[2025] Thi thử TN sở GDĐT Bà Rịa Vũng Tàu (Lần 2)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 126
⇒ Đề thi, đáp án và giải chi tiết:
| 1D | 2A | 3C | 4C | 5B | 6A | 7B | 8D | 9D |
| 10B | 11C | 12B | 13B | 14D | 15C | 16D | 17A | 18B |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | Đ | Đ | S | Đ | 5 | 8 | 4 |
| (b) | Đ | Đ | S | S | 26 | 27 | 28 |
| (c) | S | Đ | Đ | S | 42,1 | 1,93 | 7,8 |
| (d) | Đ | Đ | Đ | S |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Nhúng đầu que đốt bằng platium đã được rửa sạch bằng nước vào dung dịch lithium chloride (LiCl) bão hoà rồi đưa lên ngọn lửa đèn khí sẽ thấy ngọn lửa có màu
A. tím nhạt. B. xanh lam. C. vàng. D. đỏ tía.
(Xem giải) Câu 2. Polypropylene là chất dẻo được sử dụng phổ biến thứ 2 sau polyethylene. Trùng hợp chất nào sau đây thu được polypropylene?
A. CH2=CH–CH3. B. CH2=CH2. C. CH2=CH–Cl. D. CH2=CH–C6H5.
(Xem giải) Câu 3. Nguyên tố potassium (K) có số hiệu nguyên tử là 19. Ở trạng thái cơ bản, cấu hình electron của ion K+ là
A. 1s2 2s2 2p6 3s2 3p6 3d1. B. 1s2 2s2 2p6 3s2 3p6 4s2.
C. 1s2 2s2 2p6 3s2 3p6. D. 1s2 2s2 2p6 3s2 3p6 4s1.
(Xem giải) Câu 4. Cho các chất sau: CH3COOH (1), CH3CH2COOH (2), CH3COOCH3 (3), CH3CH2CH2OH (4). Dãy gồm các chất được sắp xếp theo chiều giảm dần nhiệt độ sôi từ trái sang phải là
A. (1) > (3) > (4) > (2). B. (3) > (1) > (4) > (2).
C. (2) > (1) > (4) > (3). D. (3) > (1) > (2) > (4).
(Xem giải) Câu 5. Thực hiện phản ứng sau: 2[Fe(CN)6]4-(X) + Cl2 → 2[Fe(CN)6]3-(Y) + 2Cl-. Phát biểu nào sau đây không đúng?
A. X và Y đều có dạng hình học bát diện.
B. Phản ứng chuyển X thành Y thuộc loại phản ứng thế phối tử.
C. Phản ứng trên là một phản ứng oxi hóa – khử.
D. Ion trung tâm của X và Y lần lượt là Fe2+ và Fe3+.
(Xem giải) Câu 6. Nhúng thanh kẽm (Zn) và thanh đồng (Cu) vào dung dịch H2SO4 loãng, nối 2 thanh lại với nhau bằng dây dẫn như hình bên dưới.
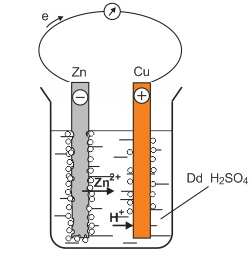
Phát biểu nào sau đây đúng?
A. Khí thoát ra ở 2 điện cực là khí hydrogen.
B. Nếu không có sợi dây dẫn nối 2 điện cực với nhau thì thanh Zn sẽ không bị ăn mòn.
C. Cực âm gọi là cathode do xảy ra quá trình nhường electron.
D. Thanh Zn bị mòn dần, đồng thời xuất hiện dòng electron di chuyển từ cathode sang anode.
(Xem giải) Câu 7. Công thức cấu tạo thu gọn của methylpropionate là
A. CH3COOCH2CH3. B. CH3CH2COOCH3.
C. CH3CH2COOC6H5. D. CH3COOCH2CH2CH3.
(Xem giải) Câu 8. Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
| Cặp oxi hóa – khử | Zn2+/Zn | Fe2+/Fe | Cu2+/Cu | Ag+/Ag |
| Thế điện cực chuẩn (V) | -0,76 | -0,44 | +0,34 | +0,80 |
Pin Galvani thiết lập từ hai cặp oxi hóa – khử nào trong số các cặp trên có sức điện động chuẩn bằng 1,24 V?
A. Fe-Cu. B. Zn-Fe. C. Zn-Ag. D. Fe-Ag.
(Xem giải) Câu 9. Cho các phát biểu sau về nước cứng:
(a) Nước cứng có thể là nguyên nhân gây nổ nồi hơi.
(b) Nước cứng là tác nhân gây ô nhiễm nguồn nước hiện nay.
(c) Vôi tôi có thể được dùng để làm mềm nước cứng toàn phần.
(d) Phương pháp trao đổi ion có thể làm mềm tất cả các loại nước cứng.
(đ) Nước mềm không gây nhiều tác hại như nước có tính cứng vĩnh cửu hay nước cứng toàn phần.
Số phát biểu đúng là
A. 5. B. 2. C. 4. D. 3.
(Xem giải) Câu 10. Khi đun nóng ester của acetic acid trong dung dịch NaOH xảy ra phản ứng hoá học sau:
CH3COOR + NaOH → CH3COONa + ROH (∗)
Cơ chế của phản ứng xảy ra như sau:
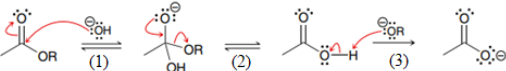
Nhận định nào sau đây không đúng?
A. Giai đoạn (3) là phản ứng acid-base theo bronsted – Lowry.
B. Giai đoạn (2) có sự thay thế nhóm OH bằng nhóm OR.
C. Giai đoạn (1) có sự phá vỡ liên kết π hình thành liên kết σ.
D. Phản ứng (∗) là phản ứng thuỷ phân ester trong môi trường kiềm.
(Xem giải) Câu 11. Một loại phân bón cung cấp cho cây trồng nguyên tố nitrogen, có vai trò thúc đẩy quá trình tăng trưởng của cây, giúp cây đẻ nhánh khỏe, ra lá nhiều, có khả năng quang hợp tốt,… làm tăng năng suất cây trồng. Loại phân đó là
A. phân lân. B. phân kali. C. phân đạm. D. phân vi lượng.
(Xem giải) Câu 12. Khí X làm đục nước vôi trong (Ca(OH)2) và được dùng làm chất tẩy trắng bột gỗ trong công nghiệp giấy. Khí X là
A. CO2. B. SO2. C. H2S. D. Cl2.
(Xem giải) Câu 13. “Điện phân là quá trình oxi hóa khử xảy ra trên bề mặt các điện cực dưới tác dụng của …(1)… đi qua dung dịch chất điện li hoặc chất điện li …(2)…”. Các từ cần điền vào vị trí (1), (2) để được phát biểu đúng lần lượt là
A. dòng điện xoay chiều, ở dạng khí. B. dòng điện một chiều, nóng chảy.
C. dòng điện một chiều, ở dạng khí. D. dòng điện xoay chiều, nóng chảy.
(Xem giải) Câu 14. Phản ứng xảy ra trong pin Galvani Zn – Cu là: Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s). Quá trình xảy ra tại anode (hay cực âm) của pin là
A. Cu2+(aq) + 2e → Cu(s). B. Cu(s) → Cu2+(aq) + 2e.
C. Zn2+(aq) + 2e → Zn. D. Zn(s) → Zn2+(aq) + 2e.
(Xem giải) Câu 15. Cho công thức cấu tạo dạng mạch vòng α-glucose như sau:
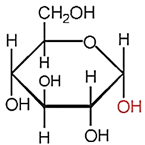
Nhóm –OH hemiacetal trong α-glucose liên kết với nguyên tử carbon số mấy?
A. 2. B. 4. C. 1. D. 3.
(Xem giải) Câu 16. Chất nào sau đây thuộc loại amine bậc 2?
A. Trimethylamine. B. Ethylamine. C. Aniline. D. Dimethylamine.
(Xem giải) Câu 17. Phản ứng nào sau đây được gọi là phản ứng ester hoá?
A. CH3COOH + CH3OH ⇋ CH3COOCH3 + H2O.
B. C17H35COONa + HCl → C17H35COOH + NaCl.
C. CH3COOC2H5 + NaOH → CH3COONa + C2H5OH.
D. CH3COOH + NaOH → CH3COONa + H2O.
(Xem giải) Câu 18. Dung dịch nào sau đây làm giấy quỳ tím đổi sang màu xanh?
A. Glutamic acid. B. Methylamine. C. Lysine. D. Aniline.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. EDTA (EthyleneDiamineTetraAcetic Acid) là một aminopolycarboxylic acid có công thức cấu tạo ở hình (1). Trong hóa học phân tích, EDTA được sử dụng trong các phép chuẩn độ và phân tích độ cứng của nước hoặc làm tác nhân che lấp để cô lập các ion kim loại sẽ can thiệp vào các phân tích nhờ vào khả năng tạo phức với ion kim loại (hình (2)).
 |
 |
| Hình 1. Phân tử EDTA | Hình 2. Phức của ion Mn+ và EDTA |
Có thể xác định số mol nước kết tinh trong một muối ngậm nước bằng phép chuẩn độ với dung dịch EDTA4-(aq) sử dụng chất chỉ thị phù hợp theo quy trình:
• Bước 1: Hòa tan 0,255 gam muối chromium (III) sulfate ngậm nước (Cr2(SO4)3.xH2O) vào nước, sau đó pha loãng đến 100 mL trong bình định mức.
• Bước 2: Lấy 25,0 mL dung dịch tạo thành đem chuẩn độ với dung dịch EDTA4- 0,00800 mol/L cho đến khi đạt điểm cuối chuẩn độ thì thể tích trung bình của dung dịch EDTA4- (sau 3 lần chuẩn độ) là 26,2 mL.
a) Công thức của muối chromium (III) sulfate ngậm nước là Cr2(SO4)3.12H2O.
b) Ion chromium (III) với EDTA tạo phức chất có điện tích là -1.
c) Liên kết tạo bởi EDTA và M là liên kết ion.
d) Công thức phân tử của EDTA là C10H16N2O8.
(Xem giải) Câu 20. Một nhóm học sinh tìm hiểu quá trình thu hồi kim loại bạc (silver) bằng phương pháp điện phân từ một món đồ trang sức bạc hợp kim (bạc 925 là hợp kim Ag-Cu chứa 92,5% Ag). Giả thuyết được nhóm đưa ra là: “Khi điện phân, bạc nguyên chất sẽ bám lên điện cực còn tạp chất không bị điện phân sẽ tan vào dung dịch hoặc kết tủa riêng biệt.” Để kiểm chứng giả thuyết, nhóm học sinh đã thực hiện thí nghiệm sau:
– Cân để xác định khối lượng ban đầu của món đồ bạc (2,50 gam) và một lá bạc tinh khiết có khối lượng 3,00 gam.
– Nối món đồ bạc với một điện cực và lá bạc tinh khiết với điện cực còn lại của nguồn điện một chiều, nhúng cả hai vào dung dịch silver nitrate (AgNO3).
– Tiến hành điện phân ở hiệu điện thế phù hợp và dòng điện không đổi.
– Sau một thời gian điện phân, rửa, làm khô và cân lại, thấy khối lượng món đồ bạc giảm còn 2,20 gam, khối lượng lá bạc tinh khiết tăng thành m gam.
Biết rằng:
– Silver nitrate phân ly hoàn toàn trong dung dịch: AgNO3 → Ag+ + NO3-
– Tại cực dương: Ag → Ag+ + e
Ag ưu tiên bị oxi hóa trong dung dịch AgNO3 không phải vì nó dễ nhường electron hơn Cu, mà vì môi trường dung dịch AgNO3 chỉ cho phép quá trình oxi hóa Ag diễn ra ổn định, và hệ cần duy trì ion Ag+ trong dung dịch. (Theo “Electrochemical Methods: Fundamentals and Applications” của Bard & Faulkner- Chương 7 – Điện phân dung dịch kim loại đơn ion, sự ưu tiên giải phóng kim loại tại các điện cực.)
a) Giá trị của m có thể dùng để xác định khối lượng bạc đã điện phân ra khỏi món đồ bạc.
b) Kết quả thí nghiệm cho thấy khối lượng món đồ bạc giảm, lá bạc tinh khiết tăng khối lượng, phù hợp với giả thuyết về việc Ag bị oxi hóa và bám lên điện cực.
c) Trong thí nghiệm trên, món đồ bạc được nối với cực dương của nguồn điện.
d) Tại lá bạc tinh khiết (cực âm) xảy ra quá trình khử ion bạc thành bạc kim loại.
(Xem giải) Câu 21. Glucose là một monosacchride quan trọng đối với con người và được cung cấp dưới dạng thực phẩm, dược phẩm. Một nhóm học sinh tiến hành xác định hàm lượng glucose trong một loại đường glucose y tế dựa trên phản ứng oxi hoá glucose bằng lượng dư I2 0,10M (trong KI) sau đó chuẩn độ I2 dư với chỉ thị hồ tinh bột bằng dung dịch chuẩn là Na2S2O3 0,1M theo các phương trình hoá học đã biết như sau:
(1) HOCH2(CHOH)4CHO + I2 + 3NaOH → HOCH2(CHOH)4COONa + 2NaI + 2H2O;
(2) I2 (dư) + 2Na2S2O3 (H+) → Na2S4O6 + 2NaI.
Giả thuyết của nhóm học sinh đưa ra là: “có thể xác định được lượng glucose trong mẫu thử thông qua thể tích đã tiêu thụ của dung dịch I2 và dung dịch Na2S2O3 theo phương trình phản ứng (1) và (2)”
Để kiểm tra giả thuyết, nhóm học sinh đã tiến hành thí nghiệm ở nhiệt độ thường như sau:
• Bước 1: Cân chính xác 1,0 gam mẫu đường y tế và hoà vào nước, thêm nước để được 100 mL (dung dịch X).
• Bước 2: Lấy 10 mL dung dịch X vào cốc thuỷ tinh, thêm tiếp 15 mL dung dịch I2 0,10M và kiềm hoá ngay lập tức bằng 5 mL dung dịch NaOH 1M, khuấy đều hỗn hợp được dung dịch Y.
• Bước 3: Thêm dung dịch HCl 1M vào Y cho tới môi trường acid, chuẩn độ bằng dung dịch Na2S2O3 0,10M với chỉ thị hồ tinh bột. Thực hiện các phép chuẩn độ 3 lần. Kết quả chuẩn độ ở ba lần thí nghiệm như sau:
| Thí nghiệm | 1 | 2 | 3 |
| Thể tích dung dịch Na2S2O3 (mL) | 20,1 | 20,0 | 19,9 |
a) Nếu mẫu glucose y tế bị lẫn một lượng nhỏ fructose, thì kết quả xác định hàm lượng glucose sẽ bị tính thấp hơn thực tế vì fructose cũng phản ứng với iodine và tiêu tốn iodine dư.
b) Mục đích của việc thêm HCl trước khi chuẩn độ bằng Na2S2O3 là để dừng phản ứng oxy hóa glucose và giải phóng iodine tự do (I2).
c) Nếu thêm hồ tinh bột vào ngay từ đầu trước khi thêm Iodine ở bước 2, hồ tinh bột tạo phức với iodine, làm khó quan sát và ảnh hưởng tới độ chính xác chuẩn độ.
d) Từ kết quả thí nghiệm, học sinh xác định được glucose trong mẫu đường glucose y tế là 90% theo khối lượng.
(Xem giải) Câu 22. Menthol là một hợp chất hữu cơ phân tử chỉ chứa C, H và O. Qua nghiên cứu thực nghiệm, người ta thu được các kết quả:
(1) Menthol phản ứng với sodium (Na) giải phóng khí hydrogen (H2).
(2) Menthol không làm mất màu dung dịch bromine (Br2) trong nước.
(3) Khi oxi hóa nhẹ menthol, thu được một hợp chất thuộc loại ketone có công thức phân tử C10H18O.
(4) Menthol không phản ứng với dung dịch silver nitrate trong ammonia (không tham gia phản ứng tráng bạc).
(5) Phổ hấp thụ hồng ngoại (IR) cho thấy vạch hấp thụ mạnh tại khoảng 3300 cm⁻¹.
(6) Phổ khối lượng (MS) cho thấy peak ion phân tử có m/z lớn nhất bằng 156.
Cho biết số sóng hấp thu thụ đặc trưng của một số liên kết trên phổ hồng ngoại (IR) như sau:
| Liên kết | O – H | C – H | C = O | C = C |
| Số sóng (cm-1) | 3600 – 3300 | 3000 – 2700 | 1750 – 1700 | 1680 -1600 |
a) Phổ khối (MS) cho thấy menthol có khối lượng mol bằng 156 g/mol, phù hợp với công thức phân tử C10H20O.
b) Menthol có cấu trúc mạch hở, không vòng.
c) Trong phân tử Menthol có chứa cả nhóm chức alcohol (–OH) và nhóm carbonyl (C=O).
d) Trong phân tử Menthol có chứa liên kết đôi C=C.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Số đồng phân amino acid có công thức phân tử C4H9O2N là bao nhiêu?
(Xem giải) Câu 24. Acarol được bán dưới dạng thuốc trừ sâu để sử dụng với cây ăn quả và rau. Công thức cấu tạo của acarol như hình dưới đây.

Giai đoạn cuối cùng của quá trình sản xuất acarol là quá trình ester hóa. Hãy cho biết trong một phân tử alcohol được dùng để tạo thành ester trên có bao nhiêu nguyên tử hydrogen?
(Xem giải) Câu 25. Tiến hành các thí nghiệm sau:
(1) Cho mẩu nhỏ Na vào cốc đựng nước dư.
(2) Điện phân dung dịch KCl bão hoà, có màng ngăn điện cực.
(3) Cho dung dịch H2SO4 vào dung dịch Ba(HCO3)2.
(4) Đun sôi dung dịch gồm CaCl2 và NaHCO3.
Trong các thí nghiệm trên, có bao nhiêu thí nghiệm tạo ra chất khí?
(Xem giải) Câu 26. Tiến hành sấy các mẫu Iron(II) sulfate heptahydrate (FeSO4.7H2O) với độ tinh khiết 99,99% với các khoảng nhiệt độ tăng dần và xử lý số liệu thu được đồ thị như sau:

Phần trăm về khối lượng oxygen trong hợp chất FeSO4.zH2O là bao nhiêu? (làm tròn kết quả đến phần mười).
(Xem giải) Câu 27. Một nhà máy sản xuất màng bọc thực phẩm sinh học từ tinh bột khoai mì. Khoai mì chứa 80% tinh bột. Quá trình sản xuất bao gồm các bước: thủy phân tinh bột thành glucose bằng enzyme, lên men glucose thành lactic acid, trùng ngưng lactic acid thành PLA. Hiệu suất của các quá trình lần lượt là 90%, 85% và 95%. Khối lượng tinh bột khoai mì cần thiết để sản xuất 1 tấn màng bọc PLA là a (tấn). Giá trị của a là bao nhiêu? (chỉ làm tròn kết quả ở bước cuối cùng và làm tròn kết quả đến hàng phần trăm).
(Xem giải) Câu 28. Sự có mặt của khí SO2 trong không khí là nguyên nhân chính gây ra hiện tượng mưa acid. Nồng độ của SO2 có thể xác định bằng cách chuẩn độ với dung dịch potassium permanganate theo phản ứng sau:
aSO2 + bKMnO4 + cH2O → dK2SO4 + eMnSO4 + fH2SO4
(a, b, c, d, e, f là hệ số nguyên tối giản)
Biết một mẫu không khí phản ứng vừa đủ với 8,15 ml dung dịch KMnO4 0,006 M. Khối lượng của SO2 có trong mẫu không khí đó là bao nhiêu miligam (mg)? (Chỉ làm tròn một phép tính cuối cùng và làm tròn kết quả đến hàng phần mười).


Bình luận