[2025] Thi thử TN sở GDĐT Nam Định (Lần 1)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 104
⇒ Đề thi, đáp án và giải chi tiết:
| 1D | 2B | 3A | 4B | 5A | 6D | 7B | 8D | 9A |
| 10A | 11A | 12B | 13C | 14B | 15D | 16D | 17A | 18B |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | S | Đ | Đ | Đ | 6 | 235 | 289 |
| (b) | Đ | S | Đ | Đ | 26 | 27 | 28 |
| (c) | Đ | Đ | S | Đ | 14 | 4 | 3214 |
| (d) | Đ | S | S | S |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Khi tiếp xúc trực tiếp với dung dịch HNO3 đặc, da tay của chúng ta bị chuyển sang màu vàng do dung dịch HNO3 phản ứng với thành phần nào của da tay?
A. Vitamin. B. Carbohydrate. C. Chất béo. D. Protein.
(Xem giải) Câu 2. Phức chất cisplatin được dùng làm thuốc chữa bệnh ung thư có công thức phân tử là [PtCl2(NH3)2]. Số phối tử trong phức chất cisplatin là
A. 1. B. 4. C. 3. D. 2.
(Xem giải) Câu 3. Trong các hợp chất dưới đây, hợp chất nào không phản ứng với dung dịch nitrous acid ở nhiệt độ thường, cho sản phẩm khí nitrogen?
A. (CH3)3N. B. CH3CH2NH2. C. (CH3)2CHCH2NH2. D. CH3NH2.
(Xem giải) Câu 4. Một mẫu chất lỏng không màu (kí hiệu là chất X) không nhãn, nghi ngờ là một trong số bốn chất sau: ethanol, acetic acid, methyl acetate, hexane. Khảo sát phổ IR của X thu được kết quả như sau:
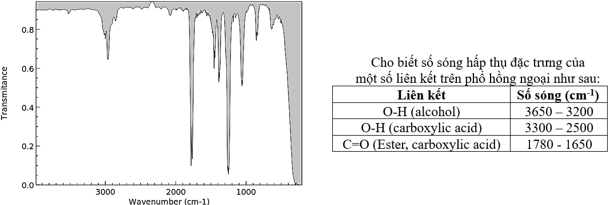
Hợp chất X là
A. hexane. B. methyl acetate. C. ethanol. D. acetic acid.
(Xem giải) Câu 5. Linoleic acid có tác dụng ngăn ngừa các bệnh về tim. Công thức cấu tạo của linoleic acid như sau:

Linoleic acid thuộc loại
A. acid béo omega-6. B. acid béo no. C. acid béo omega-9. D. acid béo omega-3.
(Xem giải) Câu 6. Cho các nguyên tố kim loại sau: K, Ba, Na, Mg, Cr và Fe. Có bao nhiêu nguyên tố kim loại trong dãy trên thể hiện nhiều số oxi hóa dương khác nhau?
A. 3. B. 1. C. 4. D. 2.
(Xem giải) Câu 7. Khi thủy phân chất béo X bằng dung dịch NaOH dư, đun nóng, ngoài glycerol, chỉ thu được một muối duy nhất là sodium oleate. Phân tử khối của X là
A. 878. B. 884 C. 806. D. 890.
(Xem giải) Câu 8. Thực tế, một số biện pháp để hạn chế sự ăn mòn điện hóa tác động đến các vật dụng bằng kim loại như sau:
(a) Máy bay hết hạn sử dụng được bảo quản ở sa mạc.
(b) Quét sơn kín bề mặt hàng rào bằng thép.
(c) Hàn khối kẽm lên mặt ngoài của vỏ tàu biển (phần chìm dưới nước).
(d) Rửa sạch và lau khô dao bằng thép sau khi thái, cắt hoa quả.
(đ) Tráng kẽm lên vật liệu thép để sản xuất tấm tôn lợp nhà.
Trong số các biện pháp trên, những trường hợp nào có mục đích hạn chế (hoặc ngăn cản) sự tiếp xúc của kim loại với dung dịch điện ly?
A. (b) và (đ). B. (b), (c), (d) và (đ).
C. (b), (c) và (d). D. (a), (b), (d) và (đ).
(Xem giải) Câu 9. Để tránh bị nấm, mốc,… khi bảo quản lâu dài, dược liệu đông y được xông khí sulfur dioxide. Khí sulfur dioxide có công thức hóa học là
A. SO2. B. CO. C. CO2. D. SO3.
(Xem giải) Câu 10. Phản ứng giữa ethylene với dung dịch H2SO4 loãng, đun nóng, diễn ra theo cơ chế như sau:
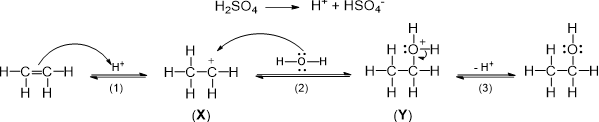
Số hiệu nguyên tử của các nguyên tố: 1H; 6C; 8O. Cho các nhận xét sau đây:
(a) Ở giai đoạn (1), liên kết π giữa hai nguyên tử carbon bị phân cắt.
(b) Trong cation X có 6 cặp electron liên kết.
(c) Trong cation Y, nguyên tử oxygen không thỏa mãn quy tắc octet.
(d) Ion H+ đóng vai trò xúc tác cho phản ứng giữa ethylene và nước.
(đ) Nếu thay thế dung dịch H2SO4/H2O bằng dung dịch D2SO4/D2O (D là đồng vị deuterium của hydrogen, tính chất hóa học giống hydrogen) sẽ thu được sản phẩm chính là CH3-CHD-OD.
Số nhận xét đúng là
A. 3. B. 6. C. 4. D. 5.
(Xem giải) Câu 11. Trong công nghiệp, kim loại kẽm được tách từ quặng sphalerite (thành phần chính là ZnS) theo sơ đồ sau:
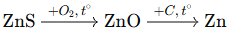
Phương pháp tách kim loại đã được sử dụng trong quá trình trên là
A. phương pháp nhiệt luyện. B. phương pháp điện phân nóng chảy.
C. phương pháp thủy luyện. D. phương pháp điện phân dung dịch.
(Xem giải) Câu 12. Dung dịch saccharose có phản ứng
A. với thuốc thử Tollens tạo thành kim loại Ag.
B. hòa tan Cu(OH)2 tạo thành dung dịch màu xanh lam.
C. với dung dịch I2 tạo thành dung dịch màu xanh tím.
D. làm mất màu dung dịch nước bromine.
(Xem giải) Câu 13. Hợp chất nào sau đây được sử dụng làm phân bón kali?
A. Na2CO3. B. Ca(HCO3)2. C. KCl. D. Mg(NO3)2.
(Xem giải) Câu 14. Nước cứng là loại nước chứa nhiều cation
A. Cu2+, Ag+. B. Mg2+, Ca2+. C. Na+, K+. D. Fe2+, Fe3+.
(Xem giải) Câu 15. Thiết lập pin Galvani như hình ảnh sau đây:

Khi pin hoạt động, tại anode xảy ra quá trình
A. Cu → Cu2+ + 2e. B. Zn2+ + 2e → Zn.
C. Cu2+ + 2e → Cu. D. Zn → Zn2+ + 2e.
(Xem giải) Câu 16. Khi cho lá chè ủ với nước sôi trong vài phút sẽ được nước chè xanh. Quá trình tách hợp chất hữu cơ từ lá chè xanh ở trên được gọi là phương pháp
A. kết tinh. B. chưng cất thường. C. cô cạn. D. chiết lỏng – rắn.
(Xem giải) Câu 17. Phản ứng chuyển hóa vinyl chloride thành poly(vinyl chloride) (có mặt chất xúc tác, đun nóng) được gọi là
A. phản ứng trùng hợp. B. phản ứng trùng ngưng.
C. phản ứng ester hóa. D. phản ứng thủy phân.
(Xem giải) Câu 18. Tiến hành điện phân dung dịch CuSO4 dư bằng dòng điện một chiều, điện cực trơ. Khi phản ứng điện phân xảy ra, nhận xét nào sau đây đúng?
A. nồng độ mol của Cu2+ trong dung dịch không đổi.
B. ở anode xảy ra sự oxi hóa nước.
C. độ pH của dung dịch tăng dần.
D. xuất hiện khí thoát ra ở cathode.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Trong công nghiệp, kim loại magnesium (Mg) được sản xuất từ carnalite (công thức hóa học là KCl.MgCl2.6H2O) bằng phương pháp điện phân nóng chảy. Trước khi điện phân, carnalite được nung nóng để loại bỏ bớt hơi nước. Khi điện phân nóng chảy, KCl có tác dụng hạ nhiệt độ nóng chảy của MgCl2 giúp giảm chi phí sản xuất. Sơ đồ thiết bị mô tả quá trình điện phân như sau:
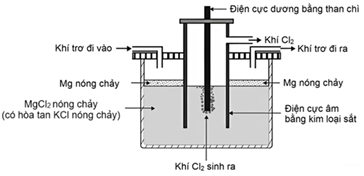
a) Khí trơ được sử dụng trong quá trình điện phân trên là khí oxygen.
b) Nếu sử dụng điện cực dương bằng sắt, điện cực đó sẽ bị phá hủy do hiện tượng ăn mòn hóa học.
c) Bằng phương pháp trên, từ 1,0 tấn carnalite (chỉ chứa KCl.MgCl2.6H2O) thu được 82 kg kim loại magnesium khi hiệu suất của quá trình sản xuất đạt 95% (kết quả làm tròn đến hàng đơn vị).
d) Khối lượng riêng của kim loại Mg nóng chảy thấp hơn so với hỗn hợp MgCl2, KCl nóng chảy.
(Xem giải) Câu 20. Trong công nghiệp, thuốc nổ trinitrotoluene (kí hiệu là TNT) được điều chế từ toluene bằng phản ứng nitro hóa (với HNO3) qua ba giai đoạn như sau:
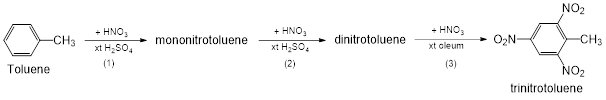
Kí hiệu xt là xúc tác. Khi TNT(s) nổ, giả thiết chỉ xảy ra phản ứng:
TNT(s) → CO(g) + H2O(g) + N2(g) + C(s)
Carbon sinh ra ở dạng muội than. Ở đkc, khi 1,0 mol TNT(s) nổ theo phản ứng trên sẽ tỏa ra lượng nhiệt là 1477,6kJ. Cho giá trị nhiệt hình thành của các chất
| Chất | TNT(s) | CO(g) | H2O(g) | C(s) muội than |
| – 67 | -283 | -241,8 | x |
a) Giá trị của x là +14,4.
b) Ở giai đoạn 1, phản ứng sinh ra năm sản phẩm đồng phân mononitrotoluene.
c) Khi TNT nổ theo phản ứng trên, 1 mol TNT sẽ sinh ra 11 mol sản phẩm.
d) Công thức phân tử của dinitrotoluene là C7H7N2O4.
(Xem giải) Câu 21. Tiến hành thí nghiệm thủy phân cellulose (bông) bằng dung dịch acid (H2SO4 70%) như hình mô tả sau đây:
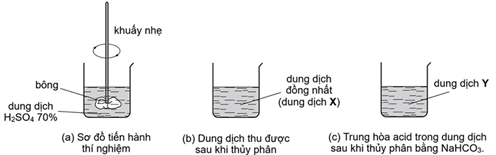
Dung dịch Y có chứa hỗn hợp các monosaccharide, disaccharide, trisaccharide,… do phản ứng thủy phân xảy ra chưa hoàn toàn.
a) Dung dịch X chứa monosaccharide duy nhất là glucose.
b) Dung dịch Y làm mất màu dung dịch nước bromine.
c) Để tăng tốc độ và hiệu suất phản ứng thủy phân cellulose, thay dung dịch H2SO4 70% bằng dung dịch H2SO4 98%.
d) Disaccharide trong dung dịch Y là maltose.
(Xem giải) Câu 22. Một nhóm học sinh dự đoán “dung dịch copper (II) sulfate phản ứng được với dung dịch ammonia (do có tính base) nhưng không phản ứng được với dung dịch HCl (do không sinh ra sản phẩm kết tủa hoặc khí)”. Từ đó, học sinh tiến hành thí nghiệm sau:
– Hòa tan chất rắn màu trắng CuSO4 khan vào nước thu được dung dịch màu xanh (dung dịch A).
– Thêm vài giọt dung dịch ammonia vào dung dịch A thấy xuất hiện kết tủa B màu xanh nhạt. Sau phản ứng thu được hỗn hợp gồm dung dịch và kết tủa B có công thức [Cu(OH)2(OH2)4] (hỗn hợp C).
– Thêm tiếp dung dịch ammonia dư vào hỗn hợp C thấy kết tủa tan, tạo thành dung dịch đồng nhất màu xanh lam (dung dịch D) chứa phức [Cu(NH3)4(OH2)2]2+.
– Cho dung dịch HCl đặc vào dung dịch A thấy dung dịch chuyển sang màu vàng (dung dịch E) chứa phức [CuCl4]2-.
a) Dung dịch A chứa phức aqua có công thức [Cu(OH2)6]2+.
b) Trong phân tử phức kết tủa B, có chứa hai loại phối tử khác nhau.
c) Từ kết quả thí nghiệm chứng tỏ dung dịch copper (II) sulfate có xảy ra phản ứng với dung dịch HCl đặc.
d) Khi xảy ra phản ứng giữa dung dịch ammonia dư và hỗn hợp C, có sự thay thế 4 phối tử nước trong phức kết tủa B bằng 4 phối tử ammonia.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Dung dịch X chứa một chất tan trong số các chất sau: NaOH (1), NaHCO3 (2), Na2CO3 (3), Na2SO4 (4), KOH (5), KHCO3 (6), K2SO4 (7). Dùng đũa platium nhúng vào dung dịch X, hơ lên ngọn lửa thấy ngọn lửa có màu tím. Nhỏ dung dịch X vào dung dịch HCl thấy có khí không màu thoát ra. Dung dịch X hòa tan muối có kí hiệu số bao nhiêu trong dãy trên?
(Xem giải) Câu 24. Hợp chất hữu cơ E mạch hở có công thức phân tử C5H10O4. Cho phương trình phản ứng (đã cân bằng phương trình) chuyển hóa E như sau:
E + NaOH (t°) → A1 + A2
A1 + HCl → A3 + NaCl
A2 + 3A3 (t°, xt) ⇋ A4 + 3H2O
Dung dịch mỗi chất tan E, A2 và A3 đều có khả năng hòa tan Cu(OH)2. Hợp chất A4 có công thức phân tử C9H14O6. Cho các nhận xét sau đây:
(1) Phân tử E có chứa hai nhóm methyl (CH3-).
(2) Tại điều kiện thường (25°C, 1 bar), hợp chất A1 ở trạng thái rắn.
(3) Phân tử khối của A2 là 92.
(4) A3 có tham gia phản ứng iodoform (với dung dịch I2/NaOH) cho kết tủa vàng.
(5) A4 là hợp chất đa chức.
Có những nhận xét nào đúng? (Các nhận xét đúng phải xếp theo thứ tự từ nhỏ đến lớn, viết liền. Ví dụ: 1234; 145;…)
(Xem giải) Câu 25. Để xác định độ tan của muối ammonium chloride trong nước ở nhiệt độ xác định, có thể tiến hành và thu được kết quả như sau:
• Bước 1: Hòa tan một lượng dư NH4Cl vào nước thu được dung dịch bão hòa. Duy trì dung dịch ở nhiệt độ cần xác định ở trên. Hút lấy 5,0 mL dung dịch bão hòa cho vào bình định mức 250 mL, thêm nước vào để được 250 mL dung dịch NH4Cl (kí hiệu là dung dịch A).
• Bước 2: Hút lấy 20,0 mL dung dịch A, cho vào bình tam giác có chứa sẵn 10,0 mL dung dịch NaOH 0,40M, lắc đều và đun nóng nhẹ đến khi để giấy quỳ tím ẩm trên miệng bình tam giác, quỳ tím không đổi màu (thu được dung dịch B).
• Bước 3: Để nguội dung dịch trong bình tam giác về nhiệt độ thường. Thêm vài giọt dung dịch phenolphthalein vào dung dịch B. Cho dung dịch HCl 0,125M vào burette, hiệu chỉnh về vạch 0.
• Bước 4: Nhỏ từ từ dung dịch HCl vào dung dịch trong bình tam giác đến khi dung dịch chuyển từ màu hồng sang không màu thì dừng lại, thấy dùng hết 14,7 mL dung dịch HCl.
Tính độ tan của NH4Cl theo đơn vị g/L ở nhiệt độ thí nghiệm trên. (Kết quả làm tròn đến hàng đơn vị)
(Xem giải) Câu 26. Thực hiện phản ứng trùng hợp hỗn hợp hai hydrocarbon X và Y (có mặt xúc tác, đun nóng) thu được polymer T. Một đoạn mạch polymer T có công thức cấu tạo như sau:
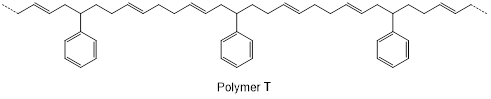
Tổng số nguyên tử hydrogen có trong một phân tử X và một phân tử Y là bao nhiêu?
(Xem giải) Câu 27. Cho các kim loại Na, Fe, Cu, Zn, Mg, Ag. Có bao nhiêu kim loại trong dãy trên tan trong dung dịch HCl?
(Xem giải) Câu 28. Các kim loại có tính khử mạnh thường tạo thành các hợp chất bền hơn so với các kim loại có tính khử yếu. Hãy sắp xếp nhiệt độ phân hủy của các muối carbonate sau đây theo thứ tự tăng dần: calcium carbonate (1), magnesium carbonate (2), silver carbonate (3), sodium carbonate (4). (Thứ tự các muối biểu diễn bằng kí hiệu số tương ứng, viết liền, gồm 4 số. Ví dụ: 1324; 2143;…)


Bình luận