[2025] Thi thử TN sở GDĐT Yên Bái (Lần 1 – Đề 2)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 128
⇒ Đề thi, đáp án và giải chi tiết:
| 1A | 2A | 3A | 4A | 5B | 6C | 7D | 8C | 9C |
| 10B | 11B | 12A | 13C | 14B | 15C | 16C | 17A | 18D |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | S | Đ | Đ | S | 740 | 15 | 881 |
| (b) | S | Đ | S | S | 26 | 27 | 28 |
| (c) | S | S | Đ | S | 4 | 124 | 2 |
| (d) | Đ | S | S | Đ |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Một pin Galvani được thiết lập ở điều kiện chuẩn theo sơ đồ bên.
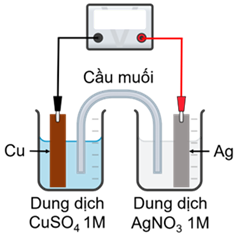
Phát biểu đúng là
A. Phản ứng hoá học xảy ra trong pin là Cu + 2Ag+ → Cu2+ + 2Ag.
B. Thanh Cu đóng vai trò là cathode và xảy ra quá trình Cu → Cu2+ + 2e.
C. Thanh Ag đóng vai trò là anode và xảy ra quá trình Ag+ + 1e → Ag.
D. Các electron theo dây dẫn di chuyển từ thanh Ag sang thanh Cu.
(Xem giải) Câu 2. Cho các phát biểu sau về kim loại nhóm IA:
(1) Nguyên tử potassium có một electron lớp ngoài cùng.
(2) Trong tự nhiên, các nguyên tố kim loại nhóm IA tồn tại ở dạng đơn chất và hợp chất.
(3) Nhiệt độ nóng chảy của các kim loại từ lithium đến caesium biến đổi theo xu hướng giảm dần.
(4) Tính khử của sodium mạnh hơn lithium.
Số phát biểu đúng là
A. 3. B. 1. C. 4. D. 2.
(Xem giải) Câu 3. Điểm chớp cháy của chất cháy là nhiệt độ thấp nhất ở áp suất khí quyển mà chất cháy bị đốt nóng tới mức tạo ra lượng hơi đủ lớn để bốc cháy trong không khí khi gặp nguồn lửa. Điểm chớp cháy được sử dụng để phân biệt chất lỏng dễ cháy với chất lỏng có thể gây cháy, chất lỏng có điểm chớp cháy nhỏ hơn 37,8°C được gọi là chất lỏng dễ cháy, chất lỏng có điểm chớp cháy lớn hơn 37,8°C được gọi là chất lỏng có thể gây cháy. Cho số liệu về điểm chớp cháy của một số chất trong bảng sau:
| Chất | Điểm chớp cháy (°C) | Chất | Điểm chớp cháy (°C) |
| Propane | -105 | Ethylene glycol | 111 |
| Pentane | -49 | Diethyl ether | -45 |
| Hexane | -22 | Acetaldehyde | -39 |
| Ethanol | 13 | Stearic acid | 196 |
| Methanol | 11 | Trimethylamine | -7 |
Trong bảng trên, số chất lỏng có thể gây cháy là
A. 2. B. 5. C. 4. D. 3.
(Xem giải) Câu 4. Cho thế điện cực chuẩn của một số cặp oxi hoá – khử ở bảng sau:
| Cặp oxi hoá – khử | Na+/Na | Zn2+/Zn | Fe2+/Fe | 2H+/H2 | Cu2+/Cu | Ag+/Ag |
| E°(V) | -2,713 | -0,763 | -0,440 | 0,00 | +0,340 | +0,799 |
Trong số các kim loại Na, Zn, Fe, Cu, Ag, số kim loại tác dụng được với dung dịch H2SO4 loãng tạo khí H2 là
A. 3. B. 4. C. 2. D. 5.
(Xem giải) Câu 5. Methylamine có công thức cấu tạo là
A. (CH3)2NH. B. CH3NH2. C. C2H5NH2. D. (CH3)3N.
(Xem giải) Câu 6. Trong thực tiễn, baking soda được sử dụng làm bột nở trong chế biến thực phẩm và làm chất chữa cháy dạng bột. Baking soda có công thức là
A. Na2CO3. B. NaHSO4. C. NaHCO3. D. Na2SO4.
(Xem giải) Câu 7. Chromium (VI) oxide (CrO3) là chất rắn, màu đỏ thẫm, vừa là acidic oxide, vừa là chất oxi hóa mạnh. Số oxi hóa của chromium trong oxide trên là
A. +3. B. 0. C. +2. D. +6.
(Xem giải) Câu 8. Cho phương trình nhiệt hóa học: 3H2(g) + N2(g) → 2NH3(g) ![]() = -91,8 kJ
= -91,8 kJ
Lượng nhiệt tỏa ra khi dùng 9 gam H2(g) để tạo thành NH3(g) là
A. 45,9 kJ. B. 275,4 kJ. C. 137,7 kJ. D. 183,6 kJ.
(Xem giải) Câu 9. Tên gọi của ester HCOOCH2CH2CH3 là
A. ethyl formate. B. ethyl acetate. C. propyl formate. D. propyl acetate.
(Xem giải) Câu 10. α- Linolenic acid (ALA) là một acid béo được tìm thấy trong các loại hạt chia, hạt lanh, cây gai dầu, quả hạch, quả óc chó và các loại dầu thực vật phổ biến. Đây là một trong hai acid béo cần thiết cho sức khỏe, cơ thể không tự tổng hợp được mà có được thông qua ăn uống. ALA có công thức cấu tạo như bên.
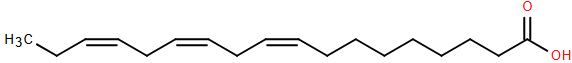
Cho các phát biểu sau:
(1) ALA thuộc loại acid béo omega-3.
(2) Một phân tử ALA chứa ba liên kết đôi C=C ở dạng cis.
(3) a mol ALA tác dụng tối đa với 4a mol H2 (xt, t°, p).
(4) Phân tử khối của triester của glycerol với ALA bằng 882 amu.
Số phát biểu đúng là
A. 3. B. 2. C. 1. D. 4.
(Xem giải) Câu 11. Tên gọi của polymer (-CH2-CH2-)n là
A. poly(vinyl chloride). B. polyethylene. C. polystyrene. D. poly(methyl methacrylate).
(Xem giải) Câu 12. Cho cân bằng hoá học: CO(g) + H2O(g) ⇌ CO2(g) + H2(g) ![]() < 0
< 0
Cân bằng trên chuyển dịch theo chiều thuận khi
A. giảm nhiệt độ của hệ. B. cho chất xúc tác vào hệ.
C. tăng áp suất chung của hệ. D. thêm khí H2 vào hệ.
(Xem giải) Câu 13. Công thức chung của alkyne là
A. CnH2n+2 (n ≥ 1). B. CnH2n (n ≥ 2). C. CnH2n-2 (n ≥ 2). D. CnH2n-6 (n ≥ 6).
(Xem giải) Câu 14. Đồng là kim loại có tính khử yếu, không tan trong dung dịch H2SO4 loãng, nhưng tan được trong dung dịch H2SO4 đặc, nóng hoặc trong dung dịch H2SO4 loãng khi có mặt của O2 ngay ở nhiệt độ thường theo các phương trình hoá học sau:
Cu + 2H2SO4 đặc (t°) → CuSO4 + SO2 + 2H2O (1)
2Cu + 2H2SO4 + O2 → 2CuSO4 + 2H2O (2)
Phát biểu đúng là
A. Ở phản ứng (2), do E°Cu2+/Cu > E°2H+/H2 nên Cu tác dụng được với dung dịch H2SO4 loãng.
B. Từ phản ứng (2) chứng tỏ E°Cu2+/Cu < E°(O2+4H+)/H2O.
C. Trong hai phản ứng trên, Cu đều bị khử.
D. Cùng một lượng CuSO4 tạo ra thì phản ứng (1) tiêu tốn H2SO4 ít hơn phản ứng (2).
(Xem giải) Câu 15. Cho phản ứng thủy phân tinh bột: (C6H10O5)n + nH2O (H+, t°) → nC6H12O6. Phản ứng trên thuộc loại phản ứng
A. trùng hợp polymer. B. tăng mạch polymer.
C. cắt mạch polymer. D. giữ nguyên mạch polymer.
(Xem giải) Câu 16. Tinh bột và cellulose là những carbohydrate thuộc loại
A. đồng đẳng. B. monosaccharide. C. polysaccharide. D. disaccharide.
(Xem giải) Câu 17. Tính chất hoá học đặc trưng của kim loại là
A. tính khử. B. tính oxi hoá. C. tính base. D. tính oxi hoá và tính khử.
(Xem giải) Câu 18. Cho các phát biểu sau:
(1) Triolein, tripalmitin là những chất béo no.
(2) Chất béo nhẹ hơn nước và không tan trong nước.
(3) Nhiệt độ sôi của CH3COOC2H5 thấp hơn nhiệt độ sôi của CH3COOH.
(4) Ester bị thủy phân trong môi trường base, đun nóng.
Số phát biểu đúng là
A. 4. B. 1. C. 2. D. 3.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Salbutamol là một hợp chất hữu cơ có hoạt tính sinh học cao. Bên cạnh tác dụng chính dùng trong y học, salbutamol còn sử dụng làm doping trong thi đấu thể thao. Theo tổ chức phòng chống Doping thế giới (WADA), vận động viên sử dụng salbutamol với liều lượng vượt quá 20 µg/kg trong vòng 24 giờ được coi là sử dụng doping. Salbutamol có công thức cấu tạo như bên.
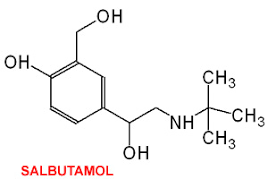
a) Một vận động viên thể thao có cân nặng 75 kg thì trong vòng 24 giờ được sử dụng liều tối đa là 1600 µg salbutamol.
b) Công thức phân tử của salbutamol là C13H23NO3.
c) Salbutamol là hợp chất hữu cơ tạp chức, chứa đồng thời 2 nhóm chức phenol, 1 nhóm chức alcohol và 1 nhóm chức amine bậc hai.
d) Salbutamol có khả năng phản ứng với dung dịch nước Br2.
(Xem giải) Câu 20. Ngô và mía là những loại cây lương thực và cây công nghiệp quan trọng, đồng thời là nguyên liệu chính được sử dụng trong sản xuất ethanol. Cellulose cũng có thể sản xuất ethanol và là nguồn nguyên liệu dồi dào, dễ tìm. Xuất phát từ loại nấm được nuôi cấy để tạo enzyme cellulase làm xúc tác cho phản ứng thuỷ phân cellulose thành glucose còn tốn kém nhiều về năng lượng nên giá thành sản xuất ethanol từ cellulose còn cao. Nhưng hướng đi này đang hứa hẹn có thể tăng hiệu suất sản xuất ethanol trong tương lai. Cellulose có cấu trúc phân tử như sau:
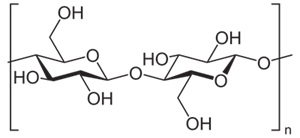
a) Cellulose là polymer tự nhiên mạch không phân nhánh.
b) Khi đun nóng cellulose với hỗn hợp HNO3 đặc và H2SO4 đặc có thể tạo thành cellulose trinitrate, dùng để chế tạo thuốc súng không khói.
c) Với những tiến bộ công nghệ đạt được, người ta tin rằng 1 tấn cellulose sắp tới có thể tạo được 400 lít ethanol. Biết khối lượng riêng của ethanol là 0,79 g/mL. Hiệu suất của quá trình điều chế ethanol từ cellulose đạt được khi đó là 63,5%.
d) Cellulose có nhiều trong trái cây chín.
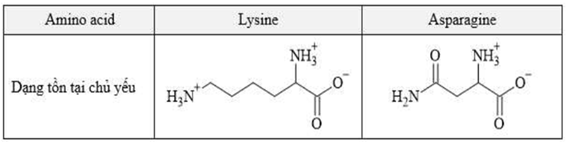
(Xem giải) Câu 21. Hỗn hợp dipeptide Lys-Asn và hai amino acid thành phần (lysine và asparagine) được phân tách bằng phương pháp điện di trong dung dịch đệm pH = 5. Tại điều kiện này, lysine và asparagine tồn tại chủ yếu ở các dạng sau:
Kết quả tiến hành điện di được thể hiện trong hình dưới đây:
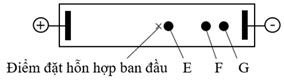
a) Tại môi trường pH = 5, lysine tồn tại chủ yếu dưới dạng cation.
b) Chất F là lysine.
c) Chất có điện tích dương càng lớn, càng dễ di chuyển về phía cực âm.
d) Chất E có thể là dipeptide Lys-Asn do có phân tử khối lớn.
(Xem giải) Câu 22. Tiến hành thí nghiệm điện phân dung dịch CuSO4 theo các bước sau:
• Bước 1: Lắp thiết bị thí nghiệm điện phân dung dịch CuSO4 như hình bên.
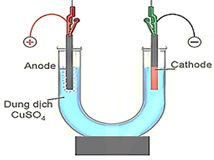
• Bước 2: Rót dung dịch CuSO4 0,2M vào ống thủy tinh hình chữ U rồi nhúng 2 điện cực bằng than chì vào dung dịch.
• Bước 3: Nối 2 điện cực than chì với hai cực của nguồn điện có cường độ dòng điện là 1A và tiến hành điện phân.
+ Sau thời gian t giây thu được 0,0025 mol khí ở anode.
+ Sau thời gian 3t giây thu được 0,0125 mol khí thoát ra ở cả hai điện cực.
Biết hằng số Faraday F = 96485C/mol.
a) Tại anode xảy ra quá trình oxi hoá ion SO42- và tạo thành khí O2.
b) Để mạ đồng lên chiếc chìa khóa bằng sắt theo phương pháp điện phân thì trong sơ đồ thí nghiệm trên phải sử dụng cathode là thanh đồng, anode là chìa khóa và dung dịch điện phân là dung dịch CuSO4.
c) Sau 30 phút, ion Cu2+ đã bị điện phân hết.
d) Dung dịch sau điện phân làm quỳ tím chuyển đỏ.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Quặng sắt là các khoáng vật chứa các hợp chất của sắt mà chủ yếu ở dạng các oxide. Hematite là một loại quặng chứa hàm lượng sắt cao và được dùng để trực tiếp sản xuất gang bằng cách nạp thẳng vào lò cao. Giả thiết 90% sắt trong quặng được dùng để sản xuất gang. Từ 1200 tấn quặng hematite (có hàm lượng 65,8% sắt) có thể sản xuất được bao nhiêu tấn gang loại 96% sắt (làm tròn đến hàng đơn vị)?
(Xem giải) Câu 24. Trong phòng thí nghiệm, soda (Na2CO3) khi để lâu ngày bị chuyển hóa và hút ẩm tạo thành hỗn hợp X gồm Na2CO3, NaHCO3 và H2O. Hòa tan hoàn toàn một lượng X trong nước thu được 100 mL dung dịch Y. Tiến hành các thí nghiệm sau:
– Thí nghiệm 1: Cho 40 mL dung dịch HCl 1M vào 10 mL dung dịch Y, sau đó đun nhẹ. Để trung hoà dung dịch thu được cần dùng 40 mL dung dịch NaOH 0,5M.
– Thí nghiệm 2: Cho 10 mL dung dịch NaOH 1M vào 10 mL dung dịch Y, sau đó thêm tiếp dung dịch BaCl2 đến dư và lọc bỏ kết tủa. Để trung hoà nước lọc thu được cần dùng 35 mL dung dịch HCl 0,2M.
Biết các phản ứng xảy ra hoàn toàn. Phần trăm Na2CO3 đã bị chuyển hóa thành NaHCO3 là bao nhiêu?
(Xem giải) Câu 25. Chất dẻo PVC được điều chế theo sơ đồ sau:
CH4 → CH≡CH → CH2=CHCl → PVC
Biết CH4 chiếm 90% thể tích khí thiên nhiên và hiệu suất của cả quá trình là 50%. Để điều chế 500 kg PVC thì cần dùng bao nhiêu m³ khí thiên nhiên (đkc) (làm tròn đến hàng đơn vị)?
(Xem giải) Câu 26. Khảo sát một số tính chất của ba chất X, Y, Z được ghi lại trong bảng sau:
| Chất | Nhiệt độ nóng chảy (°C) | Quỳ tím |
| X | 298 | Không đổi màu |
| Y | 199 | Màu hồng |
| Z | 258 | Không đổi màu |
Biết X, Y, Z là một trong ba chất valine, alanine, glutamic acid.
Thuỷ phân hoàn toàn 1 mol peptide A thu được 2 mol X, 2 mol Y và 1 mol Z. Mặt khác, nếu thuỷ phân không hoàn toàn A thu được hỗn hợp các peptide và các α-amino acid, trong đó có tripeptide Z-X-Y. Có bao nhiêu công thức cấu tạo của A với amino acid đầu C là glutamic acid thỏa mãn tính chất trên?
(Xem giải) Câu 27. Điện phân dung dịch NaCl bão hòa là một phương pháp thu được những sản phẩm có tính ứng dụng rất cao trong ngành công nghiệp sản xuất.
– Để điều chế chlorine và xút thì trong quá trình điện phân dùng màng ngăn giữa các điện cực.
– Để điều chế nước Javel thì trong quá trình điện phân không dùng màng ngăn giữa các điện cực.
Cho các phát biểu sau:
(1) Trong hai quá trình điện phân trên, tại cathode xảy ra quá trình khử ion Na+ thành kim loại Na.
(2) Trong quá trình điện phân để điều chế nước Javel thì số mol NaCl và NaClO luôn bằng nhau.
(3) Theo thời gian, trong hai quá trình điện phân trên nồng độ ion Na+ tăng lên.
(4) Trong hai quá trình điện phân trên, pH của dung dịch đều giảm xuống.
Liệt kê các phát biểu không đúng theo số thứ tự tăng dần?
(Xem giải) Câu 28. Cho các chất sau: CH3[CH2]11OSO3Na, C15H31COONa, C17H33COOH, (CH3[CH2]16COO)2Ca, CH3[CH2]16COOK, CH3[CH2]11C6H4SO3Na. Có bao nhiêu chất dùng làm xà phòng?


Bình luận