[2026] Thi thử TN chuyên Bắc Ninh (Lần 1)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 004
⇒ Đề thi, đáp án và giải chi tiết:
| 1A | 2C | 3A | 4D | 5B | 6B | 7B | 8A | 9B |
| 10A | 11B | 12C | 13B | 14B | 15A | 16B | 17A | 18A |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | S | Đ | S | S | 6 | 84 | 6 |
| (b) | Đ | S | S | Đ | 26 | 27 | 28 |
| (c) | Đ | Đ | Đ | Đ | 0,72 | 4 | 21,5 |
| (d) | Đ | S | S | Đ |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1: Cho các phát biểu sau:
(1) Độ dinh dưỡng của phân đạm, phân lân và phân kali tính theo phần trăm khối lượng tương ứng của N2O5, P2O5 và K2O.
(2) Người ta không bón phân urea kèm với vôi.
(3) Phân lân chứa nhiều photpho nhất là supephotphate kép.
(4) Bón nhiều phân đạm amonium sẽ làm đất chua.
(5) Quặng photphorite có thành phần chính là Ca3(PO4)2.
Trong các phát biểu trên, số phát biểu đúng là
A. 4. B. 2. C. 5. D. 3.
(Xem giải) Câu 2: Có thể tạo ra một hợp chất ester X có mùi thơm giống quả táo từ sự kết hợp của methanol và butanoic acid. Công thức phân tử của ester X là
A. C3H6O2. B. C4H10O2. C. C5H10O2. D. C2H4O2.
(Xem giải) Câu 3: Cho đồ thị bên:
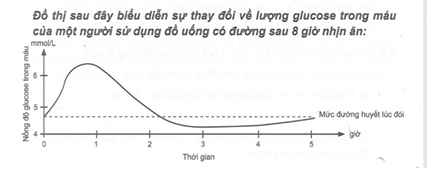
Khi sử dụng đồ uống có đường, nồng độ glucose trong máu tăng cao nhất sau khi
A. sử dụng khoảng 50 phút. B. sử dụng khoảng 2 giờ.
C. sử dụng khoảng 20 phút. D. sử dụng khoảng 3 giờ.
(Xem giải) Câu 4: Nước Javel là sản phẩm của quá trình
A. sục khí chlorine vào vôi sữa.
B. điện phân dung dịch NaOH không có màng ngăn.
C. điện phân dung dịch NaCl có màng ngăn giữa hai điện cực.
D. điện phân dung dịch NaCl không màng ngăn giữa hai điện cực.
(Xem giải) Câu 5: Khi thuỷ phân saccharose, sản phẩm thu được là
A. fructose. B. glucose và fructose.
C. tinh bột. D. glucose.
(Xem giải) Câu 6: Trong dung dịch K2Cr2O7 tồn tại cân bằng: Cr2O72- (da cam) + H2O ⇋ 2CrO42- (vàng) + 2H+. Cho vài giọt dung dịch chất X vào dung dịch K2Cr2O7 thì dung dịch chuyển dần từ màu da cam sang màu vàng. X có thể là chất nào sau đây?
A. KCl. B. KOH. C. H2SO4. D. K2SO4.
(Xem giải) Câu 7: Cho các alcohol sau: CH3OH; C2H5OH; HOCH2-CH2OH; HOCH2-CHOH-CH2OH; HOCH2-CH2-CH2OH. Số alcohol không hòa tan được Cu(OH)2 là
A. 1. B. 3. C. 4. D. 2.
(Xem giải) Câu 8: Có một loại quặng pyryte chứa 96% FeS2. Nếu mỗi ngày nhà máy sản xuất 100 tấn dung dịch sulfuric acid 98% thì cần m tấn quặng pyryte trên và biết hiệu suất của cả quá trình sản xuất H2SO4 là 90%. Giá trị của m là
A. 69,44. B. 68,44. C. 70,44. D. 67,44.
(Xem giải) Câu 9: Cho 5,6 gam CO và 5,4 gam H2O vào một bình kín dung tích không đồi 10 L. Nung nóng bình một thời gian ở 830°C để hệ đạt đến trạng thái cân bằng. Phản úng xảy ra như sau: CO(g) + H2O(g) ⇋ CO2(g) + H2(g). Biết hằng số cân bằng của phản ứng trong điều kiện trên là Kc = 1. Nồng độ của H2O ở trạng thái cân bằng là
A. 0,18. B. 0,018. C. 0,12. D. 0,012.
(Xem giải) Câu 10: Cho cân bằng hoá học: PCl5(g) ⇋ PCl3(g) + Cl2(g), ![]() > 0. Yếu tố không ảnh hưởng đến cân bằng hóa học này là
> 0. Yếu tố không ảnh hưởng đến cân bằng hóa học này là
A. Chất xúc tác. B. Nhiệt độ. C. Nồng độ. D. Áp suất.
(Xem giải) Câu 11: Cho các chất sau: H2O (1), C2H5OH (2), C6H5OH (3), CH3COOH (4). Độ linh động của nguyên tử hydrogen trong nhóm -OH tăng dần theo thứ tự là
A. (1) < (2) < (4) < (3). B. (2) < (1) < (3) < (4).
C. (1) < (2) < (3) < (4). D. (2) < (1) < (4) < (3).
(Xem giải) Câu 12: Tên gọi của CH2=CHCOOC6H5 là
A. Benzyl acrylate. B. Phenyl metacrylate.
C. Phenyl acrylate. D. Phenyl propionate.
(Xem giải) Câu 13: “Saccharose và …(1)… là hai disaccharide, có cùng công thức phân tử là …(2)…”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A. maltose, C6H12O6. B. maltose, C12H22O11.
C. cellulose, (C6H10O5)n. D. glucose, C6H12O6.
(Xem giải) Câu 14: Ester X được tạo bởi methyl alcohol và acetic acid. Công thức của X là
A. HCOOCH3. B. CH3COOCH3. C. CH3COOC2H5. D. HCOOC2H5.
(Xem giải) Câu 15: Ammonia được tạo ra bằng cách cho nitrogen phản ứng với hydrogen với sự có mặt của chất xúc tác là iron. Phương trình phản ứng tạo ammonia diễn ra như sau: N2(g) + 3H2(g) ⇋ 2NH3(g).
Biết năng lượng liên kết (Eb) ở 25°C, 1 bar của một số loại liên kết được cho trong bảng sau:
| Liên kết | N≡N | N-H | H-H |
| Năng lượng liên kết Eb (kJ/mol) | 946 | 389 | 436 |
Biến thiên enthalpy chuẩn của phản ứng (kJ) tính theo năng lượng liên kết ở điều kiện trên có giá trị là
A. -80. B. -959. C. 1476. D. 993.
(Xem giải) Câu 16: Nhiệt độ ngọn lửa là nhiệt độ cao nhất có thể tạo ra bởi phản ứng cháy của chất cháy trong không khí ở áp suất khí quyển. Nhiệt độ ngọn lửa cao nhất khi cháy trong không khí của methane khoảng 1963°C. Methane trong khí gas trộn với oxygen không khí gây nổ rất mạnh do phản ứng:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) (∗) ![]() = -571,6 kJ
= -571,6 kJ
Phản ứng này toả rất nhiều nhiệt, các sản phẩm bị đốt nóng mạnh. Cho các phát biểu sau:
(a) Tổng số mol khí trước và sau phản ứng không thay đồi.
(b) Sự nổ xảy ra là do phản ứng (∗) tỏa nhiều nhiệt, thể tích tăng đột ngột.
(c) CH4 kết hợp với O2 theo tỉ lệ khối lượng 1 : 2 sẽ tạo ra hỗn hợp nổ mạnh nhất.
(d) Việc sử dụng nước để chữa cháy nhằm mục đích hạ nhiệt độ của hỗn hợp.
Các phát biểu đúng là
A. (a), (d). B. (a), (b), (d). C. (a), (b), (c). D. (a), (c), (d).
(Xem giải) Câu 17: Phản ứng giữa ethylene với HBr: CH2 = CH2 + HBr → CH3CH2Br
Giai đoạn 1 của phản ứng là quá trình (tác nhân electrophile (∗)) phản ứng với C=C, tạo carbocation trung gian:
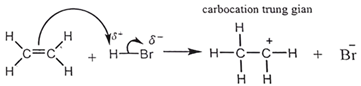
(∗) tác nhân electrophile là những chất “yêu thích” electron, chúng thường là các chất mang điện tích dương hoặc có trung tâm mang một phần điện tích duơng.
Giai đoạn 2 là quá trình kết hợp giữa carbocation với tác nhân X:
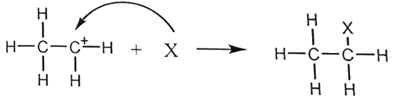
Trong các phát biểu sau, phát biểu nào đúng?
A. Hướng mũi tên cong biểu diễn sự chuyển dịch của electron.
B. Giai đoạn 2, tác nhân X phản ứng với carbocation là cation Br+.
C. Giai đoạn 1 có sự hình thành liên kết π.
D. Sản phẩm nhiều hơn chất hữu cơ ban đầu 1 liên kết σ.
(Xem giải) Câu 18: Số liên kết σ và liên kết π trong phân tử acetylene lần lượt là
A. 3 và 2. B. 2 và 1. C. 1 và 1. D. 3 và 1.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19: Đun hỗn hợp ethylene glycol và cacboxylic acid X (phân tử chỉ có nhóm -COOH) với xúc tác H2SO4 đặc, thu được hỗn hợp sản phẩm hữu cơ, trong đó có chất hữu cơ Y mạch hở. Đốt cháy hoàn toàn 3,95 gam Y cần 4,00 gam O2, thu được CO2 và H2O theo tỉ lệ mol tương ứng 2 : 1. Biết Y có công thức phân tử trùng với công thức đơn giản nhất, Y phản ứng được với NaOH theo tỉ lệ mol tương ứng 1 : 2.
a) X có đồng phân hình học.
b) Y tham gia được phản ứng cộng với Br2 theo tỉ lệ mol tương ứng 1 : 2.
c) Y không có phản ứng tráng bạc.
d) Tổng số nguyên tử hydrogen trong hai phân tử X, Y bằng 8.
(Xem giải) Câu 20: Muối Mohr có công thức (NH4)2Fe(SO4)2.6H2O. Để xác định độ tinh khiết của một loại muối Mohr (cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành các thí nghiệm sau: Cân chính xác 7,237 gam muối Mohr, pha thành 100 ml dung dịch X. Lấy chính xác 10 ml dung dịch X, thêm 10 ml dung dịch H2SO4 10%, được dung dịch Y. Chuẩn độ dung dịch Y bằng dung dịch chuẩn KMnO4 0,023M. Thực hiện chuẩn độ 3 lần. Kết quả đạt được như sau:
| Lần chuẩn độ | 1 | 2 | 3 |
| Thể tích dung dịch KMnO4 (mL) | 16,0 | 16,1 | 16,0 |
a) Dung dịch H2SO4 được thêm vào dung dịch chuẩn độ để tạo thành môi trường acid, giúp phản ứng xảy ra theo hướng tạo thành Mn2+.
b) Có thể thay dung dịch H2SO4 bằng dung dịch acid mạnh như HCl, HNO3 nhưng phải đảm bảo lượng H+ dư sau phản ứng.
c) Trong mỗi lần chuẩn độ, dung dịch KMnO4 được xem là phản ứng vừa đủ với muối Mohr (điểm dừng) khi giọt dung dịch KMnO4 cuối cùng nhỏ vào dung dịch Y không mất màu.
d) Theo kết quả chuẩn độ ở trên, trong số các giá trị: 93,32; 98,45; 97,36; 99,87 độ tinh khiết (% khối lượng (NH4)2Fe(SO4)2.6H2O) của muối Mohr có giá trị gần nhất với 98,45.
(Xem giải) Câu 21: Trong nước mưa acid thường có pH = 4 đến 5. pH thấp trong nước mưa acid chủ yếu là do có chứa các acid như HNO3, H2SO4. Trong tự nhiên, HNO3 còn được tạo ra từ N2 theo sơ đồ chuyển hóa: N2 → NO → NO2 → HNO3
a) Một cơn mưa acid, nước mưa có pH = 4 thì nồng độ HNO3 có trong nước mưa đó là 10^-4M.
b) Trong thực tế để điều chế ester từ acid và alcohol tương ứng người ta sử dụng HNO3 làm chất xúc tác.
c) HNO3 sinh ra từ quá trình trên sẽ cung cấp một lượng phân đạm cho cây trồng ở dạng NO3-.
d) Dung dịch HNO3 có pH = 3 cần phải pha loãng 20 lần để thu được dung dịch HNO3 có pH = 5.
(Xem giải) Câu 22: Một học sinh tiến hành tổng hợp isoamyl acetate (thành phần chính của dầu chuối) từ acetic acid và isoamyl alcohol theo phương trình hóa học sau:
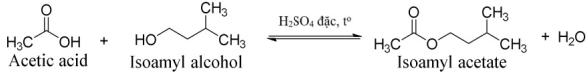
Sau thí nghiệm, tiến hành phân tách sản phẩm. Ghi phổ hồng ngoại của acetic acid, isoamyl alcohol và isoamyl acetate. Cho biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng như sau:
| Liên kết | O-H (alcohol) | O-H (carboxylic acid) | C=O (ester, carboxylic acid) |
| Số sóng (cm-1) | 3650 – 3200 | 3300 – 2500 | 1780 – 1650 |
a) Phản ứng tổng hợp trong thí nghiệm này là phản ứng thủy phân ester.
b) Phổ hồng ngoại có số sóng hấp thụ ở 3350 cm-1 là phổ của isoamyl alcohol.
c) Phổ hồng ngoại có số sóng hấp thụ ở 1750 cm-1 mà không có số sóng hấp thụ đặc trưng của liên kết OH là phổ của isoamyl acetate.
d) Dựa vào phổ hồng ngoại, phân biệt được acetic acid, isoamyl alcohol và isoamyl acetate.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23: Một hộ gia đình mua than đá làm nhiên liệu đun nấu và trung bình mỗi ngày dùng hết 2,0 kg than đá. Giả thiết loại than đá này chứa 90% carbon và 1,2% sulfur về khối lượng, còn lại là các tạp chất trơ không cháy.
Cho các phản ứng:
C(s) + O2(g) → CO2(g)  = -393,5 kJ/mol
= -393,5 kJ/mol
S(s) + O2(g) → SO2(g)  = -296,8 kJ/mol
= -296,8 kJ/mol
Hiệu suất sử dụng nhiệt là 37,5%. Nhiệt lượng cung cấp cho hộ gia đình từ quá trình đốt than trong một ngày tương đương bao nhiêu số điện? (Biết cứ 1 số điện = 1 kWh = 3600 kJ)? (Kết quả làm tròn đến hàng đơn vị)
(Xem giải) Câu 24: Một mẫu nước thải của nhà máy sản xuất có pH = 3. Để thải ra ngoài môi trường thì cần phải tăng pH lên từ 5,8 đến 8,6 (theo đúng qui định), nhà máy phải dùng vôi sống thải vào nước thải. Để nâng pH của 3 m³ nước thải từ 3 lên 7 cần dùng m gam vôi sống. Tính giá trị m. (Bỏ qua sự thủy phân của các muối, kết quả làm tròn đến hàng đơn vị)
(Xem giải) Câu 25: Một nhà hóa học trẻ quyết định nghiên cứu về sự nhiệt phân muối cobalt(II) pentahydrate (CoSO4.5H2O) để phục vụ cho dự án khoa học của mình. Để tiến hành, anh ta đặt một mẫu muối màu hồng tươi vào thiết bị phân tích nhiệt trọng (TGA) và bắt đầu quá trình đun nóng đến 950°C. Kết quả là anh ta nhận được đồ thị về sự phụ thuộc vào khối lượng mẫu của nhiệt độ như trong hình sau:
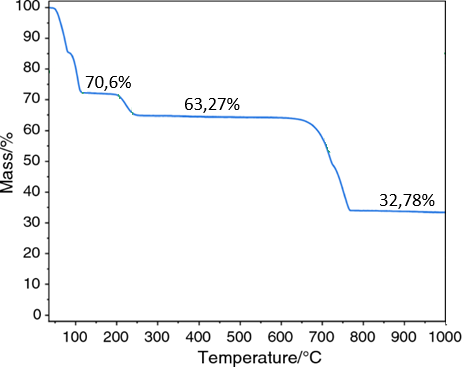
Số nguyên tử trong một phân tử mẫu ở 520°C là bao nhiêu?
(Xem giải) Câu 26: Cho salixylic acid (o-hidroxibenzoic) phản ứng với anhydride acetic, thu được acetylsalixylic (o-CH3COOC6H4COOH) dùng làm thuốc cảm (aspirin). Để phản ứng hoàn toàn với 43,2 gam acetylsalixylic cần vừa đủ V lít dung dịch NaOH 1M. Giá trị của V là bao nhiêu? (Kết quả làm tròn đến hàng phần trăm).
(Xem giải) Câu 27: Thuỷ phân hoàn toàn chất béo X trong dung dịch NaOH dư, thu được glycerol, sodium stearate và oleate. Có bao nhiêu chất béo X thỏa mãn?
(Xem giải) Câu 28: Carboxylic acid X hai chức (có phần trăm khối lượng của oxygen nhỏ hơn 70%), Y và Z là hai alcohol đồng đẳng kế tiếp (MY < MZ). Đốt cháy hoàn toàn 0,2 mol hỗn hợp gồm X, Y, Z cần vừa đủ 9,916L khí O2 (đkc), thu được 8,6765L khí CO2 (đkc) và 8,1 gam H2O. Phần trăm khối lượng của Z trong hỗn hợp trên là bao nhiêu? (Kết quả làm tròn đến hàng phần mười).

Bình luận