[2024 – 2025] Thi học sinh giỏi lớp 12 tỉnh Phú Thọ (Đề minh họa)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 003-H12B năm 2024-2025
⇒ Thời gian làm bài: 180 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1D | 2D | 3D | 4C | 5A | 6C | 7A | 8B |
| 9B | 10D | 11A | 12C | 13A | 14C | 15D | 16B |
| 17B | 18A | 19C | 20B | 21A | 22C | 23D | 24A |
| 25B | 26C | 27C | 28D | 29B | 30C | 31A | 32C |
| (a) | (b) | (c) | (d) | |
| Câu 1 | S | Đ | Đ | Đ |
| Câu 2 | S | S | S | Đ |
PHẦN 1. TỰ LUẬN (10 điểm)
Câu I (2,0 điểm).
1. Giải thích các hiện tượng sau đây và viết các phương trình hóa học xảy ra phản ứng:
(Xem giải) a) Khi sục khí chlorine vào dung dịch sodium hydrogencarbonate thấy có khí carbonic bay ra. Nếu thay chlorine bằng khí sulfur dioxide thì có hiện tượng trên xảy ra hay không?
(Xem giải) b) Khi cho sulfur dioxide vào nước vôi trong thì thấy nước vôi trong bị đục, nếu nhỏ tiếp hydrochloric acid vào lại thấy nước vôi trong lại. Nếu thay hydrochloric acid bằng sulfuric acid thì nước vôi có trong lại hay không?
(Xem giải) c) Sục khí sulfur dioxide vào nước bromine đến khi vừa làm mất màu đỏ nâu của dung dịch. Sau đó thêm dung dịch barium chloride vào thấy tạo thành kết tủa trắng.
(Xem giải) d) Nhỏ dung dịch barium hydroxide vào dung dịch ammonium sulfate rồi đun nhẹ, thấy có kết tủa màu trắng, đưa mẩu giấy pH đã tẩm ướt lên miệng ống nghiệm thấy chuyển sang màu xanh.
(Xem giải) 2. Sodium được sản xuất trong công nghiệp bằng cách điện phân muối ăn ở trạng thái nóng chảy. Sơ đồ bình điện phân được cho ở hình vẽ:
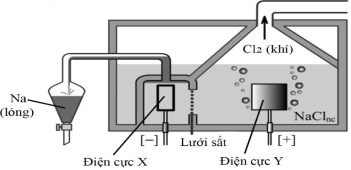
a) Cho biết trong các điện cực X và Y, điện cực nào là cathode, điện cực nào là anode của bình điện phân Down? Viết các quá trình xảy ra ở cathode và anode. Cho biết quá trình nào là quá trình oxi hoá, quá trình nào là quá trình khử?
b) Biết rằng trong hai điện cực sử dụng chế tạo bình điện phân, một điện cực làm từ sắt, một điện cực làm từ grafite (than chì). Cho biết điện cực nào làm từ sắt, điện cực nào làm từ grafite?
c) Tại sao hệ thống thu kim loại sodium được lắp đặt phía trên bề mặt bình điện phân mà không phải ở phía dưới đáy bình điện phân như trong điện phân nóng chảy aluminium oxide?
d) Vì sao hệ thống ống dẫn sodium và bình thu sodium nóng chảy luôn được đặt trong môi trường khí trơ?
Câu II (2,0 điểm).
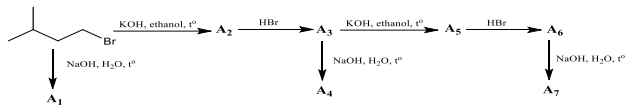
(Xem giải) 1. Trong sơ đồ sau các chất hữu cơ từ A1 đến A7 là các sản phẩm chính. Xác định công thức các chất từ A1 đến A7.
(Xem giải) 2. Rutin có nhiều trong hoa hòe, có tác dụng làm bền vững thành mạch, chống co thắt, chống viêm cầu thận cấp. Rutin có công thức cấu trúc như hình bên. Biết độ tan của rutin (g/1 L nước) ở 100°C và 25°C lần lượt là 5,2 và 0,125.
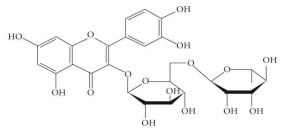
a) Cho biết công thức phân tử của rutin?
b) Dựa vào cấu tạo của rutin hãy giải thích tại sao rutin tan được trong nước.
c) Người ta đun sôi một mẫu hoa hòe với nước ở 100°C trong 1 giờ, sau đó tách bỏ chất rắn, làm nguội dung dịch thì thu được rutin tách ra ở dạng rắn. Trong qui trình trên, những phương pháp tinh chế hợp chất hữu cơ nào đã được sử dụng để tách lấy rutin? Những phương pháp đó dựa trên tính chất nào của rutin?
Câu III (2,0 điểm).
(Xem giải) 1. Cho biết thế điện cực chuẩn của cặp EºX2+/X = -0,763 V, EºY2+/Y = 0,340 V.
a) Cho biết thí nghiệm nào sau đây xảy ra phản ứng?
– Nhúng thanh kim loại X vào dung dịch Y(NO3)2.
– Nhúng thanh kim loại Y vào dung dịch X(NO3)2.
b) Tính sức điện động chuẩn của pin X-Y.
(Xem giải) 2. Mưa acid gây phá hủy rộng lớn cho rừng cây khắp nơi trên thế giới, đặc biệt là những vùng công nghiệp hóa chất như châu Âu và bắc Mỹ. Mưa acid xảy ra chủ yếu do sự phóng thích từ sự nung chảy quặng sulfur và sự đốt cháy nhiên liệu tạo ra khí sulfur dioxide. Trong không khí, một phần sulfur dioxide chuyển thành sulfur trioxide được hấp thụ trong nước mưa chuyển thành sulfuric acid. Giả sử cứ 50000 phân tử nước (chứa 4,5.10^4 lít nước của một trận mưa) hấp thụ một phân tử sulfur trioxide và toàn bộ sulfuric acid đều tan trong lượng nước mưa. Giả sử khối lượng riêng của nước lỏng là 1 g/mL. Xác định nồng độ mol/L của sulfuric acid trong nước mưa.
(Xem giải) 3. Hòa tan hết m gam hỗn hợp X gồm Fe3O4 và Cu vào dung dịch H2SO4 loãng dư, sau khi phản ứng kết thúc chỉ thu được dung dịch Y. Chia Y thành hai phần bằng nhau: Cho phần một phản ứng tối đa với dung dịch NaOH, lọc tách kết tủa đem nung trong không khí đến khối lượng không đổi, thu được 10,8 gam chất rắn. Để oxi hóa hết ion Fe2+ trong phần hai cần vừa đủ 50 ml dung dịch KMnO4 0,2M. Tính khối lượng của mỗi chất trong m gam X.
(Xem giải) Câu IV (2,0 điểm).
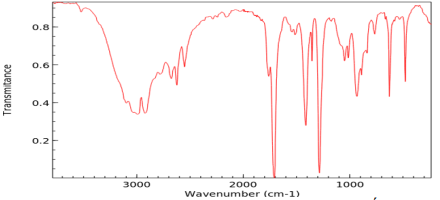
Chất hữu cơ X có tác dụng kháng khuẩn nhẹ, được sử dụng trong điều trị một số loại bệnh. Kết quả phân tích nguyên tố (theo khối lượng) cho thấy X chứa: 40,00% carbon; 6,67% hydrogen còn lại là oxygen.
a) Xác định công thức đơn giản nhất của X.
b) Từ phổ khối xác định được peak ion phân tử [M+] của X có giá trị m/z bằng 60. Xác định công thức phân tử của X.
c) Xác định công thức cấu tạo của X (có giải thích). Biết phổ hồng ngoại của X như sau:
d) Ethanol phản ứng với X trong môi trường H2SO4 đặc tạo thành chất hữu cơ Y theo phương trình hoá học sau: C2H5OH(l) + X (l) ⇋ Y (l) + H₂O(l)
Ở 50°C, giá trị Kc của phản ứng trên là 7,5. Nếu cho 23,0 g ethanol phản ứng với 30,0 gam X ở 50°C thì khối lượng Y thu được trong hỗn hợp ở trạng thái cân bằng là bao nhiêu? (Coi tổng thể tích của hệ phản ứng không đổi).
Câu V (2,0 điểm).
(Xem giải) 1. Tiến hành thí nghiệm như hình vẽ bên:
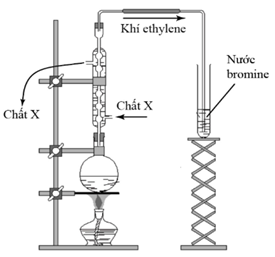
a) Lựa chọn các chất trong bình cầu phù hợp với thí nghiệm trong các chất sau: dung dịch H2SO4 đặc, KOH, C2H5Br, C2H5OH. Viết phương trình hóa học xảy ra các phản ứng.
b) Nêu hiện tượng quan sát được trong ống nghiệm đựng nước bromine. Giải thích, viết phương trình phản ứng.
c) Trong phòng thí nghiệm, chất X dẫn vào và cho chảy ra là chất gì? Cho biết vai trò của chất X.
d) Vì sao phải để lưới amiang lót dưới đáy bình cầu trước khi đun trên ngọn lửa đèn cồn?
(Xem giải) 2. Trong môi trường nước biển (pH = 7,9) và có oxygen hòa tan, đồng kim loại (Cu) bị ăn mòn và hình thành copper(II) hydroxide.
a) Hãy viết các nửa phản ứng oxi hóa khử và phản ứng tổng quát để giải thích hiện tượng trên.
b) Để bảo vệ các thiết bị bằng đồng trong môi trường nước biển khỏi bị ăn mòn, người ta gắn vào mặt ngoài của các thiết bị bằng đồng (phần chìm dưới nước) các khối kim loại mạnh hơn (kim loại hi sinh). Trong thực tế Zn thường được chọn làm kim loại hi sinh. Viết quá trình xảy ra trên hai điện cực để giải thích cách làm trên.
c) Hãy đề xuất hai cách em dùng bảo vệ kim loại trong các thiết bị trong gia đình mình (ví dụ xe đạp,…) để hạn chế sự ăn mòn kim loại.
PHẦN 2. TRẮC NGHIỆM (10 điểm)
1. Câu trắc nghiệm nhiều phương án lựa chọn (Thí sinh trả lời từ câu 1 đến câu 32. Mỗi câu hỏi thí sinh chỉ chọn một phương án)
(Xem giải) Câu 1: Phát biểu nào sau đây sai?
A. Nguyên tử (trừ H) được cấu tạo từ các hạt cơ bản là proton, neutron và electron.
B. Hầu hết hạt nhân nguyên tử được cấu tạo từ các hạt proton và neutron.
C. Vỏ nguyên tử được cấu tạo bởi các hạt electron.
D. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
(Xem giải) Câu 2: Nguyên tử X có 14 electron ở lớp M. Vị trí của X trong bảng tuần hoàn là
A. Chu kỳ 4, nhóm VIB. B. Chu kỳ 4, nhóm VIIIA.
C. Chu kỳ 4, nhóm VIA. D. Chu kỳ 4, nhóm VIIIB.
(Xem giải) Câu 3: Tính oxi hoá của các nguyên tố nhóm halogen biến đổi như thế nào?
A. Tăng dần từ fluorine đến iodine.
B. Giảm dần từ chlorine đến iodine trừ fluorine.
C. Tăng dần từ chlorine đến iodine trừ fluorine.
D. Giảm dần từ fluorine đến iodine.
(Xem giải) Câu 4: Cho các polymer: polyacrylonitrile, poly (phenol formaldehyde), polyethylene, polybuta-1,3-diene, poly (methyl methacrylate). Số polime dùng làm chất dẻo là
A. 2. B. 4. C. 3. D. 5.
(Xem giải) Câu 5: Phát biểu nào sau đây sai?
A. Cấu trúc phân tử tinh bột gồm nhiều gốc β-Glucose liên kết với nhau thành mạch kéo dài.
B. Glucose có nhiều trong quả nho chín nên được gọi là đường nho.
C. Cellulose là nguyên liệu để sản xuất tơ cellulose acetate, tơ visco.
D. Saccharose không có phản ứng tráng bạc.
(Xem giải) Câu 6: Acetone được điều chế bằng cách oxi hoá cumene nhờ oxygen, sau đó thuỷ phân trong dung dịch H2SO4 loãng. Để thu được 87 gam acetone thì khối lượng cumene cần dùng (biết hiệu suất quá trình điều chế đạt 80%) là
A. 144 gam. B. 180 gam. C. 225 gam. D. 281 gam.
(Xem giải) Câu 7: Cho các phát biểu sau:
(a) Liên kết giữa một kim loại và một phi kim luôn là liên kết ion.
(b) Liên kết cộng hóa trị được hình thành do sự góp chung electron giữa hai nguyên tử.
(c) Phân tử N2 có liên kết ba bền vững.
(d) Hydroxide ứng với hóa trị cao nhất của sulfur là H2S.
Số phát biểu đúng là
A. 1. B. 3. C. 4. D. 2.
(Xem giải) Câu 8: Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) → 2NO(g) ![]() = +180 kJ
= +180 kJ
Kết luận nào sau đây đúng?
A. Phản ứng xảy ra thuận lợi ở điều kiện thường.
B. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
C. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
D. Phản ứng giữa nitrogen và oxygen là phản ứng tỏa nhiệt.
(Xem giải) Câu 9: Cho cân bằng hoá học: 2SO2(g) + O2(g) ⇋ 2SO3 (g) ![]() < 0. (1)
< 0. (1)
Phát biểu nào sau đây đúng về phản ứng (1)?
A. Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
B. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2.
C. Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng.
D. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3.
(Xem giải) Câu 10: Cho các phát biểu sau:
(a) Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học khác.
(b) Trong sản xuất rượu bia, khí nitrogen được bơm vào bể chứa để loại bỏ khí oxygen.
(c) Nitrogen được bơm vào vỏ bao bì để bảo vệ thực phẩm khi va chạm và bảo quản thực phẩm.
(d) Trong chữa cháy, nitrogen dùng để dập tắt các đám cháy do hóa chất, chập điện.
Số phát biểu đúng là
A. 2. B. 3. C. 1. D. 4.
(Xem giải) Câu 11: Một pin điện hóa tạo bởi hai cặp oxi hóa – khử ở điều kiện chuẩn: Fe2+/Fe và Sn2+/Sn với thế điện cực chuẩn tương ứng là -0,44 V và -0,137 V.
Cho các phát biểu về pin điện hóa trên như sau:
(a) Anode của pin là Fe.
(b) Cathode của pin là Fe2+.
(c) Quá trình xảy ra ở anode khi pin hoạt động là: Fe2+ + 2e → Fe.
(d) Quá trình xảy ra ở cathode khi pin hoạt động là: Sn2+ + 2e → Sn.
(đ) Sức điện động chuẩn của pin là 0,203 V.
Số phát biểu sai là là
A. 3. B. 4. C. 1. D. 2.
(Xem giải) Câu 12: Trong công nghiệp, đồng phế liệu hoặc đồng thô tinh chế bằng phương pháp điện phân. Bình điện phân tinh chế đồng chứa dung dịch muối CuSO4 trong dung dịch H2SO4.
Cho các phát biểu về quá trình điện phân trên như sau:
(a) Anode là đồng tinh khiết.
(b) Cathode là đồng thô.
(c) Tại anode, xảy ra quá trình: Cu2+ + 2e → Cu.
(d) Tại cathode, xảy ra quá trình: Cu → Cu2+ + 2e.
(đ) Kết thúc quá trình điện phân, đồng tinh khiết thu được tại cathode.
Số phát biểu đúng là
A. 3. B. 4. C. 1. D. 2.
(Xem giải) Câu 13: Hòa tan hoàn toàn 1,42 gam hỗn hợp gồm carbon, phosphorus và sulfur trong 35 gam dung dịch HNO3 63%, thu được dung dịch X và 0,36 mol hỗn hợp khí chỉ gồm CO2 và NO2 (tỉ lệ mol 1 : 8). Cho dung dịch X tác dụng tối đa với dung dịch chứa a mol Ba(OH)2, thu được m gam kết tủa. Giá trị của m lần lượt là
A. 0,055 và 8,34. B. 0,055 và 14,35. C. 0,04 và 14,35. D. 0,04 và 8,34.
Câu 14: Tiến hành thí nghiệm với 4 dung dịch X, Y, Z, T đựng trong các lọ riêng biệt, kết quả được ghi trong bảng sau:
| Mẫu thử | Thuốc thử | Hiện tượng |
| X | Dung dịch AgNO3/NH3 | Tạo kết tủa trắng bạc |
| Y | Cu(OH)2/OH- | Có màu tím xuất hiện |
| Y hoặc Z | Quỳ tím | Chuyển màu xanh |
| T | Dung dịch Br2 | Mất màu đồng thời xuất hiện kết tủa |
Các chất X, Y, Z, T lần lượt là
A. Glucose, Ala-Lys-Val, Aniline, Ethylamine.
B. Glucose, Lys-Val-Gly, Alanin, Aniline.
C. Fructose, Lys-Val-Gly, Ethylamine, Aniline.
D. Fructose, Gly-Ala-Val, Alanin, Ethylamine.
(Xem giải) Câu 15: Thực hiện thí nghiệm tách β-carotene từ nước ép cà rốt như sau:
– Chuẩn bị: nước ép cà rốt, hexane; cốc thuỷ tinh 100 mL, bình tam giác 100 mL, phễu chiết 60 mL, giá thí nghiệm.
– Tiến hành:
Bước 1: Cho khoảng 20 mL nước ép cà rốt vào phễu chiết. Thêm tiếp khoảng 20 mL hexane, lắc đều khoảng 2 phút.
Bước 2: Để yên phễu chiết trên giá thí nghiệm khoảng 5 phút để chất lỏng tách thành hai lớp.
Bước 3: Mở khoá phễu chiết cho phần nước ở dưới chảy xuống, còn lại phần dung dịch β-carotene hoà tan trong hexane.
Phát biểu nào sau đây sai?
A. Trước khi chiết lớp hexane trong phễu không có màu; sau khi chiết lớp hexane trong phễu có màu vàng cam.
B. Thí nghiệm tách β-carotene từ nước cà rốt dựa theo nguyên tắc chiết lỏng – lỏng.
C. Dùng dung môi là hexane có khả năng hoà tan β-carotene nhưng không tan trong nước và có nhiệt độ sôi thấp để chiết.
D. Phễu chiết tách thành hai lớp, lớp bên trên là nước, lớp dưới là β-carotene hoà tan trong hexane.
(Xem giải) Câu 16: Chanh là một loài thực vật cho quả nhỏ, thuộc chi Cam chanh (Citrus), khi chín có màu xanh hoặc vàng, thịt quả có vị chua. Quả chanh được sử dụng làm thực phẩm trên khắp thế giới – chủ yếu dùng nước ép của nó, thế nhưng phần cơm (các múi của chanh) và vỏ cũng được sử dụng, chủ yếu là trong nấu ăn và nướng bánh. Nước ép chanh chứa khoảng 5% (khoảng 0,3 mol/lít) citric acid, điều này giúp chanh có vị chua, và độ pH của chanh từ 2-3. Citric acid có công thức cấu tạo là
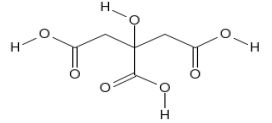
Chọn phát biểu đúng
A. Công thức phân tử của citric acid là C6H6O7.
B. Nước ép chanh có thể tẩy được cặn trong ấm đun nước (cặn có thành phần chính là CaCO3).
C. 1 mol Citric acid tác dụng được với Na sinh ra 4 mol H2.
D. Citric acid tác dụng với NaOH theo tỉ lệ mol 1 : 4.
(Xem giải) Câu 17: Hỗn hợp E gồm muối vô cơ X (CH8N2O3) và dipeptide Y (C4H8N2O3). Cho E tác dụng với dung dịch NaOH đun nóng, thu được khí Z. Cho E tác dụng với dung dịch HCl dư, thu được khí T và chất hữu cơ Q. Nhận định nào sau đây sai?
A. Chất Y là H2NCH2CONHCH2COOH. B. Chất Q là H2NCH2COOH.
C. Chất Z là NH3 và chất T là CO2. D. Chất X là (NH4)2CO3.
(Xem giải) Câu 18: Cho các phát biểu sau:
(a) Ethyl acetate có số nguyên tử carbon trong một phân tử là 4.
(b) Chất béo là triester của ethylene glycol với acid béo.
(c) Chất béo tan tốt trong nước và nhẹ hơn nước.
(d) Để chuyển chất béo lỏng thành chất béo rắn, ta cho chất béo lỏng tác dụng với hydrogen dư (xúc tác Ni, đun nóng).
(đ) Phản ứng thuỷ phân ester trong môi trường acid luôn là phản ứng một chiều.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 19: Thủy phân hoàn toàn một hexapeptide M, thu được Ala, Arg, Gly, Ile, Phe và Tyr. Các peptide E (chứa Phe, Arg) và G (chứa Arg, Ile, Phe) được tạo thành trong số các sản phẩm thủy phân không hoàn toàn M. Dùng 1-fluoro-2,4-dinitrobenzen xác định được amino acid đầu N là Ala. Thủy phân M nhờ tripsin thu được tripeptit A (chứa Ala, Arg, Tyr) và một chất. Thứ tự liên kết của các amino axit trong M là
A. Arg – Tyr – Ala – Phe – Ile – Gly. B. Ala – Tyr – Arg – Phe – Gly –Ile.
C. Ala – Tyr – Arg – Phe – Ile – Gly. D. Ala – Tyr – Phe – Arg – Ile – Gly.
(Xem giải) Câu 20: Cho phản ứng đốt cháy butane sau: C4H10(g) + 6,5O2(g) → 4CO2(g) + 5H2O(g)
Biết năng lượng liên kết trong các hợp chất cho trong bảng sau
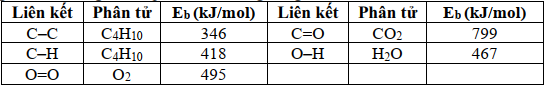
Để đun sôi (lên 100°C) một ấm chứa 2 lít nước cần dùng m gam khí butane ở trên. (Giả thiết mỗi ấm nước chứa 2 lít nước ở 25°C, để nâng 1 gam nước lên 1°C cần tiêu tốn 4,2 J, có 40% nhiệt đốt cháy butane bị thất thoát ra ngoài môi trường, khối lượng riêng của nước 1g/mL). Giá trị của m có giá trị gần nhất với giá trị nào sau đây?
A. 13. B. 23. C. 20. D. 14.
(Xem giải) Câu 21: Cho 0,015 mol một loại hợp chất oleum vào nước thu được 200 mL dung dịch X. Để trung hoà 100 mL dung dịch X cần dùng 200 mL dung dịch NaOH 0,15 M. Phần trăm của khối lượng của nguyên tố sulfur trong oleum trên là
A. 35,95%. B. 32,65%. C. 37,86%. D. 23,97%.
(Xem giải) Câu 22: Điện phân dung dịch chứa x mol CuSO4, y mol H2SO4 và z mol NaCl (với điện cực trơ có màng ngăn xốp, hiệu suất điện phân là 100%). Khối lượng dung dịch giảm và khối lương Al2O3 bị hòa tan tối đa trong dung dịch sau điện phân ứng với mỗi thí nghiệm được cho ở bảng dưới đây:
| Thí nghiệm 1 | Thí nghiệm 2 | Thí nghiệm 3 | |
| Thời gian điện phân | t | 4t | 8t |
| Khối lượng dung dịch giảm (gam) | 27 | 83,2 | 103,1 |
| Khối lương Al2O3 bị hòa tan tối đa (gam) | 13,6 | 0,0 | 10,2 |
Biết tại catot ion Cu2+ điện phân hết thành Cu trước khi ion H+ điện phân tạo thành H2, cường độ dòng điện bằng nhau và không đổi trong các thí nghiệm trên. Tổng giá trị (x + y + z) là
A. 1,6. B. 2,4. C. 2,6. D. 2,0.
(Xem giải) Câu 23: Tiến hành các thí nghiệm sau:
(a) Cho a mol bột Fe vào dung dịch chứa 3a mol AgNO3.
(b) Cho từ từ từng giọt dung dịch chứa a mol HCl vào dung dịch chứa a mol Na2CO3.
(c) Cho dung dịch chứa a mol Ca(HCO3)2 vào dung dịch chứa a mol NaOH.
(d) Cho dung dịch chứa a mol Ba(HCO3)2 vào dung dịch chứa a mol NaHSO4.
Sau khi các phản ứng hoàn toàn, số thí nghiệm thu được dung dịch chứa một muối là
A. 1. B. 2. C. 4. D. 3.
(Xem giải) Câu 24: Trung bình để năng suất thu được 1,0 tạ thóc thì lượng phân bón cần cung cấp khoảng: 2,0 kg N; 0,8 kg P2O5; 3,2 kg K2O. Giả sử khi bón phân bằng cách trộn x kg phân NPK có độ dinh dưỡng 16-16-8; y kg phân đạm ure có dinh dưỡng 46% và z kg phân kali đỏ (KCl – có độ dinh dưỡng 60%) sẽ thu được 1,0 tấn thóc. Tổng giá trị của (x + y + z) là
A. 122,76. B. 120,00. C. 92,68. D. 106,42.
(Xem giải) Câu 25: Hiện nay người ta sản xuất ammonia bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí methane (thành phần chính của khí thiên nhiên).
Phản ứng điều chế H2: CH4 + 2H2O ⇋ CO2 + 4H2 (1)
Phản ứng loại O2 để thu N2: CH4 + 2O2 → CO2 + 2H2O (2)
Phản ứng tổng hợp NH3: N2+ 3H2 ⇋ 2NH3 (3)
Để sản xuất khí ammonia, nếu lấy 841,7 m³ không khí (chứa 21,03% O2; 78,02% N2, còn lại là khí hiếm theo thể tích), thì cần phải lấy x m³ khí methane và y m³ hơi nước để có đủ lượng N2 và H2 theo tỉ lệ 1 : 3 về thể tích dùng cho phản ứng tổng hợp ammonia. Giả thiết các phản ứng (1), (2) đều xảy ra hoàn toàn và các thể tích khí đo ở cùng điều kiện. Giá trị của x và y lần lượt là
A. 492,03 và 177,28. B. 580,82 và 807,74.
C. 656,12 và 985,35. D. 841,21 và 970,52.
(Xem giải) Câu 26: X là amine no, đơn chức, mạch hở và Y là amine no, hai chức, mạch hở có cùng số nguyên tử carbon.
– Hỗn hợp gồm a mol X và b mol Y phản ứng vừa hết với dung dịch chứa 18,25 gam HCl và tạo ra m gam hỗn hợp muối.
– Hỗn hợp gồm b mol X và a mol Y phản ứng vừa hết với dung dịch chứa 14,6 gam HCl và tạo ra 38,0 gam hỗn hợp muối.
Giá trị của m là
A. 48,950. B. 40,900. C. 43,150. D. 32,525.
(Xem giải) Câu 27: Cho phenol (C6H5OH) tác dụng vừa đủ với dung dịch Br2 (theo tỉ lệ mol tương ứng là 1 : 3), sau phản ứng thu được một hỗn hợp X gồm các sản phẩm có khối lượng là 5,74 gam. Cho X tác dụng với dung dịch NaOH (đặc, nóng, dư, có áp suất cao), số mol NaOH đã phản ứng là a mol, biết các phản ứng xảy ra hoàn toàn. Giá trị của a là
A. 0,01. B. 0,07. C. 0,1. D. 0,04.7
(Xem giải) Câu 28: Một loại xăng E5 có tỉ lệ số mol như sau: 5% ethanol, 35% heptane, 60% octane. Khi được đốt cháy hoàn toàn, 1 mol ethanol sinh ra một lượng năng lượng là 1367kJ, 1 mol heptane sinh ra một lượng năng lượng là 4825 kJ và 1 mol octane sinh ra một lượng năng lượng là 5460 kJ, năng lượng giải phóng ra có 20% thải vào môi trường, các phản ứng xảy ra hoàn toàn. Một xe máy chạy 1 giờ cần một năng lượng là 37688 kJ. Nếu xe máy chạy với tốc độ trung bình như trên thì thời gian để sử dụng hết 3 kg xăng E5 gần nhất với giá trị nào sau đây?
A. 2,55 giờ. B. 2,82 giờ. C. 3,55 giờ. D. 3,05 giờ.
(Xem giải) Câu 29: Một số loại máy đo nồng độ cồn trong hơi thở dựa trên phản ứng của ethanol (cồn) (C2H5OH) có trong hơi thở với hợp chất potassium dichromate trong môi trường sulfuric acid loãng. Phản ứng (chưa được cân bằng) như sau:
C2H5OH + K2Cr2O7 + H2SO4 → CH3COOH + Cr2(SO4)3 + K2SO4 + H2O. (1)
Dung dịch chứa ion Cr2O72- ban đầu có màu da cam, khi xảy ra phản ứng (1) dưới tác dụng của chất xúc tác ion Ag+ tạo thành sản phẩm là dung dịch chứa ion Cr3+ có màu xanh lá cây trong khoảng chưa đến 1,0 phút. Dựa vào sự thay đổi màu sắc này có thể xác định người tham gia giao thông có sử dụng thức uống có cồn hay không. Bảng sau (trích từ nghị định 46/2016/NĐ-CP) đưa ra mức độ phạt người tham gia giao thông có sử dụng hàm lượng cồn.
| Mức độ vi phạm | ≤ 0,25 mg cồn/ 1 lít khí thở | 0,25 – 0,4 mg cồn/ 1 lít khí thở | > 0,4 mg cồn/ 1 lít khí thở |
| Xe máy | 2.000.000 – 3.000.000 đồng | 4.000.000 – 5.000.000 đồng | 6.000.000 – 8.000.000 đồng |
Một mẫu hơi thở của anh T bị nghi vấn có sử dụng cồn khi tham gia giao thông có thể tích 26,25 ml được thổi vào thiết bị Breathalyzer chứa 1,0 ml dung dịch K2Cr2O7 nồng độ 0,056 mg/ml trong môi trường acid H2SO4 50% và nồng độ ion Ag+ ổn định 0,25 mg/ml. Biết rằng phản ứng xảy ra hoàn toàn và toàn bộ dung dịch màu da cam chuyển hoàn toàn thành màu xanh lá cây.
Cho các phát biểu sau:
(a) Trong phản ứng (1) ethanol là chất bị oxi hoá.
(b) Tổng hệ số cân bằng nguyên dương tối giản của phản ứng (1) là 32.
(c) Trong phản ứng (1) nồng độ chất xúc tác Ag+ không thay đổi sau phản ứng.
(d) Theo quy định, anh T bị phạt từ 6 đến 8 triệu đồng.
Số phát biểu đúng là
A. 4. B. 3. C. 1. D. 2.
(Xem giải) Câu 30: Thủy phân 25,28 gam hỗn hợp M gồm hai ester X và Y chỉ chứa một loại nhóm chức (MX < MY) cần vừa đúng 200 mL dung dịch NaOH 2M rồi cô cạn thu được muối Z của một carboxylic acid T và hỗn hợp E gồm hai alcohol no, đơn chức, mạch hở là đồng đẳng kết tiếp. Cho toàn bộ E tác dụng với 13,8 gam Na thu được 27,88 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Phát biểu nào sau đây đúng?
A. Chất Z có phần trăm khối lượng carbon là 17,65%.
B. Tỉ lệ mol giữa X và Y trong hỗn hợp M là 1 : 3.
C. Chất T có phần trăm khối lượng carbon là 26,67%.
D. Tỉ lệ mol giữa hai alcohol trong hỗn hợp E là 3 : 8.
(Xem giải) Câu 31: Hợp chất hữu cơ X gồm 3 nguyên tố C, H, O. Kết quả phân tích nguyên tố của hợp chất hữu cơ X có mC : mH : mO = 42 : 7 : 16. Phân tử khối của X gấp 4,0625 lần phân tử khối của phân tử oxygen. X có mạch không phân nhánh và phổ hồng ngoại của X như sau:
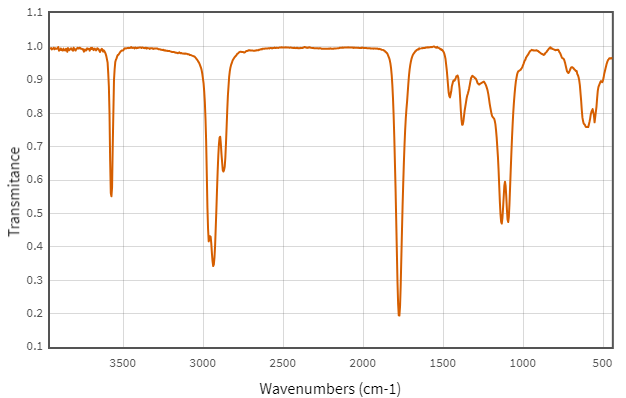
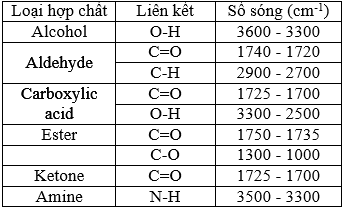
Cho các phát biểu sau:
(a) X có 6 nguyên tử carbon.
(b) X tác dụng được với NaHCO3.
(c) X có số nguyên tử hydrogen gấp 7 lần số nguyên tử oxygen.
(d) X thuộc loại hợp chất ester.
(đ) Tỉ lệ số nguyên tử C và H trong X là 1 : 2.
Số phát biểu đúng là
A. 3. B. 2. C. 4. D. 5.
(Xem giải) Câu 32: Hỗn hợp E gồm acid carboxylic đơn chức X, alcohol no đa chức Y và chất Z là sản phẩm của phản ứng ester hóa giữa X với Y. Trong E, số mol của X lớn hơn số mol của Y. Tiến hành các thí nghiệm sau:
Thí nghiệm 1: Cho 0,5 mol E phản ứng với dung dịch NaHCO3 dư thu được 3,7185 lít khí CO2 (đkc).
Thí nghiệm 2: Cho 0,5 mol E vào dung dịch NaOH dư, đun nóng thì có 0,65 mol NaOH phản ứng và thu được 32,2 gam alcohol Y.
Biết 0,5 mol E nặng 79,1 gam. Các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Z trong hỗn hợp E là
A. 73,86%. B. 71,24%. C. 72,06%. D. 74.68%.
2. Câu trắc nghiệm đúng sai (Thí sinh trả lời từ câu 1 đến câu 2. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai)
(Xem giải) Câu 1: Vôi sống có nhiều ứng dụng như: sản xuất vật liệu xây dựng, vật liệu chịu nhiệt, khử chua đất trồng, tẩy uế, sát trùng, xử lí nước thải,… Hiện nay, nhiều lò nung vôi thủ công hoạt động tự phát, gây ảnh hưởng xấu đến môi trường xung quanh. Ở các lò nung vôi công nghiệp, quá trình kiểm soát phát thải ô nhiễm được thực hiện chặt chẽ hơn. Xét một lò nung với công nghiệp sử dụng than đá làm nhiên liệu. Giả thiết:
– Đá vôi chỉ chứa CaCO3 và để phân hủy 1 kg đá vôi cần cung cấp một nhiệt lượng là 1800 KJ.
– Đốt cháy 1 kg than đá giải phóng ra một nhiệt lượng là 27000 KJ và có 50% lượng nhiệt này được hấp thụ ở quá trình phân hủy đá vôi.
– Than đá chứa 1% sulfur (ở dạng vô cơ và hữu cơ như FeS2, CaSO4, CxHySH,…) về khối lượng, 80% lượng sulfur bị đốt cháy tạo thành SO2 và 1,6% lượng SO2 sinh ra phát thải vào khí quyển.
– Công suất của lò nung vôi là 420 tấn vôi sống/ngày.
a. Phản ứng nhiệt phân đá vôi là phản ứng tỏa nhiệt.
b. Khối lượng đá vôi mà lò nung vôi trên sử dụng mỗi ngày là 750 tấn.
c. Khối lượng than đá mà lò nung vôi trên đã sử dụng mỗi ngày là 100 tấn.
d. Giả thiết toàn bộ lượng SO2 phát ra từ lò nung vôi trên trong 30 ngày chuyển hết thành sufuric acid trong nước mưa với nồng độ H2SO4 là 2.10-5M. Khi toàn bộ lượng nước mưa này rơi trên một vùng đất rộng 40 km² thì tạo ra một cơn mưa acid với lượng mưa trung bình là 15 mm.
(Xem giải) Câu 2: Độ alcohol hay độ cồn là giá trị cho biết thể tích alcohol có trong dung dịch. Độ cồn được tính theo số mL alcohol có trong 100 mL dung dịch ở 20°C. Một loại nước uống có cồn, thể tích bình chứa 330 mL dung dịch và trên nhãn ghi độ cồn là 5,0°.
a. Khối lượng của ethanol có trong 330 mL dung dịch (khối lượng riêng của ethanol 0,789 g/mL) là 10,72 gam.
b. LD50 (Lethal Dose, 50%) là liều lượng hoá chất phơi nhiễm trong cùng một thời điểm, gây tử vong cho 50% cá thể của nhóm thử nghiệm. LD50 của ethanol đối với người trưởng thành trong khoảng 5 gam – 8 gam trên 1 kg trọng lượng cơ thể. Một số poster tuyên truyền về LD50 của ethanol bằng cách quy đổi khối lượng ethanol về số lượng cốc rượu, bia hoặc đơn vị lon, chai, … uống vào cơ thể. Khi thiết kế poster, cần vẽ 23 đơn vị bình chứa để thể hiện giá trị LD50 của ethanol cho một người trưởng thành có cân nặng trung bình 60 kg.
c. Khối lượng ethanol thu được khi lên men 1 tấn sắn khô (chứa 38% khối lượng là tinh bột) với hiệu suất của cả quá trình là 81% là 178,4 kg.
d. Dùng toàn bộ lượng ethanol thu được ở trên để pha chế xăng E5 (5% thể tích là ethyl alcohol). Biết khối lượng riêng của ethyl alcohol là 0,8 kg.L-1. Thể tích xăng E5 thu được là 4,37 m³.


Bình luận