[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Bắc Giang
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 054-H12B năm 2024-2025
⇒ Thời gian làm bài: 120 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1C | 2C | 3C | 4A | 5C | 6B | 7A | 8A | 9C | 10B |
| 11D | 12D | 13D | 14D | 15D | 16B | 17B | 18A | 19C | 20D |
| Câu 21 | Câu 22 | Câu 23 | Câu 24 | Câu 25 | Câu 26 | |
| (a) | Đ | Đ | Đ | Đ | Đ | S |
| (b) | Đ | S | S | Đ | S | Đ |
| (c) | S | S | S | S | S | Đ |
| (d) | S | Đ | S | S | Đ | S |
| Câu 27 | Câu 28 | Câu 29 | Câu 30 | Câu 31 | Câu 32 |
| 444 | 690 | 6 | 4 | 6 | 3241 |
PHẦN I: TRẮC NGHIỆM (14,0 điểm).
I. Dạng 1: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 20. Mỗi câu thí sinh chỉ chọn một phương án đúng.
(Xem giải) Câu 1: Cho các polymer: poly(hexamethylene adipamide); polyacrylonitrile; polyisoprene; poly(vinyl chloride); polybuta-1,3-diene, poly(phenol formaldehyde); polycaprolactam. Số polymer được điều chế bằng phản ứng trùng hợp là
A. 2. B. 3. C. 5. D. 4.
(Xem giải) Câu 2: Thí nghiệm điều chế và thử tính chất của ethylene được tiến hành như hình dưới đây:
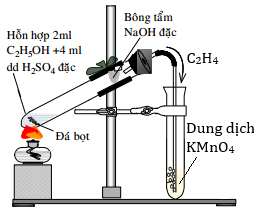
Cho các phát biểu sau:
(a) Đá bọt có vai trò làm cho chất lỏng sôi nhanh và mạnh hơn khi đun nóng.
(b) Bông tẩm dung dịch NaOH đặc có tác dụng loại khí SO2, CO2 sinh ra.
(c) Trong quá trình phản ứng, mầu của ống nghiệm đựng dung dịch KMnO4 nhạt dần.
(d) Khi kết thúc thí nghiệm, tắt đèn cồn trước sau đó để nguội rồi rút ống dẫn khí.
Số phát biểu đúng là
A. 3. B. 1. C. 2. D. 4.
(Xem giải) Câu 3: Điện phân 200 mL dung dịch X gồm KCl 0,5M và CuSO4 1M với các điện cực trơ. Cho các phát biểu sau:
(a) Ban đầu, tại anode xảy ra quá trình: 2Cl- → Cl2 + 2e.
(b) Trong quá trình điện phân thì pH của dung dịch sẽ luôn tăng.
(c) Khi thu được 9,6 gam kim loại bám vào cathode thì khối lượng dung dịch giảm là 11,2 gam.
(d) Nếu điện phân dung dịch X với anode bằng điện cực copper (Cu) thì xảy ra quá trình: Cu → Cu2+ + 2e.
Số phát biểu đúng là
A. 5. B. 3. C. 2. D. 4.
(Xem giải) Câu 4: Paracetamol (còn có tên gọi khác là acetaminophen) là hoạt chất giúp giảm đau và hạ sốt… được sử dụng nhiều trong y học. Thuốc paracetamol được tổng hợp từ phenol qua nhiều giai đoạn, trong đó giai đoạn tạo ra paracetamol từ p-aminophenol và acetic anhydride xảy ra theo phương trình hóa học sau:

Để sản xuất 5 000 hộp thuốc paracetamol 500 mg (mỗi hộp gồm 10 vỉ, mỗi vỉ gồm 10 viên, mỗi viên chứa 500 mg paracetamol) cần dùng tối thiểu m kg p-aminophenol. Biếu hiệu suất phản ứng tính theo p-aminophenol là 80%. Giá trị gần nhất của m là
A. 225,6. B. 227,1. C. 432,9. D. 427,6.
(Xem giải) Câu 5: Thủy phân hoàn toàn chất hữu cơ E (C9H16O4, chứa hai chức ester) bằng dung dịch NaOH thu được sản phẩm gồm alcohol X và hai chất hữu cơ Y, Z. Biết Y chứa 3 nguyên tử carbon và MX < MY < MZ. Cho Z tác dụng với dung dịch HCl (loãng, dư), thu được hợp chất hữu cơ T (C3H6O3). Cho các phát biểu sau:
(a) Khi cho a mol T tác dụng với Na (dư), thu được a mol H2.
(b) Có 4 công thức cấu tạo thỏa mãn tính chất của E.
(c) Alcohol X là propane-1,2-diol.
(d) Phân tử khối của Z là 96.
(e) Cho a mol T tác dụng với một lượng dư NaHCO3 thu được a mol CO2.
(f) Chất Y có mạch carbon không phân nhánh.
Số các phát biểu đúng là
A. 3. B. 2. C. 4. D. 5.
(Xem giải) Câu 6: Một pin Galvani được tạo nên từ hai cặp oxi hoá – khử Cu2+/Cu và Zn2+/Zn, trong pin này
A. anode (điện cực âm) là Cu, cathode (điện cực dương) là Zn.
B. anode (điện cực âm) là Zn, cathode (điện cực dương) là Cu.
C. anode (điện cực dương) là Zn, cathode (điện cực âm) là Cu.
D. anode (điện cực dương) là Cu, cathode (điện cực âm) là Zn.
(Xem giải) Câu 7: Tiến hành các thí nghiệm dưới đây:
(a) Cho bột Fe (dư) vào dung dịch FeCl3.
(b) Sục khí CO2 (dư) vào dung dịch NaOH.
(c) Cho kim loại Cu (dư) vào dung dịch Fe(NO3)3.
(d) Cho Na2CO3 vào dung dịch Ca(HCO3)2 (tỉ lệ mol 1 : 1).
(e) Cho hỗn hợp BaO và Al2O3 (tỉ lệ mol 1 : 1) vào nước (dư).
(g) Cho hỗn hợp Fe2O3 và Cu (tỉ lệ mol 1 : 1) vào dung dịch HCl (dư).
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được dung dịch chứa một muối là
A. 4. B. 1. C. 2. D. 3.
(Xem giải) Câu 8: Cho phương trình hóa học sau: aFeSO4 + bK2Cr2O7 + cH2SO4 → dFe2(SO4)3 + eK2SO4 + fCr2(SO4)3 + gH2O. Tỉ lệ a : b là
A. 6 : 1. B. 1 : 6. C. 3 : 2. D. 2 : 3.
(Xem giải) Câu 9: Cho bảng số liệu sau:
| Tính chất/Chất | HF | HCl | HBr | HI |
| Năng lượng liên kết H-X (kJ/mol) | 565 | 431 | 364 | 297 |
| Độ dài liên kết H-X (Å) | 0,92 | 1,27 | 1,41 | 1,60 |
| Nhiệt độ nóng chảy (°C) | -83 | -114,2 | -88 | -50,8 |
| Nhiệt độ sôi (°C) | 19,5 | -84,9 | -66,7 | -35,8 |
Phát biểu nào sau đây không đúng?
A. Chiều tăng dần tính acid HF < HCl < HBr < HI.
B. Ở điều kiện thường (25°C), các chất HF, HCl, HBr, HI đều ở thể khí.
C. Nhiệt độ sôi của HF cao bất thường so với các chất còn lại là do năng lượng liên kết H-F lớn.
D. Nhiệt độ sôi HCl < HBr < HI là do tương tác van der Waals giữa các phân tử tăng dần.
(Xem giải) Câu 10: Acid béo omega-3; omega-6 và omega-9 đều là những acid béo quan trọng đối với cơ thể người. Một loại sữa trên thị trường có thành phần dinh dưỡng như sau:
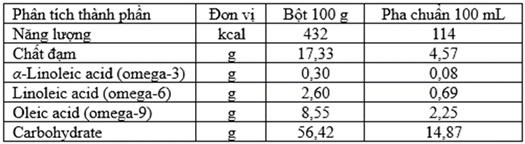
Từ thông tin đã cung cấp ở trên, có các nhận định sau:
(a) Các acid béo trên đều không no và mạch không phân nhánh.
(b) Các acid béo trên đều có cùng số nguyên tử carbon.
(c) Omega-3 và omega-6 là những acid béo có liên kết đôi ở vị trí thứ 3 và 6 so với nhóm -COOH.
(d) Phân tử omega-9 có ít hơn một liên kết pi (π) so với phân tử omega-6.
(e) Vitamin A hòa tan tốt trong chất béo nên chúng được vận chuyển và hấp thụ cùng chất béo.
(f) Dầu cá biển chứa nhiều omega-6; dầu thực vật chứa omega-3.
Số nhận định đúng là
A. 5. B. 4. C. 2. D. 3.
(Xem giải) Câu 11: Phenylalanine (Phe) là một loại amino acid thiết yếu, tham gia vào cấu tạo của protein và được sử dụng làm thuốc hỗ trợ điều trị bệnh trầm cảm, bệnh bạch biến trong y học. Công thức cấu tạo của Phe như sau:
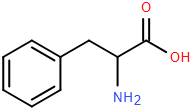
Cho độ tan của Phe (gam/100 gam nước) ở các nhiệt độ khác nhau:
| Nhiệt độ (°C) | 25 | 50 | 75 | 100 | |
| Độ tan | 1,00 | 1,41 | 2,19 | 3,71 | 6,89 |
Cho các nhận định sau:
(a) Phe thuộc loại α-amino acid và có tính chất lưỡng tính.
(b) Ở pH = 2, Phe di chuyển về phía cực dương của điện trường.
(c) Ở 25°C, dung dịch Phe bão hoà có nồng độ là 1,41%.
(d) Tinh chế được Phe bằng phương pháp kết tinh.
Các nhận định đúng là
A. (b), (d). B. (a), (c). C. (b), (c). D. (a), (d).
(Xem giải) Câu 12: Methane và acetylene cháy trong oxygen theo các phản ứng hóa học sau:
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (g) (1)
2C2H2 (g) + 5O2 (g) → 4CO2 (g) + 2H2O (g) (2)
Biết nhiệt tạo thành chuẩn của một số chất:
| Chất | CH4 (g) | C2H2 (g) | CO2 (g) | H2O (g) |
 (kJ/mol) (kJ/mol) |
-74,6 | 227,4 | -393,5 | -241,8 |
Cho các phát biểu sau:
(a) Biến thiên enthalpy chuẩn của phản ứng (2) là -2512,4 kJ.
(b) Nếu đốt cháy cùng số mol thì lượng nhiệt tỏa ra từ C2H2 gấp CH4 là 3,131 lần.
(c) Phản ứng (2) xảy ra thuận lợi hơn phản ứng (1) về nhiệt.
(d) Biến thiên enthalpy chuẩn của phản ứng (1) là -800,5 kJ.
Số phát biểu đúng là
A. 3. B. 1. C. 4. D. 2.
(Xem giải) Câu 13: Thực hiện phản ứng hóa học sau: CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O. Theo dõi tổng thể tích CO2 thu được theo thời gian, thu được đồ thị như sau (thể tích khí được đo ở áp suất khí quyển và nhiệt độ phòng).
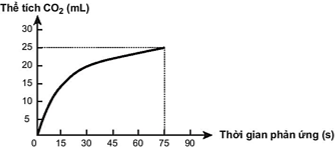
Cho các phát biểu sau:
(a) Ở thời điểm 90 giây, tốc độ phản ứng bằng 0 mL/s.
(b) Tốc độ phản ứng tăng dần theo thời gian.
(c) Tốc độ trung bình của phản ứng trong khoảng thời gian từ thời điểm đầu đến 75 giây xấp xỉ 0,33 mL/s.
(d) Nếu ban đầu, lấy nồng độ dung dịch HCl gấp 2 lần thì tốc độ phản ứng xảy ra nhanh hơn.
Số phát biểu đúng là
A. 2. B. 4. C. 1. D. 3.
(Xem giải) Câu 14: Cho cân bằng: 2SO2(g) + O2(g) ⇌ 2SO3(g). Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này là
A. phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
B. phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
C. phản ứng nghịch toả nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
D. phản ứng thuận toả nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
(Xem giải) Câu 15: Cho các nhận định sau về phân tử ammonia và ion ammonium:
(a) Nguyên tử N đều còn một cặp electron hóa trị chưa tham gia liên kết.
(b) Trong dung dịch ammonia chỉ chứa NH3 và NH4+.
(c) Đều có tính base yếu theo Brønsted – Lowry.
(d) Nguyên tử nitrogen đều có số oxi hóa là -3.
Số nhận định đúng là
A. 4. B. 2. C. 3. D. 1.
(Xem giải) Câu 16: Cho các thế điện cực chuẩn (E°) của các cặp oxi hóa khử như bảng sau:
| Cặp oxi hóa – khử | Al3+/Al | Zn2+/Zn | Pb2+/Pb | Cu2+/Cu |
| Thế điện cực chuẩn E°(V) | -1,676 | -0,762 | -0,126 | +0,340 |
Pin có sức điện động chuẩn lớn nhất là
A. Zn – Cu. B. Al – Cu. C. Pb – Cu. D. Al – Zn.
(Xem giải) Câu 17: Cho cấu tạo dạng mạch vòng của saccharose và maltose lần lượt như hình sau:
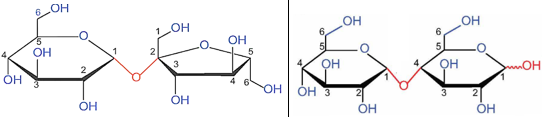
Nhận định nào sau đây đúng?
A. Saccharose và maltose đều phản ứng được với thuốc thử Tollens.
B. Nhóm -OH ở nguyên tử C số 1 trong maltose là nhóm -OH hemiacetal.
C. Nhóm -OH ở nguyên tử C số 2 trong saccharose là nhóm -OH hemiketal.
D. Maltose và saccharose đều có thể mở vòng.
(Xem giải) Câu 18: Cho các phát biểu sau:
(a) Chưng cất là phương pháp tách chất dựa vào sự khác nhau về nhiệt độ sôi của các chất trong hỗn hợp ở một áp suất nhất định.
(b) Phương pháp kết tinh dùng để tách biệt và tinh chế hỗn hợp các chất rắn dựa vào độ tan khác nhau và sự thay đổi độ tan của chúng theo nhiệt độ.
(c) Khi tiến hành tách riêng hỗn hợp xăng và nước bằng phương pháp chiết, nước sẽ được chiết ra trước.
(d) Trong phương pháp chưng cất, chất có nhiệt độ sôi cao hơn chuyển thành hơi sớm hơn.
Số phát biểu đúng là
A. 3. B. 4. C. 1. D. 2.
(Xem giải) Câu 19: Aspartame (APM) là một chất làm ngọt nhân tạo, còn được gọi là đường hóa học không chứa đường saccharide, có độ ngọt gấp 200 lần đường ăn thông thường. Công thức cấu tạo của APM cho như hình bên.
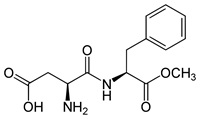
Cho các phát biểu sau:
(a) Công thức phân tử của APM là C14H18N2O5.
(b) Trong phân tử APM có 1 liên kết amide.
(c) APM bền trong môi trường axit nhưng kém bền trong môi trường kiềm.
(d) Cho 29,4 gam APM tác dụng hết với 200 mL dung dịch NaOH 2M thu được dung dịch X, cô cạn X thu được chất rắn có khối lượng 43,6 gam.
Số phát biểu đúng là
A. 3. B. 5. C. 2. D. 4.
(Xem giải) Câu 20: Cho dãy các chất: vinyl acetate, benzyl acetate, phenyl acetate, methyl methacrylate, methyl acetate, ethyl formate, tripalmitin. Số chất trong dãy khi thủy phân trong dung dịch NaOH (dư), đun nóng sinh ra alcohol là
A. 3. B. 4. C. 2. D. 5.
II. Dạng 2: Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 6. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 21: Salbutamol là chất cực kì nguy hiểm cho sức khỏe, nhiều hộ chăn nuôi nhỏ lẻ cố tình trộn các chất tăng trọng có chứa salbutamol vào thức ăn cho lợn trước thời kì bán thúc. Lợn ăn thức ăn này thịt đỏ tươi hơn, nạc nhiều, tăng trọng nhanh. Tồn dư salbutamol trong thịt gây độc hại cho người sử dụng. Salbutamol có công thức cấu tạo như hình dưới đây:
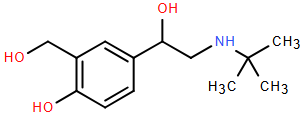
Cho các phát biểu sau:
a) Công thức phân tử của salbutamol là C13H21NO3.
b) Salbutamol có khả năng phản ứng với nước Br2 ở điều kiện thường.
c) Salbutamol là hợp chất hữu cơ đa chức vì có chứa nhiều nhóm chức.
d) Cho 0,15 mol salbutamol phản ứng với 0,2 mol HCl thu dược dung dịch X. Dung dịch X sau phản ứng cho tác dụng với dung dịch NaOH dư thu được dung dịch Y. Khối lượng muối thu được trong dung dịch Y là 44,25 gam.
(Xem giải) Câu 22: Chất béo là nguồn cung cấp và dự trữ năng lượng ở người và động vật. Chất béo là nguyên liệu cho ngành công nghiệp thực phẩm, sản xuất xà phòng và glycerol.
a) Nên chiên rán thức ăn bằng dầu ăn ở nhiệt độ vừa phải; không nên để dầu ăn bị cháy; sử dụng dầu ăn đã qua chế biến nhiều lần sẽ gây ảnh hưởng không tốt cho sức khỏe.
b) Một loại mỡ động vật có chứa 40% tristearin, 40% tripalmitin và 20% triolein về khối lượng. Xà phòng hoá 1 tấn mỡ trên bằng dung dịch NaOH với hiệu suất cả quá trình là 85%, thu được lượng muối dùng để sản xuất tối đa m tấn xà phòng (chứa 72% khối lượng là muối của acid béo). Giá trị của m là 1,32 (Làm tròn kết quả đến hàng phần trăm).
c) Chất béo khi được chuyển hóa sẽ cung cấp năng lượng ít hơn carbohydrate (ở dạng tinh bột hoặc đường).
d) Khi ăn các món ăn như thịt mỡ, gà rán…người ta thường ăn kèm với những đồ ăn có tính chua như dưa muối, salad vừa giúp tăng cảm giác ngon miệng, vừa giúp cho cơ thể dễ tiêu hóa chất béo trong thức ăn.
(Xem giải) Câu 23: Hiện nay, pin lithium ion được sử dụng phổ biến trong nhiều thiết bị như điện thoại, laptop, xe điện,… do có ưu điểm gọn nhẹ và có mật độ năng lượng cao. Xét một pin lithium ion có cathode làm từ LiMn2O4 và anode làm từ graphite. Giữa các lớp của graphite có các nguyên tử xâm nhập tạo thành hợp chất ion có công thức dạng LixC6. Phản ứng tổng cộng xảy ra trong pin khi phóng điện và khi nạp điện như sau: Li1-xMn2O4 + LixC6 ⇋ Li1Mn2O4 + C6 (chiều thuận phóng điện, chiều nghịch nạp điện)
a) Khi pin phóng điện, ở anode xảy ra quá trình oxi hoá LixC6 thành xLi+ và C6.
b) Số oxi hoá của Mn trong Li1-xMn2O4 thấp hơn trong Li1Mn2O4.
c) Nếu x = 0,24 thì khi phóng điện, 1 mol LixC6 cung cấp 0,04 mol electron.
d) Khi pin nạp điện, ở anode xảy ra quá trình khử LiMn2O4 thành Li1-xMn2O4 và xLi+.
(Xem giải) Câu 24: Cho hai chất hữu cơ mạch hở E, F có cùng thành phần nguyên tố: 40,00% C; 6,67% H và 53,33% O về khối lượng. Trên phổ MS, peak ion phân tử của E và F đều nhỏ hơn 100. Cho phổ IR của E và F:
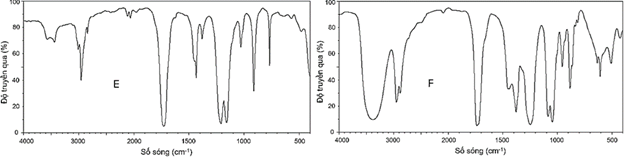
Đun nóng E, F với dung dịch NaOH (dư) đều tạo ra sản phẩm gồm hai chất hữu cơ, trong đó sản phẩm của F có chứa alcohol đa chức.
a) E và F đều chứa một nhóm chức ester.
b) Đun nóng hỗn hợp E và F với dung dịch NaOH (dư) tạo ra một muối.
c) E có nhiệt độ sôi cao hơn F.
d) E và F đều không tạo được liên kết hydrogen với nước.
(Xem giải) Câu 25: Cho các phản ứng:
(1) H2(g) + Cl2(g) → 2HCl(g) ![]() = -184,6 kJ
= -184,6 kJ
(2) CO2(g) + H2(g) → CO(g) + H2O(g) ![]() = +41,2 kJ
= +41,2 kJ
(3) C(s) + ½O2(g) → CO(g) ![]() = -110,5 kJ
= -110,5 kJ
(4) H2(g) + ½O2(g) → H2O(g) ![]() = -241,8 kJ
= -241,8 kJ
a) Nhiệt tạo thành chuẩn của CO2(g) là -393,5 kJ/mol.
b) Nhiệt tạo thành chuẩn của HCl là -184,6 kJ/mol.
c) Ở điều kiện chuẩn (25°C, áp suất 1 bar), phản ứng (2) xảy ra thuận lợi nhất về nhiệt.
d) Có 3 phản ứng tỏa nhiệt và 1 phản ứng thu nhiệt.
(Xem giải) Câu 26: Để xác định hàm lượng Fe2+ trong một lọ muối Mohr (có công thức (NH4)2SO4.FeSO4.6H2O) người ta tiến hành thí nghiệm như sau:
– Cân 5,00 gam muối rồi hoà tan vào nước, thêm tiếp 5 mL dung dịch H2SO4 20%, thêm nước cất vào để định mức được 200 mL dung dịch (kí hiệu là dung dịch X).
– Lấy 10 mL dung dịch X đem chuẩn độ bằng dung dịch chuẩn KMnO4 0,02 M thì thấy hết 5 mL.
a) Phương trình phản ứng chuẩn độ: 6FeSO4 + 2KMnO4 + 4H2SO4 → 3Fe2(SO4)3 + K2SO4 + 2MnO2 + 4H2O.
b) Thời điểm kết thúc chuẩn độ là lúc dung dịch xuất hiện màu hồng ổn định khoảng 20 giây.
c) Khi hòa tan muối Mohr trong nước sẽ cho môi trường acid.
d) Hàm lượng Fe trong mẫu muối Mohr đem phân tích ở trên là 1,12%.
III. Dạng 3: Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời các câu hỏi từ câu 1 đến câu 6.
(Xem giải) Câu 1: Chất bột, chất béo và chất đạm là nguồn cung cấp năng lượng chính cho cơ thể con người. Năng lượng cung cấp (kJ) từ mỗi gam bột, chất béo và chất đạm được cho ở biểu đồ sau.
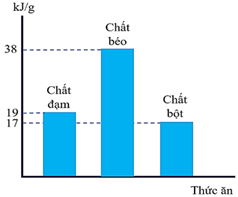
Giả thiết mỗi ngày, một học sinh lớp 12 cần năng lượng 9690 kJ, trong đó chất bột, chất béo và chất đạm lần lượt đóng góp 60%, 20% và 10% nguồn năng lượng đó. Theo số liệu trên, mỗi ngày học sinh nên ăn x gam chất bột, y gam chất béo và z gam chất đạm sẽ là phù hợp nhất. Giá trị tổng (x + y + z) bằng bao nhiêu? (Làm tròn kết quả đến phần nguyên)
(Xem giải) Câu 2: Hiện nay người ta sản xuất NH3 theo chu trình Haber – Bosch bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí methane (trong các tháp phản ứng) qua các giai đoạn theo sơ đồ sau:
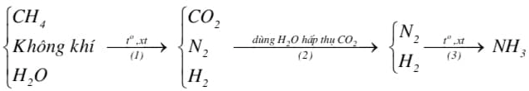
Nếu lấy 1000 m³ không khí (chứa 21% O2 và 78% N2 còn lại là CO2) thì cần phải lấy V m³ khí methane để thu được N2 và H2 theo tỉ lệ 1 : 3 về thể tích dùng cho phản ứng tổng hợp ammonia. Biết các phản ứng xảy ra ở giai đoạn (1) đều xảy ra hoàn toàn. Các khí và hơi đo ở cùng điều kiện. Xác định giá trị của V.
(Xem giải) Câu 3: Một nonapeptide (E) được sản sinh từ huyết thanh trong máu, có thể bị thuỷ phân hoàn toàn trong môi trường acid để tạo ra 3 phân tử Pro, 2 phân tử Arg, 2 phân tử Phe, 1 phân tử Ser và 1 phân tử Gly. Xử lí E bằng enzyme chymotrypsin tạo ra pentapeptide Arg-Pro-Pro-Gly-Phe, tripeptide Ser-Pro-Phe và Arg. Phân tích đầu N và đầu C của peptide E thấy các amino acid đều giống nhau. Cho biết trong trình tự các amino acid có trong nonapeptide, nếu đánh số thứ tự amino acid đầu N là số 1 thì Ser ở vị trí số mấy trong E?
(Xem giải) Câu 4: Cho vào bình cầu: 15 mL isoamyl alchohol, 15 mL acetic acid tuyệt đối và 10 mL dung dịch H2SO4 đặc. Lắp dụng cụ như hình vẽ, tiến hành thực hiện thí nghiệm; chất lỏng thu được ở bình tam giác cho vào phễu chiết cùng dung dịch NaCl bão hòa.
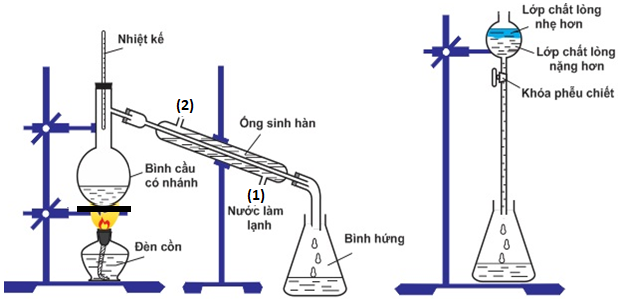
Cho các phát biểu:
(a) Trong phễu chiết lớp chất lỏng nặng hơn có thành phần chính là isoamyl acetate.
(b) Nhiệt kế dùng để kiểm soát nhiệt độ.
(c) Phễu chiết dùng tách các chất lỏng không tan vào nhau ra khỏi nhau.
(d) Isoamyl acetate tinh khiết có thể được sử dụng làm hương liệu phụ gia cho thực phẩm.
(e) Để hiệu suất phản ứng cao hơn nên dùng dung dịch acetic acid 5%.
(f) Nước trong ống sinh hàn được lắp cho chảy vào (1) và ra (2).
Số các phát biểu đúng là bao nhiêu?
(Xem giải) Câu 5: Docosahexaenoic acid (DHA) là một acid béo không no, mạch hở, có công thức phân tử là C22H32O2. DHA thuộc loại acid béo omega-3, có vai trò quan trọng trong cơ thể, chiếm hàm lượng cao trong tổng lượng acid béo không no trong não và trong võng mạc. Số liên kết đôi C=C có trong DHA bằng bao nhiêu?
(Xem giải) Câu 6: Cho bốn amino acid: alanine (Ala), phenylalanine (Phe), lysine (Lys), aspartic acid (Asp) có công thức cấu tạo như sau:
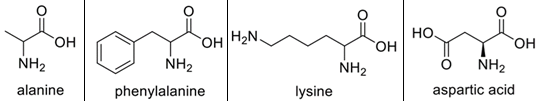
Tiến hành điện di dung dịch gồm bốn amino acid trên tại pH = 6 thu được kết quả như minh hoạ ở hình sau đây:
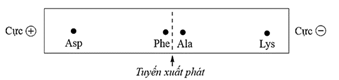
Trong dung dịch, giá trị pH mà tại đó amino acid tồn tại chủ yếu ở dạng ion lưỡng cực có tổng điện tích bằng 0 được gọi là pHI. Cho các giá trị pHI được đánh số từ 1 đến 4: 2,98 (1); 5,91 (2); 6,11 (3); 9,87 (4). Gán số thứ tự giá trị pHI tương ứng với các amino acid: Ala, Phe, Lys, Asp và sắp xếp theo trình tự dãy bốn số (Câu: 1234, 4321,…).
PHẦN II: TỰ LUẬN (6,0 điểm).
(Xem giải) Câu 1. (1,5 điểm). Sulfuric acid là một trong những hóa chất quan trọng nhất được sử dụng trong công nghiệp; được sản xuất hàng trăm triệu tấn mỗi năm, chiếm nhiều nhất trong ngành công nghiệp hóa chất. Phương pháp sản xuất sulfuric acid phổ biến nhất là phương pháp tiếp xúc, theo đó acid có thể được sản xuất từ quặng pyrite qua các giai đoạn theo sơ đồ sau:
(1) FeS2(s) + O2(g) → Fe2O3(s) + SO2(g)
(2) 2SO2(g) + O2(g) ⇌ 2SO3(g) ![]() = -197,8 kJ
= -197,8 kJ
(3) H2SO4(aq) + SO3(g) → H2SO4.nSO3(l)
(4) H2SO4.nSO3(l) + H2O(l) → H2SO4(aq)
Dùng sulfuric acid 98% hấp thụ SO3(g) trong giai đoạn (3), quá trình này được thực hiện trong tháp tiếp xúc. Để xác định công thức của oleum thu được, người ta pha loãng 6,3375 gam oleum vào nước thành 1,0 lít dung dịch sulfuric acid, sau đó tiến hành chuẩn độ 10,00 mL dung dịch acid này bằng dung dịch chuẩn NaOH 0,10 M. Thể tích NaOH trung bình cần sử dụng để chuẩn độ là 15 mL.
a. Trình bày cân bằng phản ứng (1) bằng phương pháp thăng bằng electron.
b. Cho biết các biện pháp có thể áp dụng để tăng hiệu suất cân bằng (2) và giải thích.
c. Xác định công thức của oleum.
Câu 2 (2,0 điểm).
(Xem giải) 1. Xác định các chất X (MX ≤ 362; chỉ chứa nhóm chức trong các nhóm: -OH; -COOH; -COO-) , X1, X2, X3, X4, X5 và hoàn thành các phản ứng hóa học sau đây:
(1) X + NaOH → X1 + X2 + H2O
(2) X1 + H2SO4 → Na2SO4 + X3
(3) nX3 + nX4 → poly(hexamethylene adipamide) + 2nH2O
(4) nX5 + nX2 → poly(ethylene terephthalate) + 2nH2O
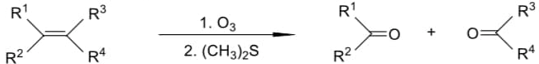
(Xem giải) 2. Liên kết đôi C=C bị oxi hóa bằng phản ứng ozone phân khử hoặc ozone phân oxi hóa tạo ra các sản phẩm hữu cơ chứa oxygen. Nếu thực hiện ozone phân rồi và khử ngay bằng chất khử êm dịu như dimethyl sulfide (CH3)2S thì thu được sản phẩm theo sơ đồ sau:
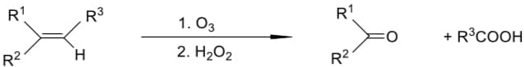
Còn nếu thực hiện ozone phân và oxi hóa ngay bằng chất oxi hóa như H2O2 thì khi đó nhóm chức aldehyde sinh ra sẽ bị oxi hóa thành nhóm caborxylic acid còn nhóm chức ketone không bị oxi hóa vì vậy sản phẩm thu được cuối cùng là carboxylic acid và ketone theo sơ đồ sau:
Thực hiện phản ứng ozone phân theo sơ đồ:
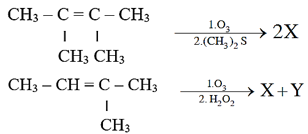
a. Viết công thức cấu tạo và gọi tên các chất hữu cơ X, Y.
b. Từ tinh dầu chanh người ta phân lập được chất A và tiến hành phân tích nguyên tố chất A thu được 88,2353% carbon còn lại là hydrogen về khối lượng. Dựa vào phổ khối lượng (MS) xác định được phân tử khối của A bằng 136. Khi tiến hành ozone phân khử A thu được sản phẩm theo sơ đồ sau:
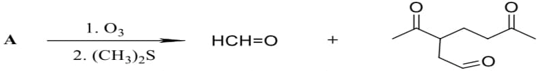
Xác định công thức phân tử và viết công thức cấu tạo có thể có của A.
Câu 3 (2,5 điểm).
(Xem giải) 1. Hãy nêu hiện tượng xảy ra và viết phương trình hóa học cho các thí nghiệm dưới đây.
a. Cho CH3NH2 từ từ đến dư vào dung dịch CuSO4.
b. Cho từ từ vài giọt dung dịch C6H5NH2 loãng vào nước Br2.
c. Cho dung dịch glucose C6H12O6 vào ống nghiệm chứa thuốc thử Tollens rồi đun nóng nhẹ.
d. Cho glycerol C3H5(OH)3 dư vào ống nghiệm chứa Cu(OH)2 và lắc nhẹ.
(Xem giải) 2. Hiện nay, xăng sinh học E5 (xăng chứa 5% ethanol về thể tích) đang được sử dụng ở nước ta để thay thế một phần xăng truyền thống. Trong một nhà máy, ethanol được sản xuất từ cellulose theo sơ đồ sau (với hiệu suất của cả quá trình là 60%): (C6H10O5)n → C6H12O6 → C2H5OH. Toàn bộ lượng ethanol thu được từ 1,62 tấn mùn cưa (chứa 50% cellulose) dùng để pha chế thành V lít xăng E5. Biết ethanol có khối lượng riêng là 0,8 g/mL. Tính giá trị của V.
(Xem giải) 3. Trong trường hợp tổng quát, pin Galvani được ký hiệu như sau: (-) A | An+ | | Bm+ | B (+)
Trong đó dấu | | chỉ cầu muối, A | An+ và Bm+ | B là các điện cực kim loại được nhúng vào dung dịch muối tương ứng của chúng. Thế điện cực của các cặp oxi hóa – khử được tính theo phương trình Nernst:
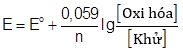
Trong đó: n là số electron trao đổi của cặp oxi hóa khử; E° là thế điện cực chuẩn của cặp oxi hóa – khử đó.
Cho pin điện hoá: (-) Zn | Zn(NO3)2 0,2M | | AgNO3 0,1M | Ag (+)
Biết các dung dịch Zn(NO3)2 và AgNO3 trong pin điện đều có thể tích 1,000 L và ở 25°C, thế điện cực chuẩn của E°Zn2+/Zn = -0,762V và E°Ag+/Ag = +0,799V.
a. Viết các quá trình xảy ra ở mỗi điện cực, phản ứng khi pin hoạt động.
b. Tính sức điện động của pin thời điểm ban đầu.


Bình luận