[2025] Thi thử TN trường Nguyễn Hiền – TP Hồ Chí Minh
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 129
⇒ Đề thi, đáp án và giải chi tiết:
| 1D | 2C | 3D | 4D | 5B | 6B | 7B | 8C | 9C |
| 10B | 11B | 12B | 13D | 14C | 15D | 16D | 17A | 18D |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | Đ | S | Đ | Đ | 138 | 134 | 1,3 |
| (b) | Đ | Đ | S | Đ | 26 | 27 | 28 |
| (c) | S | S | Đ | S | 484 | 97,6 | 9,3 |
| (d) | S | Đ | S | Đ |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Có 4 ester no, đơn chức, mạch hở kí hiệu ngẫu nhiên lần lượt là X, Y, Z, T. Phân tử ester của mỗi chất nêu trên đều tạo bởi các carboxylic acid mạch không phân nhánh và ethyl alcohol. Độ tan của 4 ester như sau:
| Ester | X | Y | Z | T |
| Độ tan (g/100 g nước, ở 25°C) | 2,2 | 10,5 | 8,7 | 4,9 |
Trong số 4 ester trên, ester có nhiều nguyên tử carbon nhất trong phân tử là
A. Y. B. Z. C. T. D. X.
(Xem giải) Câu 2. Trong các chất dưới đây, chất nào là amine bậc hai?
A. CH3CH2NH2. B. C6H5NH2. C. CH3NHCH3. D. H2N[CH2]6NH2.
(Xem giải) Câu 3. Chất có phản ứng tạo màu xanh tím với thuốc thử I2 là
A. cellulose. B. maltose. C. glucose. D. tinh bột.
(Xem giải) Câu 4. Chất nào sau đây là thành phần chính của xà phòng?
A. CH3COONa. B. CH3[CH2]10CH2C6H4SO3Na.
C. C3H5(OH)3. D. CH3[CH2]16COONa.
(Xem giải) Câu 5. Quặng nào sau đây có thể dùng làm nguyên liệu chính để tách kim loại sắt trong ngành luyện kim?
A. Halite. B. Hematite. C. Bauxite. D. Dolomite.
(Xem giải) Câu 6. Chất X được sử dụng chủ yếu sản xuất phân đạm, nhiên liệu tên lửa, được dùng làm chất gây lạnh trong thiết bị lạnh ở dạng lỏng. Chất X là chất nào sau đây?
A. Sulfuric acid. B. Ammonia.
C. Sodium carbonate. D. Ammonium nitrate.
(Xem giải) Câu 7. Ba chất A, B, C theo thứ tự có nhiệt độ sôi tăng dần. Các chất A, B, C nào dưới đây phù hợp:
A. acetic acid, acetaldehyde, ethanol.
B. acetaldehyde, ethanol, acetic acid.
C. ethanol, acetaldehyde, acetic acid.
D. acetaldehyde, acetic acid, ethanol.
(Xem giải) Câu 8. Phản ứng nhiệt phân muối carbonate nào sau đây cần cung cấp nhiều nhiệt lượng nhất?
A. MgCO3(s) (t°) → MgO(s) + CO2(g) ![]() = 100,7 kJ
= 100,7 kJ
B. SrCO3(s) (t°) → SrO(s) + CO2(g) ![]() = 234,6 kJ
= 234,6 kJ
C. BaCO3(s) (t°) → BaO(s) + CO2(g) ![]() = 271,5 kJ
= 271,5 kJ
D. CaCO3(s) (t°) → CaO(s) + CO2(g) ![]() = 179,2 kJ
= 179,2 kJ
(Xem giải) Câu 9. Trong quá trình điện phân KBr nóng chảy, phản ứng nào xảy ra ở điện cực dương (anode)?
A. Ion K+ bị oxi hoá. B. lon K+ bị khử.
C. Ion Br- bị oxi hoá. D. Ion Br- bị khử.
(Xem giải) Câu 10. Cho pin Galvani Zn-Cu có cấu tạo như hình sau, ở 25°C.

Đóng kín mạch bằng cầu muối chứa dung dịch bão hoà KNO3. (Biết E°Zn2+/Zn = -0,762V). Chọn phát biểu đúng?
A. Tại điện cực dương, cathode xảy ra quá trình: Zn → Zn2+ + 2e.
B. Khi pin hoạt động các electron theo dây dẫn di chuyển từ thanh Zn sang thanh Cu .
C. Nếu thay Zn bằng Fe thì sức điện động chuẩn của pin không thay đổi.
D. Ứng với pin Galvani này, thế điện cực chuẩn E°Cu2+/Cu = +1,86V.
(Xem giải) Câu 11. Cho phản ứng hoá học: (CH3)3CBr + NaOH → (CH3)3COH + NaBr (∗) xảy ra theo cơ chế gồm hai giai đoạn:
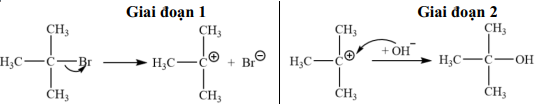
Nhận định nào sau đây đúng?
A. Phản ứng (∗) là phản ứng cộng.
B. Trong giai đoạn 2 có sự hình thành liên kết σ.
C. Trong phân tử tert-butyl bromide có 12 liên kết σ.
D. Giai đoạn 1 của cơ chể phản ứng có sự phân cắt liên kết π.
(Xem giải) Câu 12. Một số loại sắn có chứa lượng chất cyanhydric acid (HCN), đây là một chất có thể gây độc chết người. Cách đơn giản để chuyển hóa HCN là cho HCN kết hợp nhóm carbonyl (C=O) để chuyển thành hợp chất chứa nhóm -C(OH)CN. Loại thực phẩm nào sau đây có thể cung cấp nhóm carbonyl để giải độc nhanh nhất cho người ngộ độc?
A. Gạo trắng. B. Đường glucose. C. Giấm ăn. D. Dầu ăn.
(Xem giải) Câu 13. Cho khối lượng riêng của các chất:
| Chất | Li | Na | K | Ca | Dầu hỏa |
| d (g/cm³) | 0,53 | 0,97 | 0,86 | 1,54 | 0,80 |
Để bảo quản một số kim loại mạnh, người ta ngâm chìm các kim loại đó vào trong dầu hỏa. Hãy cho biết kim loại nào không bảo quản được bằng cách cho vào dầu hỏa?
A. K. B. Na. C. Ca. D. Li.
(Xem giải) Câu 14. Charles Goodyear khám phá ra phương pháp kết hợp giữa nguyên tố sulfur với cao su thiên nhiên để tạo ra một loại cao su có cấu trúc dạng mạch không gian, làm tăng cao tính bền cơ học, khả năng chịu được sự ma sát, va chạm. Loại cao su này có tên là
A. cao su buna-N. B. cao su buna-S. C. cao su lưu hóa. D. cao su buna.
(Xem giải) Câu 15. Cấu hình electron nào sau đây là của kim loại chuyển tiếp dãy thứ nhất?
A. [Ar]4s2. B. [Ar]3d10 4s2 4p1.
C. [Ar] 3d10 4s2 4p6. D. [Ar] 3d7 4s2.
(Xem giải) Câu 16. Cho các cặp oxi hóa – khử và thế điện cực chuẩn tương ứng:
| Cặp oxi hóa – khử | 2X+/X2 | Y2+/Y | X2+/Z | T+/T |
| Thế điện cực chuẩn (V) | 0,00 | +0,34 | -0,44 | +0,799 |
Khi điện phân dung dịch chứa đồng thời bốn loại cation ở trên với nồng độ mol bằng nhau, cation đầu tiên bị điện phân đầu tiên ở cathode là
A. Z2+. B. Y2+. C. X+. D. T+.
(Xem giải) Câu 17. Kim loại tungsten (W) được dùng làm dây tóc trong bóng đèn chủ yếu nhờ vào đặc điểm nào sau đây?
A. Nhiệt độ nóng chảy cao. B. Tính dẻo cao.
C. Độ cứng lớn. D. Khả năng dẫn điện tốt.
(Xem giải) Câu 18. Cho một số thông tin về chất lỏng hexane (C6H14):
Khối lượng riêng: 0,66 g/cm³
Điểm chớp cháy: -22°C
Nhiệt độ tự bốc cháy: 259°C
Nhiệt độ ngọn lửa: 2040°C
Điểm chớp cháy là nhiệt độ thấp nhất mà một chất lỏng hoặc vật liệu dễ bay hơi tạo thành lượng hơi đủ để bốc cháy trong không khí khi tiếp xúc nguồn lửa. Chất lỏng có điểm chớp cháy nhỏ hơn 37,8°C là chất lỏng dễ cháy. Nhiệt độ tự bốc cháy là nhiệt độ mà tại đó chất cháy tự bốc cháy mà không cần nguồn lửa. Nhiệt độ ngọn lửa là nhiệt độ cao nhất có thể tạo ra bởi chất cháy. Áp suất đều bằng áp suất khí quyển. Cho các phát biểu dưới đây (ở áp suất khí quyển):
(a) Hexane là chất lỏng dễ cháy.
(b) Ở 100°C, hexane tự bốc cháy mà không cần nguồn lửa.
(c) Có thể dùng hexane để nấu chảy chì (lead, nhiệt độ nóng chảy là 328°C).
(d) Khi xảy ra đám cháy với lượng lớn hexane không thể dùng nước để dập tắt đám cháy.
Trong các phát biểu trên, có bao nhiêu phát biểu đúng?
A. 1. B. 2. C. 4. D. 3.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Mỗi năm, lượng dầu ăn phế thải từ các nhà hàng, quán ăn thải ra môi trường gây ô nhiễm, làm lãng phí tài nguyên. Xuất phát từ thực trạng đó, một nhóm nghiên cứu khoa học đã sử dụng dầu ăn thải để tổng hợp nhiên liệu sinh học biodiesel.
Biodiesel được sản xuất thông qua phản ứng giữa chất béo và các alcohol mạch ngắn (thường là methanol CH3OH) với xúc tác kiềm (thường dùng NaOH), thu được biodiesel (dạng methyl ester) và glycerol.
Phản ứng tổng quát như sau: (RCOO)3C3H5 + 3CH3OH (NaOH) → 3RCOOCH3 + C3H5(OH)3
Nhóm học sinh đưa ra giả thuyết: “Xúc tác NaOH không gây phản ưng phụ trong quá trình sản xuất biodiesel, do đó dùng lượng xúc tác càng nhiều sẽ cho hiệu suất thu hồi biodiesel càng cao.”
Để kiểm chứng, nhóm này tiến hành phản ứng ở cùng điều kiện nhiệt độ và cố định tỷ lệ mol dầu : methanol, chỉ thay đổi lượng xúc tác NaOH (0,5 gam – 2,5gam). Kết quả được ghi lại như sau:
| Khối lượng NaOH (gam) | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
| Hiệu suất thu biodiesel (%) | 71,2 | 86,4 | 90,0 | 88,0 | 85,6 |
a) Lượng NaOH nếu dùng dư có thể gây phản ứng phụ tạo xà phòng, làm nhũ tương hóa sản phẩm và giảm hiệu suất tách biodiesel.
b) Khi dùng lượng xúc tác là 1,5 gam NaOH, hiệu suất thu hồi biodiesel đạt cao nhất.
c) Kết quả thực nghiệm cho thấy giả thuyết ban đầu của nhóm học sinh đặt ra hoàn toàn chính xác.
d) Một loại dầu ăn phế thải đã qua xử lý có chứa 60,2% chất béo (M = 860 amu). Nếu từ 500 kg dầu đó có khả năng chuyển hóa tối đa thành 302,4 kg biodiesel dạng methyl ester với hiệu suất đạt 90%.
(Xem giải) Câu 20. Một nhóm học sinh tiến hành thí nghiệm mạ đồng (copper) lên chiếc chìa khoá. Giả thuyết được nhóm học sinh này đưa ra là: “Nồng độ của dung dịch CuSO4 trước và sau quá trình mạ là không đổi”.
Để kiểm chứng giả thuyết, nhóm học sinh tiến hành các bước như sau:
– Bước 1: Cân để xác định khối lượng ban đầu của chiếc chìa khoá là 10 gam và của thanh đồng nguyên chất là 15 gam.
– Bước 2: Nối chiếc chìa khoá với 1 điện cực và thanh đồng với điện cực còn lại của nguồn điện một chiều rồi nhúng vào cốc chứa dung dịch CuSO4 để tiến hành mạ với hiệu điện thế thích hợp (như hình vẽ):
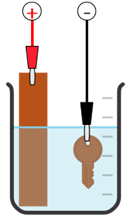
– Bước 3: Sau thời gian 15 phút điện phân, lấy chiếc chìa khoá và thanh đồng ra khỏi cốc, làm khô cẩn thận, đem cân thì thấy khối lượng của chiếc chìa khoá là 10,32 gam, của thanh đồng là 14,68 gam. Biết hiệu suất của quá trình đạt 100%.
a) Thanh đồng được nối với cực âm, chiếc chìa khoá được nối với cực dương của nguồn điện.
b) Tại cathode xảy ra quá trình khử ion Cu2+, tại anode xảy ra quá trình oxi hoá Cu.
c) Do khối lượng của thanh đồng giảm nên giả thuyết ban đầu của nhóm học sinh là sai.
d) Sau khi mạ xong, độ giảm khối lượng của thanh đồng bằng độ tăng khối lượng của chiếc chìa khoá.
(Xem giải) Câu 21. Aspartame là một chất tạo ngọt nhân tạo dành cho người cần kiểm soát lượng đường. Aspartame được tổng hợp từ sự kết hợp của hai amino acid: aspartic acid và phenylalanine, sau đó chuyển đổi nhóm carboxyl thành methyl ester để tạo nên cấu trúc ester đặc trưng. Về mặt hóa học, aspartame mang tính chất của peptide, amino acid, ester hữu cơ. Nhờ cấu trúc này, aspartame tạo cảm giác ngọt gấp hàng trăm lần so với đường mía (saccharose) nhưng lại cung cấp rất ít năng lượng. Tuy nhiên, điểm yếu của aspartame là tính không bền nhiệt, khiến nó bị phân hủy ở nhiệt độ cao tạo các amino acid tự do, lúc đó aspartame không còn vị ngọt.
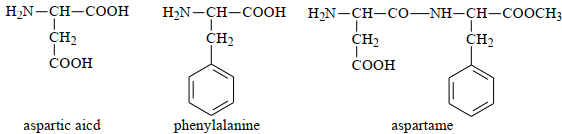
Điểm đẳng điện (pI) là giá trị pH mà tại đó amino acid tồn tại chủ yếu dưới dạng ion lưỡng cực có tổng điện tích bằng 0. Khi giá trị pH của môi trường khác với pI, amino acid sẽ tồn tại dưới dạng ion dương (cation) hoặc ion âm (anion), từ đó có thể di chuyển về các cực khác nhau trong điện trường.
| Giá trị pH của dung dịch so với giá trị pI | nhỏ hơn | bằng | lớn hơn |
| Dạng tồn tại của amino acid | cation | ion lưỡng cực | anion |
Điểm đẳng điện (pI) của aspartic acid là 2,82.
a) Phenylalanine thuộc loại α-amino acid.
b) Tại pH = 7, khi đặt vào một điện trường, aspatic acid di chuyển về phía cực âm.
c) Aspartame là một dipeptide có gắn nhóm ester trong cấu tạo phân tử.
d) Có thể sử dụng chất tạo ngọt aspartame để thay thế đường saccharose trong làm các loại bánh nướng.
(Xem giải) Câu 22. Cho các quá trình tạo phức chất bát diện sau:
Fe3+ + 6H2O ⇌ [Fe(OH2)6]3+ (aq) (1)
[Fe(OH2)6]3+ + SCN- ⇌ [Fe(OH2)5(SCN)]2+ + H2O; Kc = 1.4×10^2 (2)
[Fe(OH2)6]3+ + F- ⇌ [Fe(OH2)5F]2+ + H2O; Kc = 2.0×10^5 (3)
Biết các dung dịch: [Fe(OH2)6]3+ màu vàng nâu, [Fe(OH2)5(SCN)]2+ có màu đỏ, [Fe(OH2)5F]2+ và các anion SCN-, F- đều không có màu. Khi hằng số Kc càng lớn, phức chất tạo ra càng bền (phản ứng thuận chiếm ưu thế).
a) Trong các quá trình (1), (2) và (3), mỗi phân tử H2O hoặc anion SCN- hay anion F- đều sử dụng số cặp electron hoá trị riêng như nhau để cho vào orbital trống của cation Fe3+.
b) [Fe(OH2)6]3+ là phức chất aqua của ion kim loại chuyển tiếp.
c) So với anion F-, anion SCN- dễ thay thế phối tử H2O trong [Fe(OH2)6]3+ hơn.
d) Khi cho từ từ dung dịch KSCN vào dung dịch ở quá trình (3) thì dung dịch này sẽ có màu đỏ.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Methyl 4-hydroxybenzoate là ester được sử dụng làm chất bảo quản thực phẩm hoặc mĩ phẩm để ngăn chặn sự phát triển của nấm mốc, vi khuẩn có hại. Thuỷ phân methyl 4-hydroxybenzoate trong môi trường acid thu được chất hữu cơ X và một alcohol. Phân tử khối của X bằng bao nhiêu?
(Xem giải) Câu 24. Cho các hiện tượng sau:
(1) Bức tượng bằng đồng chuyển sang màu xanh (CuCO3.Cu(OH)2) khi để lâu ngoài không khí.
(2) Giấy “bạc” được sản xuất bằng cách cho các thỏi nhôm chuyển thành dạng lỏng ở nhiệt độ cao sau đó
đổ vào khuôn tạo thành phôi nhôm rồi đưa qua máy cán mỏng.
(3) Cánh cửa bằng thép lâu ngày chuyển từ màu xám thành màu nâu.
(4) Miếng Ag sử dụng khi đánh cảm chuyển từ màu sáng sang màu đen.
(5) Khi mài dao trên đá mài thì tại chỗ mài chuyển từ màu tối sang màu sáng.
Sắp xếp theo chiều tăng dần những hiện tượng tương ứng với quá trình ăn mòn kim loại? (ví dụ: 124,135,… ).
(Xem giải) Câu 25. Một nghiên cứu phân tích hàm lượng glutamic acid có trong mẫu nước mắm được thực hiện bởi phương pháp sắc ký lỏng hiệu năng cao (HPLC) với độ nhạy cao, độ chính xác tốt.
• Bước 1: Xây dựng đường tuyến tính từ các mẫu chuẩn giữa y (là diện tích peak trên phổ HPLC (đơn vị mAU∗min) và x (là nồng độ glutamic acid (đơn vị mg/L)) được kết quả như sau: y = 0,029x + 0,0202
• Bước 2: Cân chính xác 0,4329 gam một mẫu nước mắm hòa tan trong các dung môi thích hợp trong 24h, lọc loại bã thu được 10mL dung dịch gốc.
• Bước 3: Lấy 0,05 mL dung dịch gốc này, thêm nước cất để pha loãng thành 1 mL dung dịch phân tích rồi tiến hành đo HPLC. Ghi nhận được giá trị diện tích peak ứng với glutamic acid là 0,8467 mAU∗min.
Tính thành phần % về khối lượng của glutamic acid trong mẫu nước mắm? (đơn vị %, làm tròn đến hàng phần mười)
(Xem giải) Câu 26. Trong một nhà máy hoá chất, vôi sống (CaO) được sản xuất bằng cách nung đá vôi (CaCO3) theo phương trình hoá học (1) như sau: CaCO3(s) → CaO(s) + CO2(g)
Lượng nhiệt phản ứng (1) được cung cấp từ quá trình đốt cháy hoàn toàn carbon trong lò nung theo phương trình hoá học (2): C(graphite) + O2(g) → CO2(g) (2)
– Hiệu suất chuyển hóa CaCO3 thành CaO đạt 100%.
– Than dùng làm nhiên liệu chứa 80%C (graphite) về khối lượng, phần còn lại là tạp chất.
– Chỉ 50% nhiệt lượng sinh ra từ phản ứng (2) được sử dụng cho phản ứng (1).
Giá trị nhiệt tạo thành của các chất ở điều kiện chuẩn được cho trong bảng sau:
| Chất | CaCO3(s | CaO(s) | CO2(g) |
| -1207,0 | -394,0 | -635,1 |
Tính khối lượng than (theo kg, làm tròn đến hàng đơn vị) cần thiết để sản xuất 2000 kg vôi sống theo phương pháp trên.
(Xem giải) Câu 27. Trong một nghiên cứu phân tích thành phần hợp kim từ huy chương đồng của Thế vận hội London 2012, người ta đã thực hiện quy trình định lượng như sau:
– Hòa tan 0,800g mẫu huy chương đồng vào dung dịch nitric acid (HNO3) đậm đặc, nóng.
– Sau khi làm nguội và pha loãng, thêm một lượng dư dung dịch potassium iodide vào rồi tiếp tục pha loãng dung dịch đến 250,0 mL.
– Biết 25,00 mL mẫu dung dịch này phản ứng vừa đủ với 12,20mL dung dịch sodium thiosulfate 0,100 M.
Cho các phương trình xảy ra như sau:
2Cu2+(aq) + 4I-(aq) → 2CuI(s) + I2(aq)
I2(aq) + 2S2O32-(aq) → 2I-(aq) + S4O62-(aq)
Biết rằng các huy chương Đồng được làm bằng hợp kim chứa copper. Tính % khối lượng copper (Cu) trong chiếc huy chương trên. (Kết quả làm tròn đến hàng phần mười)
(Xem giải) Câu 28. Trong máu người trưởng thành, khỏe mạnh vào lúc đói (8 giờ sau ăn) có lượng đường huyết trong khoảng 4,4 – 7,2 mmol/L (theo quyết định số 5481/QĐ-BYT ngày 30 tháng 12 năm 2020 của Bộ Y tế). Kết quả xét nghiệm đường huyết của anh X vào buổi sáng (chưa ăn) là 168 mg/dL (biết 1L = 10 dL). Tính lượng đường huyết trong mẫu xét nghiệm của anh X theo đơn vị mmol/L? (Kết quả làm tròn đến hàng phần mười)


Bình luận