[2015 – 2016] Thi học sinh giỏi lớp 12 – Tỉnh Đồng Tháp
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 90 phút
⇒ Đề thi, đáp án và giải chi tiết:
| 1C | 2C | 3B | 4D | 5A | 6B | 7D | 8C | 9C | 10B |
| 11C | 12A | 13D | 14B | 15A | 16A | 17D | 18B | 19D | 20B |
| 21B | 22B | 23A | 24B | 25C | 26A | 27B | 28B | 29A | 30D |
| 31A | 32C | 33B | 34D | 35D | 36A | 37A | 38B | 39D | 40A |
| 41D | 42C | 43C | 44A | 45D | 46C | 47C | 48C | 49A | 50D |
Câu 1: Dùng quỳ tím có thể phân biệt được dãy các dung dịch nào sau đây?
A. Glyxin, valin, axit glutamic. B. Alanin, axit glutamic, valin.
C. Glyxin, lysin, axit glutamic. D. Glyxin, alanin, lysin.
Câu 2: Cation nào sau đây có bán kính nhỏ nhất?
A. K+. B. Ca2+. C. Mg2+ D. Na+.
(Xem giải) Câu 3: Cho các nhận xét sau:
(1) Glucozơ và fructozơ là đồng phân của nhau.
(2) Để nhận biết dung dịch glucozơ và fructozơ có thể dùng phản ứng tráng gương.
(3) Trong amilozơ chỉ có một loại liên kết glicozit.
(4) Saccarozơ được xem là một đoạn mạch của tinh bột.
(5) Trong mỗi mắt xích xenlulozơ có 3 nhóm –OH.
(6) Amilopectin có cấu trúc mạng lưới không gian.
Số nhận xét không đúng là:
A. 5. B. 3. C. 4. D. 6.
(Xem giải) Câu 4: Cho các phát biểu sau về cacbohidrat:
(1) Glucozơ và saccarozơ đều là chất rắn vị ngọt, dễ tan trong nước.
(2) Tinh bột và xenlulozơ đều là polisaccarit.
(3) Trong dung dịch, glucozơ và saccarozơ đều hòa tan Cu(OH)2, tạo phức màu xanh lam.
(4) Khi thủy phân hoàn toàn hỗn hợp gồm tinh bột và saccarozơ trong môi trường axit, chỉ thu được một loại monosaccarit duy nhất.
(5) Khi đun nóng glucozơ (hoặc fructozơ) với dung dịch AgNO3 trong NH3 thu được Ag.
(6) Glucozơ và saccarozơ đều tác dụng với H2 (xúc tác Ni, đun nóng) tạo sobitol.
Số phát biểu đúng là :
A. 6. B. 3. C. 5. D. 4.
Câu 5: Dãy các kim loại phản ứng với nước ở nhiệt độ thường tạo thành dung dịch bazơ?
A. Ca, Sr, Ba. B. Be, Mg, Ca. C. Mg, Ca, Sr. D. Mg, Ca, Ba.
Câu 6: Phát biểu đúng là:
A. Trong các axit HX (X: là halogen), HF là axit mạnh nhất.
B. Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa.
C. Tính khử của các ion halogenua giảm dần theo thứ tự: F-, Cl-, Br-, I-.
D. Các axit HX (X: halogen) đều có tính oxi hóa và khử trong các phản ứng hóa học.
Câu 7: Kim loại có nhiệt độ nóng chảy cao nhất, dùng làm dây tóc bóng đèn là:
A. Cu B. Pt. C. Au. D. W
(Xem giải) Câu 8: Cho phương trình: Fe(NO3)2 + NaHSO4 → Fe(NO3)3 + Fe2(SO4)3 + Na2SO4 + NO + H2O. Sau khi cân bằng với các hệ số của các chất là số nguyên nhỏ nhất thì tổng hệ số các chất tham gia phản ứng và sản phẩm là:
A. 17. B. 21. C. 43. D. 41.
(Xem giải) Câu 9: Cho phản ứng: NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O. Khi phản ứng cân bằng, tổng hệ số các chất tham gia phản ứng là:
A. 21 B. 16 C. 13 D. 8
(Xem giải) Câu 10: Cho sơ đồ chuyển hóa sau:
(1) C3H4O2 + NaOH → X + Y
(2) X + H2SO4 loãng → Z + T
(3) Z + dung dịch AgNO3/NH3 dư → E + Ag + NH4NO3
(4) Y + dung dịch AgNO3/NH3 dư → F + Ag + NH4NO3
Chất E và F lần lượt là
A. HCOONH4 và CH3CHO. B. (NH4)2CO3 và CH3COONH4.
C. (NH4)2CO3 và CH3COOH. D. HCOONH4 và CH3COONH4.
(Xem giải) Câu 11: Cho phenol phản ứng lần lượt với: dung dịch NaOH, dung dịch HCl, dung dịch Br2, (CH3CO)2O, CH3COOH, Na, NaHCO3. Số trường hợp có xảy ra phản ứng là:
A. 3. B. 6. C. 4. D. 5.
(Xem giải) Câu 12: Cho dãy các chất: KAl(SO4)2.12H2O, C2H5OH, CH3COONH4, Ca(OH)2, CH3COOH, C12H22O11 (saccarozơ). Số chất điện li là:
A. 4. B. 5. C. 3. D. 2.
(Xem giải) Câu 13: Cho phản ứng thuận nghịch đang ở trạng thái cân bằng: N2 (k) + 3H2 (k) ⇌ 2NH3 (k), ΔH = -92 kJ. Nếu thay đổi các tác động bên ngoài như: (1) giảm nhiệt độ; (2) hóa lỏng và lấy NH3 ra khỏi hỗn hợp; (3) giảm áp suất; (4) thêm chất xúc tác. Có bao nhiêu tác động làm cân bằng trên chuyển dịch theo chiều thuận?
A. 1. B. 3. C. 4. D. 2.
(Xem giải) Câu 14: Cho các chất: CH3CHO, CH3COOC2H5, CH3COOH, C4H6, C2H4. Có bao nhiêu chất trong số các chất đã cho có thể là Y trong sơ đồ chuyển hóa sau: C6H12O6 (glucozơ) → X → Y → Z → CH4.
A. 3. B. 4. C. 1. D. 2.
Câu 15: Phản ứng nào dưới đây không đúng:
A. H2SO4 đặc + FeO → FeSO4 + H2O.
B. 6H2SO4 đặc + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O.
C. H2SO4 đặc + 2HI → I2 + SO2 + 2H2O.
D. 2H2SO4 đặc + C → CO2 + 2SO2 + 2H2O.
(Xem giải) Câu 16: Số chất đồng phân của amin bậc 2 ứng với công thức phân tử C4H11N:
A. 3. B. 1. C. 8. D. 4.
(Xem giải) Câu 17: Cho các hiđroxit: Ni(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, Cr(OH)3. Số hiđroxit tan được trong dung dịch NH3 là:
A. 2. B. 1. C. 4. D. 3.
(Xem giải) Câu 18: Cho các chất sau: CH3CHCICOOH (1), CH2Cl-CH2-COOH (2), CH3CH2–COOH (3), CH3-CCl2-COOH (4). Dãy sắp xếp theo chiều giảm dần tính axit là:
A. (4) > (1) > (3) > (2). B. (4) > (1) > (2) > (3).
C. (1) > (4) > (3) > (2). D. (3) > (2) > (1) > (4).
Câu 19: Nhóm các vật liệu được chế tạo từ polime trùng ngưng là :
A. nilon-6,6; tơ lapsan; thuỷ tinh plexiglas. B. cao su; nilon-6,6; tơ nitron.
C. tơ axetat, nilon-6,6. D. nilon-6,6; to lapsan; nilon-6.
(Xem giải) Câu 20: Cho CH4N2O tác dụng lần lượt với các dung dịch: CH3COOH, NaOH, HCl, CaCl2, HCHO. Số trường hợp tạo ra chất khí là:
A. 4. B. 3. C. 2. D. 1.
(Xem giải) Câu 21: Cho các phản ứng sau (trong điều kiện thích hợp):
(1) NH4Cl + NaNO2 (2) KNO3 + C + S
(3) Ca3(PO4)2 + SiO2 + C (4) SiO2 + Na2CO3.
Số phản ứng tạo được đơn chất là:
A. 2. B. 3. C. 1. D. 4.
(Xem giải) Câu 22: Cho 16,8 lít (đktc) hỗn hợp X gồm vinylaxetilen và H2, tỉ khối của X so với H2 bằng 6. Nung nóng hỗn hợp X (xúc tác Ni) một thời gian, thu được hỗn hợp Y có tỉ khối so với H2 bằng 10. Dẫn hỗn hợp Y qua dung dịch brom dư, sau khi phản ứng xảy ra hoàn toàn, khối lượng brom tham gia phản ứng là:
A. 12 gam. B. 24 gam. C. 16 gam. D. 8 gam.
Câu 23: Este có mùi táo là:
A. etyl isovalerat. B. etyl axetat. C. isoamyl axetat. D. etyl butirat.
(Xem giải) Câu 24: Cho sơ đồ phản ứng sau:
![]()
Biết X, Y, Z, T là các hợp chất hữu cơ và là những sản phẩm chính. Công thức cấu tạo đúng của T là:
A. C6H5-COOH. B. C6H5-COONH4.
C. CH3-C6H4-COONH4. D. p-HOOC-C6H4-COONH4.
(Xem giải) Câu 25: Có bao nhiêu đồng phân ứng với công thức phân tử C8H10O (là dẫn xuất của benzen) không tác dụng với NaOH, còn khi tách nước thu được sản phẩm có khả năng tạo polime?
A. 3. B. 4. C. 2. D. 5.
(Xem giải) Câu 26: Cho từ từ dung dịch HCl loãng vào dung dịch chứa x mol NaOH và y mol NaAlO2 (hay Na[Al(OH)4]). Sự phụ thuộc của số mol kết tủa thu được vào số mol HCl được biểu diễn theo đồ thị (hình bên)
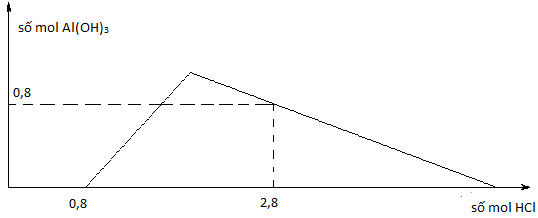
Giá trị của y là
A. 1,1. B. 1,5. C. 1,4. D. 1,7.
(Xem giải) Câu 27: Đốt cháy hoàn toàn chất nào sau đây trong O2 dư thu được kim loại?
A. FeS2. B. Ag2S. C. ZnS. D. Cu2S.
(Xem giải) Câu 28: Hỗn hợp A gồm vinyl axetat, etylen điaxetat, axit acrylic, axit oxalic. Đốt cháy m gam A cần vừa đủ 9,184 lít O2 (đktc) thu được 8,96 lít CO2 (đktc) và 5,4 gam H2O. Mặt khác cho hỗn hợp A phản ứng với V lít dung dịch KOH 2M, thể tích dung dịch KOH tối đa phản ứng được (ở điều kiện thích hợp) là:
A. 60 ml. B. 70 ml. C. 50 ml. D. 140 ml.
(Xem giải) Câu 29: Cho các chất: Cr(OH)3, CrO3, Ca(HCO3)2, CrO, P2O5. Số chất không tác dụng được với dung dịch NaOH loãng, nóng là:
A. 1. B. 4. C. 2. D. 3.
(Xem giải) Câu 30: Chia 0,6 mol hỗn hợp gồm một axit đơn chức và một ancol đơn chức thành 2 phần bằng nhau. Phần 1: đốt cháy hoàn toàn, thu được 20,16 lít CO2. Phần 2: đun nóng với H2SO4 đặc, thu được 10,2 gam este E (hiệu suất 100%). Đốt cháy hết lượng E, thu được 11,2 lít CO2 và 9,0 gam H2O. Thể tích các khí đo đktc. Biết số mol axit nhỏ hơn số mol ancol. Công thức của axit là:
A. C3H7COOH. B. CH3COOH. C. C2H5COOH. D. HCOOH.
(Xem giải) Câu 31: Điện phân 150 ml dung dịch AgNO3 1M với điện cực trơ trong t giờ, cường độ dòng điện không đổi 1,34A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y và khí Z. Cho 13 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 14,9 gam hỗn hợp kim loại và khí NO (sản phẩm khử duy nhất của N+5). Giá trị của t là:
A. 1,0. B. 3,0 C. 2,0. D. 1,5.
(Xem giải) Câu 32: Đốt cháy hoàn toàn m gam hỗn hợp X gồm C3H4, C2H4 và C3H8 thu được 1,008 lít khí CO2 (đktc) và 0,81 gam H2O. Vậy m có giá trị là:
A. 0,540g. B. 0,585g. C. 0,630g. D. 6,300g.
(Xem giải) Câu 33: Dẫn 1,344 lít khí NH3 (đktc) đi qua ống sứ đựng m gam CuO nung nóng, sau phản ứng thu được chất rắn X. Hòa tan chất rắn X trong dung dịch H2SO4 đặc, nóng, dư thì thu được dung dịch Y và giải phóng 1,1088 lít khí SO2 (đktc). Cô cạn dung dịch Y thu được 16,5 gam tinh thể CuSO4.5H2O. Hiệu suất phản ứng khử NH3 và giá trị của m (gam) là:
A. 82,5% và 5,28. B. 75% và 5,28. C. 75% và 3,96. D. 82,5% và 3,96.
(Xem giải) Câu 34: Thủy phân hoàn toàn a gam đipeptit Glu-Gly trong dung dịch NaOH dư, đun nóng thu được 17,28 gam hỗn hợp muối. Giá trị của a là:
A. 13,32 gam. B. 13,25 gam. C. 11,44 gam. D. 12,24 gam.
(Xem giải) Câu 35: Cho các chất: KHSO4, NaHCO3, Al2O3, Al2(SO4)3, Zn(OH)2, NaHS, K2SO3, (NH4)2CO3, Na2HPO3. Số chất có tính lưỡng tính là:
A. 7. B. 4. C. 6. D. 5.
Câu 36: Phát biểu nào sau đây không đúng?
A. Các kim loại K, Ca, Mg, Al được điều chế bằng cách điện phân nóng chảy muối clorua tương ứng.
B. Khi nhúng thanh Fe vào dung dịch hỗn hợp CuSO4 và H2SO4 thì Fe có thể bị ăn mòn điện hoá.
C. Hợp kim là vật liệu kim loại có chứa 1 kim loại cơ bản và 1 số kim loại hoặc phi kim khác.
D. Trong điện phân dung dịch NaCl trên catot xảy ra sự khử nước.
(Xem giải) Câu 37: Hấp thụ hết 4,48 lít khí CO2 (ở đktc) vào dung dịch A chứa x mol KOH và y mol K2CO3 thu 400 ml dung dịch X. Lấy 200 ml X cho từ từ vào 200 ml dung dịch HCl 0,75M thu được 2,688 lít khí (ở đktc). Mặt khác, 200 ml X tác dụng với dung dịch Ba(OH)2 dư thu được 39,4 gam kết tủa. Giá trị của x (mol) là:
A. 0,10. B. 0,15. C. 0,20. D. 0,05.
(Xem giải) Câu 38: X có công thức C3H12O3N2. X tác dụng với dung dịch NaOH (đun nóng nhẹ) hoặc HCl đều có khí thoát ra. Lấy 18,6 gam X tác dụng hoàn toàn với 400ml dung dịch NaOH 1,2M. Sau phản ứng cô cạn dung dịch thu được m gam rắn. Giá trị m là.
A. 25,44. B. 23,1. C. 27,3. D. 23,352.
(Xem giải) Câu 39: Cho sơ đồ phản ứng sau: Ca → X → Y → Z → T → G → Ca. Với X, Y, Z, T, G là các hợp chất của Ca; phản ứng (2) (3) (4) (5) không phải là phản ứng oxi hóa – khử. Vậy các chất trên lần lượt là:
A. Ca(OH)2, Ca(HCO3)2, CaCO3, Ca(NO3)2, CaCl2.
B. Ca(OH)2, CaCO3, CaO, Ca(HCO3)2, CaCl2.
C. Ca(OH)2, Ca(HCO3)2, CaCO3, CaSO4, CaCl2.
D. CaO, Ca(OH)2, CaCO3, Ca(HCO3)2, CaCl2.
(Xem giải) Câu 40: X là tetrapeptit: Gly-Ala-Gly-Gly, Y là tripeptit Gly-Glu-Ala. Đun m gam hỗn hợp T gồm X, Y có tỉ lệ mol tương ứng là 4 : 3 với dung dịch NaOH vừa đủ, sau khi phản ứng xảy ra hoàn toàn cô cạn dung dịch thu được 420,75 gam chất rắn khan. Giá trị của m là
A. 279,75. B. 298,65. C. 407,65. D. 322,45.
(Xem giải) Câu 41: Đốt cháy hoàn toàn m gam một chất béo (triglixerit) cần 36,064 lít O2, sinh ra 25,536 lít CO2 và 19,08 gam H2O. Các thể tích khí đo ở đktc. Nếu cho m gam chất béo này tác dụng đủ với dung dịch NaOH thì khối lượng muối tạo thành là:
A. 23,00 gam. B. 16,68 gam. C. 20,28 gam. D. 18,28 gam.
(Xem giải) Câu 42: A, B là 2 ancol đa chức kế tiếp nhau trong dãy đồng đẳng (MA < MB). A, B đều không có khả năng hòa tan Cu(OH)2. Đốt cháy hoàn toàn một lượng bất kỳ A được x mol CO2 và y mol H2O. Đốt cháy hoàn toàn một lượng bất kỳ B được x’ mol CO2 và y’ mol H2O (trong đó x/y < x’/y’). Đốt cháy hoàn toàn 0,15 mol hỗn hợp X gồm A và B cần dùng vừa đủ 14,112 lít O2 (đktc). Thành phần phần trăm khối lượng ancol A trong X là:
A. 66,67% B. 46,66% C. 84,59% D. 62,00%
(Xem giải) Câu 43: Cho các phát biểu sau:
(1) Hỗn hợp CuS và FeS tan hoàn toàn trong dung dịch HCl.
(2) Ở nhiệt độ thường, H2S bị oxi của không khí khử thành lưu huỳnh.
(3) Có thể sử dụng dung dịch H2SO4 đặc để làm khô các khí H2S và SO3.
(4) Nước brom có thể phân biệt hai khí H2S và SO2.
(5) Sục khí H2S vào dung dịch FeCl3, xuất hiện kết tủa màu vàng.
Số phát biểu đúng là:
A. 2. B. 3. C. 1. D. 4.
(Xem giải) Câu 44: Cho các phương trình phản ứng:
(1) dung dịch FeCl2 + dung dịch AgNO3 dư →
(2) F2 + H2O →
(3) K + H2O →
(4) SO2 + dung dịch Br2 →
(5) Ag + O3 →
(6) dung dịch FeCl3 + Cu →
Trong các phản ứng trên, số phản ứng tạo đơn chất là
A. 4. B. 6. C. 5. D. 3.
(Xem giải) Câu 45: Đốt một lượng nhôm trong 4,48 lít O2. Hòa tan hoàn toàn chất rắn thu được sau phản ứng vào dung dịch HCl dư thấy thoát ra 4,48 lít H2 (các thể tích khí đo ở đktc). Khối lượng nhôm đã dùng là:
A. 16,2 gam. B. 12,4 gam. C. 5,4 gam. D. 10,8 gam.
Câu 46: Phát biểu đúng là:
A. Muối ăn dễ tan trong benzen.
B. Khi đốt cháy hoàn toàn a mol một hiđrocacbon X bất kì thu được b mol CO2 và c mol H2O, nếu b – c = a thì X là ankin.
C. Trong phân tử hợp chất hữu cơ chứa C, H, O thì số nguyên tử H phải là số chẵn.
D. Ở điều kiện thường, các este đều ở trạng thái lỏng.
(Xem giải) Câu 47: Hỗn hợp A gồm 2 andehit X, Y đều mạch hở, đơn chức (đều chứa không quá 4 nguyên tử C trong phân tử). Đốt cháy hoàn toàn 0,3 mol A thu được 11,2 lít CO2 (đktc) và 5,4 gam H2O. Nếu lấy 0,3 mol A cho tác dụng với dung dịch AgNO3/NH3 dư thì xuất hiện m gam kết tủa. Giá trị của m là?
A. 64,8 gam. B. 125,2 gam. C. 127,4 gam. D. 86,4 gam.
(Xem giải) Câu 48: Cho 66,7 gam hỗn hợp A gồm Fe3O4, Fe(NO3)3 và Cu tác dụng với dung dịch chứa 0,828 mol H2SO4 loãng, sau phản ứng thu được khí NO duy nhất và dung dịch B chứa 2 muối. Cô cạn 1/2 dung dịch B thì thu được bao nhiêu gam muối khan?
A. 65,976 hoặc 61,52. B. 65,976 hoặc 75,922.
C. 64,4 hoặc 61,52. D. 73,122 hoặc 64,4.
(Xem giải) Câu 49: Hòa tan 1,92 gam Cu vào 100 ml dung dịch A gồm HNO3 0,3M và H2SO4 0,25M. Sau khi các phản ứng xảy ra hoàn toàn (sản phẩm khử duy nhất là NO), cô cạn cẩn thận toàn bộ dung dịch sau phản ứng thì khối lượng muối khan thu được là:
A. 4,94g. B. 5,64g. C. 4,80g. D. 5,04g.
(Xem giải) Câu 50: Để hòa tan hoàn toàn 4,64g hỗn hợp A gồm FeO, Fe2O3, Fe3O4 (nFeO : nFe2O3 = 1 : 1) cần V lít dung dịch H2SO4 0,1M và HCl 0,3M. V có giá trị là:
A. 0,12 lit. B. 0,40 lít. C. 0,04 lít. D. 0,32 lít.


Bình luận