[2022-2023][Hóa 10] Kiểm tra giữa kỳ 1 trường Võ Nguyên Giáp – Quảng Nam
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Giải chi tiết và đáp án:
⇒ Mã đề: 005
| 1C | 2A | 3A | 4C | 5C | 6D | 7B | 8C | 9B | 10A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 21 |
I. TRẮC NGHIÊM (21 câu 7 điểm).
(Xem giải) Câu 1. Orbital nguyên tử là gì?
A. Là khu vực có chứa electron xung quanh hạt nhân nguyên tử.
B. Là quỹ đạo chuyển động của electron xung quanh hạt nhân.
C. Là vùng không gian xung quanh nguyên tử, ở đó xác suất có mặt electron lớn nhất.
D. Là vùng chuyển động của electron xung quanh hạt nhân.
(Xem giải) Câu 2. Mỗi orbital nguyên tử chứa tối đa
A. 2 electron. B. 1 electron. C. 3 electron. D. 4 electron.
(Xem giải) Câu 3. Chromium được sử dụng nhiều trong luyện kim để chế tạo hợp kim chống ăn mòn và đánh bóng bề mặt. Nguyên tử chromium có cấu hình electron viết gọn là [Ar]3d5 4s1. Vị trí chromium trong bảng tuần hoàn là
A. ô số 24, chu kì 4, nhóm VIB. B. ô số 24, chu kì 4, nhóm VIA.
C. ô số 17, chu kì 4, nhóm IA. D. ô số 27, chu kì 4, nhóm IB.
(Xem giải) Câu 4. Trường hợp nào sau đây có sự tương ứng giữa hạt cơ bản với khối lượng và điện tích của chúng?
A. Proton, m ≈ 0,00055 amu, q = +1. B. Electron, m ≈ 1 amu, q = -1.
C. Neutron, m ≈ 1 amu, q = 0. D. Proton, m ≈ 1 amu, q = -1.
(Xem giải) Câu 5. X được dùng làm chất bán dẫn trong kĩ thuật vô tuyến điện, chế tạo pin mặt trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của X là
A. 1s2 2s2 2p6 3s2 3p5. B. 1s2 2s2 2p6 3s2 3p3.
C. 1s2 2s2 2p6 3s2 3p2. D. 1s2 2s2 2p5 3s2 3p4.
(Xem giải) Câu 6. Bảng tuần hoàn hiện nay không áp dụng nguyên tắc sắp xếp nào sau đây?
A. Mỗi nguyên tố hóa học được xếp vào một ô trong bảng tuần hoàn.
B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng.
C. Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thàng một cột.
D. Các nguyên tố được sắp xếp theo chiều tăng dần khối lượng nguyên tử.
(Xem giải) Câu 7. Sự phân bố electron theo ô orbital nào dưới đây là đúng?
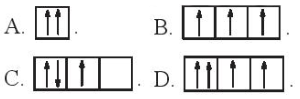
(Xem giải) Câu 8. Phân lớp 3p chứa tối đa bao nhiêu electron?
A. 2. B. 10. C. 6. D. 14.
(Xem giải) Câu 9. Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, số chu kì nhỏ và chu kì lớn lần lượt là
A. 4 và 3. B. 3 và 4. C. 4 và 4. D. 3 và 3.
(Xem giải) Câu 10. Nguyên tố boron (B) có nguyên tử khối trung bình là 10,81. Trong tự nhiên, boron có hai đồng vị là ![]() và
và ![]() . Phần trăm số nguyên tử của đồng vị
. Phần trăm số nguyên tử của đồng vị ![]() là
là
A. 19%. B. 81%. C. 0,19%. D. 0,81%.
(Xem giải) Câu 11. Nguyên tử Fe có kí hiệu ![]() . Cho các phát biểu sau về Fe:
. Cho các phát biểu sau về Fe:
(1) Nguyên tử của nguyên tố Fe có 8 electron ở lớp ngoài cùng.
(2) Nguyên tử của nguyên tố Fe có 30 neutron ở trong hạt nhân.
(3) Fe là một phi kim.
(4) Fe là nguyên tố d.
Trong các phát biểu trên, phát biểu nào là đúng?
A. (2), (4). B. (1), (2) và (4). C. (1), (2), (3) và (4). D. (2), (3) và (4).
(Xem giải) Câu 12. Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử là
A. 5. B. 3. C. 6. D. 7.
(Xem giải) Câu 13. Dãy nào sau đây gồm các đồng vị của cùng một nguyên tố hoá học?
![]()
(Xem giải) Câu 14. Số proton và số neutron có trong một nguyên tử aluminium ( ) lần lượt là
A. 13 và 15. B. 13 và 14. C. 12 và 14. D. 13 và 13.
(Xem giải) Câu 15. Một nguyên tử X gồm 19 proton, 19 electron và 20 neutron. Nguyên tử X có kí hiệu là
A. 19K38. B. 19K39. C. 20K39. D. 20K40.
(Xem giải) Câu 16. Hầu hết các nguyên tử được cấu tạo bởi bao nhiêu loại hạt cơ bản ?
A. 2. B. 3. C. 1. D. 4.
(Xem giải) Câu 17. Nguyên tử X có tổng số electron điền vào phân lớp p là 11. Nguyên tử X có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của nguyên tử Y là 8 . Nhận định nào sau đây sai khi nói về X,Y?
A. Y có số thứ tự 13, chu kì 3, nhóm IIIA.
B. X có số thứ tự 17, chu kì 3, nhóm VIIA.
C. Hợp chất được tạo từ X và Y là YX3.
D. X là kim loại, Y là phi kim
(Xem giải) Câu 18. Fluorine và hợp chất của nó được sử dụng làm chất chống sâu răng, chất cách điện, chất làm lạnh, vật liệu chống dính,… Nguyên tử fluorine chứa 9 hạt electron và 10 hạt neutron. Tổng số hạt proton, electron và neutron trong nguyên tử fluorine là
A. 19. B. 28. C. 30. D. 32.
(Xem giải) Câu 19. Phát biểu nào sau đây không đúng?
A. Lớp L có 6 orbital.
B. Lớp M có 3 phân lớp.
C. Phân lớp p có 3 orbital.
D. Năng lượng của electron trên lớp K là thấp nhất.
(Xem giải) Câu 20. Các nguyên tố trong cùng một chu kì có đặc điểm gì chung?
A. Số lớp electron bằng nhau.
B. Số electron lớp ngoài cùng bằng nhau.
C. Số electron hoá trị bằng nhau.
D. Cùng số AO .
(Xem giải) Câu 21. Nguyên tố hóa học là những nguyên tử có cùng
A. số khối. B. số neutron.
C. số proton và neutron. D. điện tích hạt nhân.
II. TỰ LUẬN. ( 3 câu 3 điểm).
(Xem giải) Câu 1. (1 điểm). Cấu hình electron nguyên tử của nguyên tố aluminium (Z = 13) 1s2 2s2 2p6 3s2 3p1. Hãy biểu diễn cấu hình electron của aluminium theo ô orbital? Từ đó, xác định số electron độc thân của nguyên tử này? Cho biết số electron lớp ngoài cùng trong nguyên tử của nguyên tố trên? Nguyên tố là kim loại, phi kim hay khí hiếm?
(Xem giải) Câu 2. (1 điểm). Nguyên tố X có tổng số hạt là 52, tổng số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Tìm nguyên tố X? viết cấu hình electron, từ đó xác định vị trí của X (số thứ tự ô nguyên tố, chu kì và nhóm) trong bảng tuần hoàn?
Câu 3. ( 1 điểm)
(Xem giải) a/ Trong tự nhiên chlorine có hai đồng vị bền: 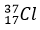 chiếm 24,23% tổng số nguyên tử, còn lại là
chiếm 24,23% tổng số nguyên tử, còn lại là 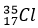 . Thành phần % theo khối lượng của
. Thành phần % theo khối lượng của 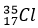 trong KClO4 là bao nhiêu? (Cho K = 39; O = 16)
trong KClO4 là bao nhiêu? (Cho K = 39; O = 16)
(Xem giải) b/ Ở 20°C, khối lượng riêng của glod (Au) là 19,32 g/cm³. Giả thiết trong tinh thể các nguyên tử Au là những hình cầu chiếm 75% thể tích tinh thể. Biết khối lượng nguyên tử của Au là 196,97. Tính bán kính nguyên tử của Au?


Bình luận