[2023 – 2024] Thi học sinh giỏi lớp 12 – Hà Nội
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 180 phút
⇒ Đề thi, đáp án và giải chi tiết:
Câu I (4,0 điểm)
(Xem giải) 1. Vì sao để giảm thiểu hiệu ứng nhà kính của bầu khí quyển trên Trái Đất, chúng ta nên hạn chế sử dụng các nhiên liệu hóa thạch như than đá (thành phần chủ yếu là cacbon), xăng dầu (thành phần chủ yếu là các hiđrocacbon),… và trồng thêm nhiều cây xanh.
(Xem giải) 2. Chất khí X có công thức dạng AB3 (A, B là hai nguyên tố phi kim). Tổng số hạt mang điện trong một phân tử X là 20.
a) Tìm công thức phân tử của X.
b) Viết một phương trình hóa học điều chế X trong phòng thí nghiệm và một phương trình hóa học tổng hợp X trong công nghiệp (ghi rõ điều kiện nếu có).
c) X có nhiều ứng dụng quan trọng, một trong những ứng dụng đó là để sản xuất phân bón hóa học. Phân bón Y được tổng hợp trực tiếp từ phản ứng của X với CO2. Viết phương trình hóa học của phản ứng tổng hợp Y (ghi rõ điều kiện nếu có).
(Xem giải) 3. Để xác định nồng độ axit axetic có trong một mẫu giấm ăn, một nhóm học sinh tiến hành thí nghiệm sau:
– Bước 1: Pha loãng 10,00 mL giấm ăn bằng nước cất trong bình định mức được 100,00 mL dung dịch X. Dùng pipet lấy 10,00 mL dung dịch X cho vào bình tam giác rồi thêm vài giọt chất chỉ thị phenolphtalein.
– Bước 2: Tráng sạch buret bằng nước cất, sau đó tráng lại bằng một ít dung dịch NaOH 0,02 M. Lắp dụng cụ như hình bên. Cho dung dịch NaOH 0,02 M vào cốc thủy tinh, sau đó rót vào buret (đã khóa) và chỉnh về vạch 0.
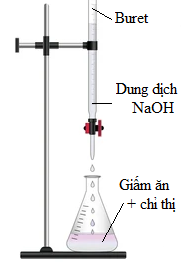 – Bước 3: Vặn khóa buret để dung dịch NaOH trong buret chảy từ từ từng giọt vào bình tam giác đồng thời lắc đều bình. Quan sát đến khi dung dịch trong bình tam giác chuyển từ không màu sang màu hồng bền trong khoảng 20 giây thì dừng lại.
– Bước 3: Vặn khóa buret để dung dịch NaOH trong buret chảy từ từ từng giọt vào bình tam giác đồng thời lắc đều bình. Quan sát đến khi dung dịch trong bình tam giác chuyển từ không màu sang màu hồng bền trong khoảng 20 giây thì dừng lại.
– Bước 4: Ghi lại thể tích dung dịch NaOH đã dùng.
Lặp lại thí nghiệm 3 lần.
a) Viết phương trình hóa học của phản ứng xảy ra (dạng phân tử và ion thu gọn).
b) Những dụng cụ thí nghiệm nào ở trên được sử dụng để lấy chính xác các thể tích?
c) Vì sao ở Bước 2 phải tráng lại buret bằng dung dịch NaOH 0,02 M sau khi đã rửa sạch bằng nước cất?
d) Thể tích dung dịch NaOH 0,02 M trong 3 lần thí nghiệm được ghi lại như sau:
| Lần 1 | Lần 2 | Lần 3 | |
| Vdd NaOH (mL) | 37,5 | 37,4 | 37,6 |
Tính nồng độ mol/L của axit axetic trong mẫu giấm ăn trên.
e) Trong lần thí nghiệm thứ 2, tại thời điểm dung dịch trong bình tam giác đổi màu, thể tích đọc được trên buret là 37,4 mL và có một giọt dung dịch còn treo ở đầu dưới của buret. Một học sinh cho rằng cần lấy giọt dung dịch này vào bình tam giác. Một học sinh khác lại cho rằng nên bỏ giọt dung dịch này. So sánh ảnh hưởng của hai cách làm này đến nồng độ axit axetic tính được từ kết quả thí nghiệm trên.
Câu II (3,0 điểm)
(Xem giải) 1. Cân bằng các phương trình hóa học sau bằng phương pháp thăng bằng electron, xác định chất khử và chất oxi hóa:
a) Cr(OH)3 + Br2 + KOH → K2CrO4 + KBr + H2O
b) CH2=CH2 + KMnO4 + H2O → HO-CH2-CH2-OH + KOH + MnO2
c) KNO3 + C + S → N2 + CO2 + K2S
(Xem giải) 2. Khoáng vật A phổ biến trong tự nhiên có thành phần chính là chất T (T có công thức XYZ2, trong đó X, Y là kim loại; Z là phi kim). Đốt cháy hoàn toàn T trong oxi dư, thu được hỗn hợp chất rắn B (gồm hai oxit kim loại) và hỗn hợp khí D. Khử hoàn toàn B bằng khí CO dư thu được hỗn hợp chất rắn E (gồm hai kim loại). Hòa tan E trong lượng dư dung dịch H2SO4 đặc nguội, sau một thời gian thu được dung dịch màu xanh lam (chứa muối của X) và còn lại chất rắn không tan có chứa kim loại là thành phần chính của gang, thép. Trong hỗn hợp D có khí F là nguyên nhân gây ra mưa axit. Sục D vào dung dịch Br2 dư, thu được dung dịch G và thoát ra khí K. Cho G tác dụng với dung dịch BaCl2 dư, thu được kết tủa trắng không tan trong axit. Lập luận xác định công thức hợp chất T và viết phương trình hóa học của các phản ứng xảy ra.
Câu III (3,0 điểm)
1. Giải thích:
(Xem giải) a) Vì sao độ âm điện của N là 3,04 xấp xỉ với độ âm điện của Cl là 3,16 nhưng ở điều kiện thường nitơ kém hoạt động hơn nhiều so với clo?
(Xem giải) b) Vì sao HF có phân tử khối lớn hơn nhưng lại có nhiệt độ sôi thấp hơn H2O?
(Xem giải) 2. Xác định các chất hữu cơ X, Y, Z, T, M, Q (cho biết: có hai trong sáu chất thuộc loại hiđrocacbon, MZ – MT = 18) và viết các phương trình hóa học thực hiện dãy chuyển hóa bên (dưới dạng công thức cấu tạo, ghi rõ điều kiện nếu có).
Butan → X → Vinyl axetat → Y → Z → T → M ← Q ← Butan
Câu IV (3,5 điểm)
(Xem giải) 1. Hỗn hợp X gồm các khí và hơi: CO2, SO2, H2O. Mô tả thí nghiệm chứng minh sự có mặt của từng chất trong hỗn hợp X, vẽ hình minh họa. Viết phương trình hóa học của các phản ứng xảy ra.
(Xem giải) 2. Hỗn hợp khí A gồm anken X và ankin Y (biết Y có cấu tạo đối xứng). Đốt cháy hoàn toàn 0,22 mol hỗn hợp A có khối lượng 8,72 gam thu được 28,16 gam CO2.
a) Viết công thức cấu tạo của X, Y.
b) Thêm 0,3 mol H2 vào 0,22 mol hỗn hợp A rồi dẫn hỗn hợp qua bột Ni, đun nóng thu được hỗn hợp khí B có tỉ khối so với H2 bằng 11,65. Dẫn B qua bình đựng dung dịch AgNO3/NH3 dư thu được 9,6 gam kết tủa và thoát ra hỗn hợp khí C. Dẫn C qua bình đựng dung dịch Br2 dư, thấy khối lượng bình tăng 6,16 gam và thoát ra hỗn hợp khí D. Viết phương trình hóa học của các phản ứng có thể xảy ra. Tính tỉ khối của D so với H2.
Câu V (3,0 điểm)
(Xem giải) 1. Nhỏ từ từ dung dịch H3PO4 vào dung dịch X chứa KOH 0,02 M và CaCl2 0,01 M thấy khối lượng kết tủa lớn nhất khi số mol H3PO4 bằng 0,03. Tính khối lượng kết tủa thu được khi nhỏ từ từ đến hết dung dịch chứa 0,024 mol H3PO4 vào X.
(Xem giải) 2. Cho hỗn hợp E chứa các chất hữu cơ mạch hở X, Y, Z, T trong đó X, Y là hai axit cacboxylic đều đơn chức (MX < MY); Z là ancol no, ba chức; T là este thuần chức tạo bởi X, Y, Z. Đốt cháy hoàn toàn 61,56 gam E cần dùng 2,68 mol O2, thu được 36 gam H2O. Mặt khác, hiđro hóa hoàn toàn 61,56 gam E (xúc tác Ni, đun nóng) cần dùng 0,23 mol H2, thu được hỗn hợp F. Cho F phản ứng vừa đủ với 700 ml dung dịch NaOH 1 M (đun nóng), cô cạn dung dịch sau phản ứng thu được 60,62 gam muối khan. Xác định công thức cấu tạo của T. Tính khối lượng của X trong E.
Câu VI (3,5 điểm)
(Xem giải) 1. Chất hữu cơ X chứa C, H, O và có phân tử khối bằng 206. Trong X, tỉ lệ khối lượng của C và O tương ứng là 33 : 16. Từ X thực hiện các phản ứng theo đúng tỉ lệ mol:
(1) X + 3KOH → Y + Z + T + M;
(2) Y + H2 → Y1
(3) Z + HCl → Z1 + KCl;
(4) Y1 + O2 → Z1 + M;
(5) T + 2HCl → T1 + 2KCl;
(6) Y + 2AgNO3 + 3NH3 + H2O → Y2 + 2Ag + 2NH4NO3.
a) Tìm công thức phân tử của X.
b) Xác định công thức cấu tạo của X, Y, Z, T, Y1, Y2, Z1, T1 và viết phương trình hóa học của các phản ứng xảy ra
(Xem giải) 2. Hòa tan hết 20,48 gam hỗn hợp X gồm Fe và một oxit sắt bằng dung dịch chứa 1,24 mol HNO3, kết thúc phản ứng thu được dung dịch Y (không chứa NH4NO3) và 0,18 mol hỗn hợp Z gồm hai khí NO, N2O. Cho dung dịch chứa 0,98 mol NaOH vào dung dịch Y, thu được 32,1 gam một chất kết tủa màu nâu đỏ. Mặt khác, hòa tan hết 20,48 gam X trong dung dịch chứa 0,82 mol HCl, thu được dung dịch T và 0,17 mol H2. Cho dung dịch AgNO3 dư vào T thấy thoát ra khí NO (sản phẩm khử duy nhất của N+5) và thu được m gam kết tủa. Tính giá trị của m.


Bình luận