[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Hòa Bình (Đề minh họa)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 048-H12C năm 2024-2025
⇒ Thời gian làm bài: 180 phút
Câu 1. (4,5 điểm):
(Xem giải) 1. Nguyên tố M có trong máu người nồng độ bình thường là 3,5 – 5,0 mmol/l. Trong cơ thể, nguyên tố M giúp điều hòa cân bằng nước và điện giải, giúp duy trì hoạt động bình thường, đặc biệt là của hệ tim mạch, cơ bắp, tiêu hóa, tiết niệu. Trên cơ tim ion M+ làm giảm lực co bóp, giảm tính chịu kích thích và giảm dẫn truyền. Tổng số hạt proton, neutron và electron trong nguyên tử nguyên tố M là 58, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 18.
Nguyên tố X có trong thành phần của các chất có tác dụng oxi hoá và sát khuẩn cực mạnh, thường được sử dụng với mục đích khử trùng và tẩy trắng trong lĩnh vực thuỷ sản, dệt nhuộm, xử lí nước thải, nước bể bơi. Oxide cao nhất của X có công thức là X2O7. Trong hợp chất khí của X và hydrogen, nguyên tố X chiếm 97,26% về khối lượng.
a. Viết cấu hình electron nguyên tử của nguyên tố M và X. Xác định vị trí của M và X trong bảng tuần hoàn các nguyên tố hóa học.
b. Viết công thức oxide ứng với hóa trị cao nhất và hydroxide tương ứng của M và X, nêu tính acid – base của chúng.
c. Mô tả sự hình thành liên kết trong phân tử MX.
(Xem giải) 2. a. Sodium peroxide (Na2O2), potassium superoxide (KO2) là những chất oxi hóa mạnh, dễ dạng hấp thụ khí carbon dioxide và giải phóng khí oxygen. Do đó, chúng được sử dụng trong bình lặn hoặc tàu ngầm để hấp thụ khí carbon dioxide và cung cấp khí oxygen cho con người trong hô hấp theo các phản ứng sau:
Na2O2 + CO2 → Na2CO3 + O2↑
KO2 + CO2 → K2CO3 + O2↑
Theo nghiên cứu, khi hô hấp, thể tích khí carbon dioxide một người thải ra xấp xỉ thể tích oxygen hút vào. Cần trộn Na2O2 và KO2 theo tỉ lệ số mol như thế nào để thể tích khí carbon dioxide hấp thụ bằng thể tích khí oxygen sinh ra?
(Xem giải) b. Giải thích hiện tượng con tắc kè có thể di chuyển trên mặt kính trơn nhẵn, thẳng đứng.
(Xem giải) 3. Thí nghiệm chuẩn độ dung dịch base mạnh bằng dung dịch chuẩn acid mạnh.
+ Dụng cụ: Bộ giá đỡ, burette 25 mL, pipette 10 mL, cốc thủy tinh, bình tam giác 50 mL, ống hút nhỏ giọt.
+ Hóa chất: Dung dịch HCl 0,10 M, dung dịch NaOH cần xác định nồng độ, dung dịch phenolphthalein.
+ Các bước tiến hành (chưa sắp xếp theo trình tự) chuẩn độ dung dịch sodium hydroxide bằng dung dịch hydrochloric acid được mô tả ngắn gọn như sau:
(1) Thêm vài giọt chất chỉ thị thích hợp vào dung dịch.
(2) Ghi lại thể tích dung dịch HCl cuối cùng và lặp lại 3 lần để thu được kết quả phù hợp.
(3) Thêm dung dịch HCl vào burette đến vạch số 0.
(4) Lấy 10 mL dung dịch sodium hydroxide vào bình nón bằng pipette.
(5) Mở khóa burette, nhỏ từng giọt dung dịch HCl vào sodium hydroxide, lắc đều cho đến khi đạt đến điểm kết thúc.
a. Hãy sắp xếp thứ tự thực hiện các bước trên khi tiến hành chuẩn độ. Hãy cho biết hiện tượng tại thời điểm kết thúc chuẩn độ.
b. Giải thích vì sao cần lắc nhẹ dung dịch trong bình tam giác khi thực hiện chuẩn độ.
c. Viết phương trình hóa học của phản ứng chuẩn độ.
d. Tiến hành thí nghiệm chuẩn độ 3 lần, thu được kết quả sau:
| Thí nghiệm | Lần 1 | Lần 2 | Lần 3 |
| Thể tích dung dịch HCl đã sử dụng (mL) | 12,50 | 12,40 | 12,50 |
Hãy xác định nồng độ dung dịch NaOH ban đầu.
Câu 2. (3,5 điểm):
(Xem giải) 1. Nước thải chăn nuôi là một trong những yếu tố gây nên hiện tượng phú dưỡng cho ao, hồ. Hãy giải thích điều này.
(Xem giải) 2. Trong thực tế, ở nhiều nơi, nước thải, phân bón hoá học, thuốc trừ sâu chưa qua xử lí được thải trực tiếp vào ao, hồ. Trong trường hợp nào có thể gây ra hiện tượng phú dưỡng? Giải thích.
(Xem giải) 3. Một số quá trình tự nhiên và hoạt động của con người thải hydrogen sulfide vào không khí. Chất này có thể bị oxi hóa bởi oxygen có trong không khí theo hai phản ứng sau:
H2S(g) + 1,5O2(g) → SO2(g) + H2O(g) (1)
H2S(g) + 0,5O2(g) → S(s) + H2O(g) (2)
Cho biết giá trị enthalpy tạo thành chuẩn của H2S(g), SO2(g) và H2O(g) lần lượt là: -20,7kJ/mol; -296,8 kJ/mol và -241,8 kJ/mol.
a. Tính giá trị biến thiên enthalpy chuẩn của mỗi phản ứng trên. Ở 298 K, mỗi phản ứng có thuận lợi về mặt năng lượng không?
b. Trong môi trường không khí mà nồng độ oxygen bị suy giảm, hãy dự đoán hydrogen sulfide dễ chuyển hóa thành sulfur dioxide hay sulfur. Giải thích.
(Xem giải) 4. Hiện nay, mưa acid, hiệu ứng nhà kính và thửng tầng ozone là ba thảm họa môi trường toàn cầu. Mưa acid tàn phá nhiều rừng cây, các công trình kiến trúc bằng đá và kim loại. Tác nhân chủ yết gây mưa acid là sulfur dioxide.
a. Trong khí quyển, SO2 chuyển hóa thành H2SO4 trong nước mưa theo sơ đồ sau: SO2 → SO3 → H2SO4
Viết các phương trình phản ứng xảy ra.
b. Một con mưa acid xuất hiện tại một khu công nghiệp diện tích 10 km² với lượng mưa trung bình 80 mm. Hãy tính:
– Thể tích nước mưa đã rơi xuồng khu công nghiệp.
– Khối lượng H2SO4 trong lượng nước mưa, biết nồng độ của H2SO4 trong nước mưa là 2.10^-5M.
c. Lượng acid trong nước mưa có thể ăn mòn các công trình bằng đá vôi.
– Viết 1 phương trình hóa học minh họa.
– Khối lượng CaCO3 tối đa bị ăn mòn bởi lượng acid trên.
Câu 3. (4,5 điểm):
(Xem giải) 1. Cho các hợp chất hữu cơ X, Y, Z có cùng công thức phân tử C4H8O2 đều mạch hở và không phân nhánh. Biết:
– X tác dụng với dung dịch NaHCO3 thấy có khí thoát ra.
– Y tác dụng với dung dịch NaOH thu được hai hợp chất hữu cơ có số nguyên tử carbon trong phân tử bằng nhau.
– Z hòa tan Cu(OH)2 ở điều kiện thường tạo dung dịch màu xanh lam.
a. Xác định công thức cấu tạo có thể có của X, Y, Z.
b. Viết các phương trình hóa học xảy ra (dưới dạng công thức cấu tạo thu gọn).
(Xem giải) 2. Cho các thí nghiệm sau:
– Thí nghiệm 1: cho khoảng 0,5 mL acetone vào ống nghiệm đã có khoảng 2 mL dung dịch I2 bão hòa trong KI và khoảng 2 mL NaOH 2 M.
– Thí Nghiệm 2: thêm từ từ vài giọt dung dịch aniline vào ống nghiệm có khoảng 1 mL nước bromine.
– Thí nghiệm 3: thêm vào ống nghiệm có chứa thuốc thử Tollens khoảng 2 mL dung dịch glucose 2%, lắc đều. Sau đó, ngâm ống nghiệm vào cốc thủy tinh chứa nước nóng trong vài phút.
– Thí nghiệm 4: cho khoảng 1 mL ethylamine vào ống nghiệm có sẵn khoảng 1 mL dung dịch NaNO2 0,5M và 1 mL dung dịch HCl 1 M lắc đều.
Cho biết hiện tượng ở các thí nghiệm trên và viết phương trình hóa học của phản ứng xảy ra.
(Xem giải) 3. Hiện nay, xăng sinh học đang được sử dụng ở nước ta để thay thế một phần xăng truyền thống. Xăng sinh học được coi là hỗn hợp của ethanol và hỗn hợp các đồng phân octane, phổ biến nhất là 2,2,4-trimetylpentane. Khi cháy lượng carbonic sinh ra từ ethanol được sử dụng lại trong quá trình tổng hợp sinh học, để rồi lại thu được ethanol, nên khí carbonic thải ra từ quá trình đốt cháy xăng sinh học chỉ tính lượng carbonic sinh ra do các đồng phân của octane. Ban đầu, người ta đề xuất xăng E5 (chứa 5% thể tích ethanol), tuy nhiên gần đây người ta khuyến khích sử dụng xăng E10 (chứa 10% thể tích ethanol).
Biết: Đốt cháy hoàn toàn, 1 mol các đồng phân của octane tỏa ra lượng nhiệt là 5144 kJ; 1 mol ethanol tỏa ra lượng nhiệt là 1276 kJ; khối lượng riêng: Dethanol = 0,789 g/ml và Doctane = 0,703 g/ml.
a. Viết phương trình hóa học xảy ra khi đốt cháy xăng E5 hoặc E10.
b. Xác định lượng nhiệt (kJ) tỏa ra khi đốt cháy 1 lít xăng E5 hoặc E10.
c. Tính tỉ lệ nhiệt tỏa ra khi đốt xăng E10 so với xăng E5. Tính tỉ lệ khí carbonic sinh ra do các đồng phân octane khi đốt xăng E10 so với xăng E5. Hãy cho biết khi sử dụng loại xăng nào thì bảo vệ môi trường tốt hơn?
Câu 4 (4,5 điểm):
(Xem giải) 1. Methyl butanoate có mùi thơm của trái cây nên thường được sử dụng trong công nghiệm sản xuất bánh kẹo, nước giải khát,… Trong phòng thí nghiệm, methyl butanoate được tổng hợp bằng cách đun nóng hỗn hợp gồm methanol, butanoic acid và sulfuric acid đặc trong bình cầu chịu nhiệt ở điều kiện thích hợp. Sau một thời gian thu được hỗn hợp E gồm alcohol, acid, ester và nước. Biết một số tính chất vật lí của các chất trong hỗn hợp E như sau:
| Chất | Khối lượng riêng ở 25°C (g.mL-1) | Độ tan ở 25°(g/100g nước) | Nhiệt độ sôi (°C) |
| H2O | 1,00 | 100 | |
| CH3OH | 0,79 | ∞ | 78 |
| CH3CH2CH2COOH | 0,96 | ∞ | 163,5 |
| CH3CH2CH2COOCH3 | 0,89 | 1,4 | 102 |
a. Viết phương trình hóa học xảy ra.
b. Để yên bình cầu một thời gian, hỗn hợp bị phân thành 2 lớp. Hãy cho biết thành phần các chất trong mỗi lớp?
c. Để tách methyl butanoate ra khỏi hỗn hợp E, sử dụng phương pháp chiết hay phương pháp chưng cất sẽ phù hợp hơn? Vì sao?
(Xem giải) 2. Cho các sơ đồ phản ứng theo đúng tỉ lệ mol:
(1) X + 2NaOH → X1 + Y1 + Y2 + 2H2O
(2) X2 + 2NaOH → X3 + 2H2O
(3) X3 + 2NaOH (CaO, t°) → CH4 + 2Y2
(4) 2X1 + X2 → X4
Biết: X là muối có công thức phân tử là C3H12O3N2; X1, X2, X3, X4 là những hợp chất hữu cơ khác nhau; X1, Y1 đều làm quỳ tím ẩm hóa xanh; số nguyên tử cacbon trong X4 là 7. Xác định công thức cấu tạo của X, X1, X2, X3, X4, Y1, Y2 và hoàn thành các phản ứng hóa học trong sơ đồ trên?
(Xem giải) 3. Peptide X có công thức cấu tạo như hình bên dưới.
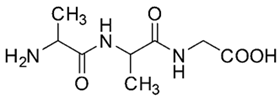
Thủy phân hoàn toàn 2,604 gam X trong 40 mL dung dịch NaOH 1M đun nóng, thu được dung dịch Y. Cho Y tác dụng với dung dịch HCl dư thu được dung dịch Z. Cô cạn dung dịch Z đến khối lượng không đổi, thu được m gam chất rắn khan.
a. Cho biết thứ tự các α-amino acid cấu tạo nên peptide X.
b. Tính giá trị của m.
Câu 5 (3,0 điểm):
(Xem giải) 1. Từ lá cây bạc hà có thể chiết xuất được tinh dầu bạc hà, có công dụng như: khử mùi và làm sạch không khí, hỗ trợ hoạt động của hệ tiêu hóa, hỗ trợ điều trị cảm cúm, … Thành phần chính của tinh dầu bạc hà là menthol (C10H20O), ngoài ra còn chứa các hợp chất khác như: menthone (C10H18O), menthol ester (menthyl acetate), …

(R1, R2, R3 là các gốc hydrocarbon)
a. Viết công thức cấu tạo của menthol, menthone, menthyl acetate. So sánh nhiệt độ sôi của menthol, menthone.
b. Tinh dầu bạc hà chứa ít nhất 60% menthol, 3 – 9% menthol ester theo khối lượng và các thành phần phụ khác. Menthol ester thường gặp là menthyl acetate. Cân chính xác 5 gam tinh dầu bạc hà cho vào bình cầu dung tích 100 mL, thêm tiếp 3 mL ethanol 96%. Cho tiếp vào bình cầu 50 mL dung dịch KOH 0,5M trong ethanol 96% và 5 giọt chất chỉ thị màu phenolphthalein. Đun nóng cách thủy bình cầu có lắp ống sinh hàn ngược để phản ứng xà phòng hóa xảy ra hoàn toàn, để nguội. Pha loãng hỗn hợp sau phản ứng bằng 100 mL nước cất, sau đó thêm từ từ dung dịch HCl 0,5M vào đến khi hỗn hợp mất màu thì thấy đã dùng hết 45 mL dung dịch HCl. Tính phần trăm khối lượng menthyl acetate trong tinh dầu bạc hà.
(Xem giải) 2. Một pin Galvani có cấu tạo như sau:
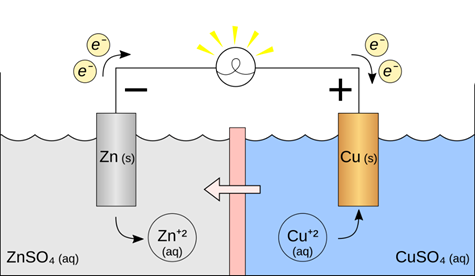
Trong đó, màng bán thấm chỉ cho nước và các anion đi qua. Biết rằng thể tích của các dung dịch đều là 0,50 L và nồng độ chất tan trong dung dịch là 1,00 M. Cho E°Zn2+/Zn = -0,763V; E°Cu2+/Cu = +0,340V.
a. Xác định Anode, cathode của pin điện hoá trên, viết quá trình xảy ra ở mỗi điện cực.
b. Có các nhận xét sau về pin Ganvani trên.
(1) Sức điện động chuẩn của pin là 1,103 V.
(2) Phản ứng chung xảy ra trong pin điện là phản ứng trao đổi ion trong dung dịch chất điện li.
(3) Khối lượng điện cực zinc giảm đúng bằng khối lượng điện cực copper tăng.
(4) Nồng độ ion SO42- (aq) trong dung dịch ZnSO4 tăng và trong dung dịch CuSO4 giảm dần.
Cho biết các nhận xét trên đúng hay sai? Giải thích?
(Xem giải) 3. Pin nhiên liệu được nghiên cứu rộng rãi nhằm thay thế nguồn nhiên liệu hóa thạch ngày càng cạn kiệt. Trong pin nhiên liệu, dòng điện được tạo ra do phản ứng oxi hóa nhiên liệu (hydrogen, carbon monooxide, methanol, ethanol, propane,…) bằng oxygen không khí. Trong pin propane – oxygen, phản ứng tổng cộng xảy ra khi pin hoạt động như sau:
C3H8 (s) + 5O2 (s) + 6OH- (aq) → 3CO32- (aq) + 7H2O (l)
Ở điều kiện chuẩn, khi đốt cháy hoàn toàn 1 mol propane theo phản ứng trên thì sinh ra một lượng năng lượng là 2500,00 kJ. Một bóng đèn công suất 10W được thắp sáng bằng pin nhiên liệu propane – oxygen. Biết hiệu suất quá trình oxi hóa propane là 80,0%; hiệu suất sử dụng năng lượng là 100%. Khi sử dụng 220 gam propane làm nhiên liệu ở điều kiện chuẩn, tính thời gian (giờ) bóng đèn được thắp sáng liên tục?


Bình luận