[2025 – 2026] Khảo sát HSG cụm 7 trường Thanh Hóa (Lần 7)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề 012-H12A năm 2025-2026
⇒ Thời gian làm bài: 90 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1C | 2B | 3B | 4C | 5A | 6C | 7B | 8B | 9B | 10B |
| 11D | 12C | 13A | 14D | 15C | 16A | 17C | 18B | 19A | 20D |
| Câu 21 | Câu 22 | Câu 23 | Câu 24 | Câu 25 | Câu 26 | |
| (a) | S | Đ | S | Đ | Đ | Đ |
| (b) | S | S | S | Đ | Đ | Đ |
| (c) | Đ | S | S | Đ | S | Đ |
| (d) | S | Đ | S | S | Đ | Đ |
| Câu 27 | Câu 28 | Câu 29 | Câu 30 | Câu 31 | Câu 32 |
| 234 | 40,8 | 2933 | 14 | 3 | 14,0 |
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 20. Mỗi câu thí sinh chỉ chọn một phương án đúng
(Xem giải) Câu 1: Vào mùa đông các nước vùng ôn đới có nhiệt độ không khí dưới 0°C. Dung dịch làm mát động cơ xe ô tô được sử dụng là dung dịch ethylenglycol 62% thay vì dùng nước. Biết rằng nếu hoà tan 1 mol ethylenglycol vào 1000 gam nước thì nhiệt độ đông đặc của dung dịch giảm 1,86°C. Vậy dung dịch ethylenglycol 62% đông đặc ở nhiệt độ nào?
A. -41,7°C. B. -30,0°C. C. -48,9°C. D. -38,2°C.
(Xem giải) Câu 2: Cho phản ứng oxi hóa khử sau: aK2Cr2O7 + bRCH2OH + cKHSO4 → dRCHO + eK2SO4 + fCr2(SO4)3 + gH2O. (a, b, c, d, e, f, g là các hệ số cân bằng nguyên tối giản, R là gốc hydrocarbon). Tổng giá trị a + b + c bằng bao nhiêu?
A. 11. B. 12. C. 13. D. 28.
(Xem giải) Câu 3: Cho đồ thị bên biểu diễn sự biến thiên nồng độ của các chất trong hệ phản ứng theo thời gian (với điều kiện nhiệt độ không đổi) của hai phản ứng sau:
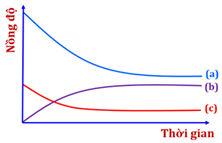
(1) N2(g) + 3H2(g) ⇋ 2NH3(g) với hằng số cân bằng K1
(2) ½N2(g) + ³⁄₂H2(g) ⇋ NH3(g) với hằng số cân bằng K2
Phát biểu nào sau đây đúng?
A. Đường (a), (b) và (c) lần lượt biểu diễn sự biến thiên nồng độ của N2(g), NH3(g) và H2(g).
B. Phản ứng nhanh đạt đến trạng thái cân bằng hơn khi thêm chất xúc tác.
C. Mối liên hệ giữa hằng số cân bằng K1 và K2 là K1 = 2K2.
D. Tại thời điểm cân bằng, nồng độ N2(g), H2(g) và NH3(g) không đổi do phản ứng đã dừng lại.
(Xem giải) Câu 4: Phân đạm urea, có công thức hoá học là (NH2)2CO. Phân đạm có vai trò rất quan trọng đối với cây trồng và thực vật nói chung, đặc biệt là cây lấy lá như rau. Phân đạm cùng với phân lân, phân kali góp phần tăng năng suất cho cây trồng. Trong tự nhiên, phân đạm tồn tại trong nước tiểu của các loài động vật và con người. Phát biểu nào sau đây đúng?
A. Urea được điều chế bằng cách cho NH3 tác dụng với CH4.
B. Phân đạm cung cấp nguyên tố N, P, K dưới dạng hóa hợp.
C. Thực tế ta có thể trộn phân đạm urea với phân kali để bón.
D. Thực tế có thể bón kết hợp giữa urea với vôi để khử chua.
(Xem giải) Câu 5: Hình bên mô phỏng thiết bị dùng để chưng cất tinh dầu cây ngò gai. Biết rằng tinh dầu cây ngò gai có khối lượng riêng nhỏ hơn 1 g/mL và chứa các hợp chất hữu cơ bị oxi hoá trong không khí.
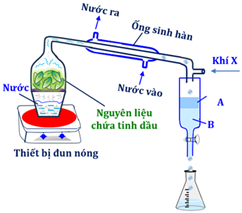
Phát biểu nào sau đây đúng?
A. Sơ đồ theo hình bên có thể áp dụng để tách các chất có nhiệt độ sôi cao và không tan trong nước như chưng cất tinh dầu bưởi, tinh dầu sả chanh.
B. Phương pháp chưng cất đã sử dụng như hình bên là chưng cất thường.
C. Tinh dầu nằm ở phần B và có thể tách A và B ra khỏi nhau bằng phương pháp chiết lỏng – lỏng.
D. Khí X ở đây có thể là oxygen.
(Xem giải) Câu 6: Hiện nay, trong công nghiệp phenol và acetone được điều chế từ cumen (isopropyl benzene) theo sơ đồ sau:
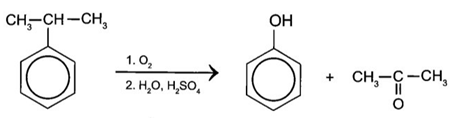
Khi oxi hoá 1 tấn cumene trong công nghiệp với hiệu suất của quá trình điều chế là 95% thì thu được m tấn phenol. Nhận định nào sau đây đúng?
A. Giá trị của m là 0,87 tấn (làm tròn đến hàng phần trăm).
B. Phenol và cumen đều làm mất màu dung dịch nước bromine.
C. Acetone vừa có khả năng bị khử bởi LiAlH4, vừa có thể bị oxi hóa bởi I2/OH-.
D. Ở điều kiện thường, phenol là chất rắn màu trắng, ít tan trong nước nhưng tan tốt trong dung môi acetone.
(Xem giải) Câu 7: Cho 4 hợp chất hữu cơ:
| Kí hiệu | M | N | P | Q |
| Công thức phân tử | C3H6O | C3H6O2 | C3H4O | C3H4O2 |
| Tính chất | M, P bị oxi hóa bởi thuốc thử Tollens | |||
| N, Q phản ứng được với dung dịch NaOH | ||||
| Q + H2 (Ni, t°) → N | ||||
| P + O2 (xt, t°) → Q | ||||
M, P, N và Q lần lượt là
A. C2H5CHO; CH2=CHCHO; CH2=CHCOOH; C2H5COOH.
B. C2H5CHO; CH2=CHCHO; C2H5COOH; CH2=CHCOOH.
C. CH2=CHCOOH; C2H5COOH; C2H5CHO; CH2=CHCHO.
D. CH2=CHCHO; C2H5CHO; C2H5COOH; CH2=CHCOOH.
(Xem giải) Câu 8: Cho các phát biểu sau:
(a) Khi tinh bột bị thủy phân không hoàn toàn tạo thành dextrin, maltose và glucose, trong đó dextrin không phải là hợp chất carbohydrate.
(b) Fructose và glucose đều có khả năng tham gia phản ứng tráng bạc với thuốc thử Tollens.
(c) Saccharose và tinh bột đều bị thủy phân khi đun nóng (có xúc tác base).
(d) Tinh bột được tạo thành trong cây xanh nhờ quá trình quang hợp.
(e) Thủy phân cellulose và tinh bột trong môi trường acid sản phẩm cuối cùng thu được là glucose.
Số phát biểu đúng là
A. 2. B. 3. C. 5. D. 4.
(Xem giải) Câu 9: Cho các công thức cấu tạo sau:
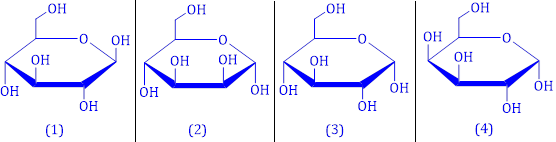
Các công thức cấu tạo biểu diễn hai dạng α-glucose và β-glucose lần lượt là
A. (1) và (3). B. (3) và (1). C. (2) và (4). D. (4) và (2).
(Xem giải) Câu 10: Trong dung dịch muối CoCl2 (màu hồng) trong một ống nghiệm, tồn tại cân bằng hoá học sau: [Co(H2O)6]2+ (màu hồng) + 4Cl- ⇋ [CoCl4]2- (màu xanh) + 6Η2Ο; ![]() > 0. Cho các phát biểu sau:
> 0. Cho các phát biểu sau:
(a) Khi ngâm ống nghiệm vào cốc nước nóng, dung dịch chuyển màu xanh.
(b) Khi thêm từ từ HCl đặc, dung dịch thu được có màu hồng.
(c) Thêm một vài giọt dung dịch AgNO3, dung dịch chuyển màu xanh.
(d) CoCl2 có thể được dùng như một tín hiệu thông báo có nước trong chất chống ẩm.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 11: Mùi tanh của cá chủ yếu do trimethylamine (X) gây ra. Người ta định lượng được trong 100 gam một loại cá nước ngọt, có 88,5 mg X. Để khử mùi tanh của cá sau khi mổ để nấu, người ta dùng giấm ăn có nồng độ 5%. Tính khối lượng (gam) giấm ăn tối thiểu cần để khử hoàn toàn mùi tanh cho con cá 5 kg ở trên.
A. 101,7 gam. B. 225 gam. C. 44,25 gam. D. 90 gam.
(Xem giải) Câu 12: Dipeptide Phe-Tyr có cấu trúc:
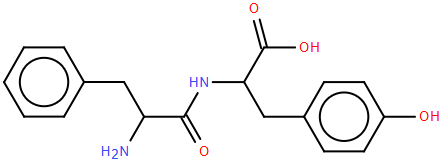
Hỗn hợp của dipeptide Phe-Tyr và hai amino acid thành phần (Phe và Tyr) đã được tiến hành điện di trong dung dịch đệm pH = 12. Tại điều kiện này, thông tin của ba chất được cung cấp như sau:
| Chất | Điện tích tại pH = 12 | Kích thước tương đối |
| Phe-Tyr | -2 | Lớn |
| Tyr | -2 | Nhỏ |
| Phe | -1 | Nhỏ |
Vào cuối thí nghiệm thu được những kết quả sau: Ba chấm P, R, S là đại diện cho ba chất Phe hoặc Tyr hoặc Phe-Tyr (không theo thứ tự). Các chấm R và S vẫn nằm rất gần nhau.
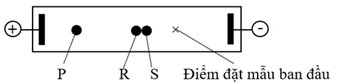
Cho các nhận định sau về quá trình điện di:
(a) Kích thước phân tử càng lớn thì khả năng di chuyển về phía điện cực càng kém.
(b) Chất có giá trị điện tích càng nhỏ thì khả năng di chuyển về phía điện cực càng tốt.
(c) Chất P là Tyr.
(d) Amino acid Phe có khả năng di chuyển với tốc độ gần như dipeptide Phe-Tyr trong điện trường.
(e) Trong dung dịch đệm pH = 12 có thể tách riêng từng chất trong hỗn hợp Phe-Tyr, Phe, Tyr bằng phương pháp điện di.
Số nhận định đúng là
A. 5. B. 4. C. 3. D. 2.
(Xem giải) Câu 13: Copolymer được tạo thành từ 2 monomer khác nhau. Khi thực hiện phản ứng trùng hợp gồm ethylene và styrene thu được copolymer X. Phân tích thành phần nguyên tố của X thấy phần trăm khối lượng của carbon bằng 90,91%. Trong thành phần của X, cứ một mắt xích styrene thì có bao nhiêu mắt xích ethylene?
A. 1. B. 2. C. 1,5. D. 3.
(Xem giải) Câu 14: Cho các phát biểu sau:
(1) Tơ visco, tơ acetate đều thuộc loại tơ tổng hợp.
(2) Polyethylene và poly(vinyl chloride) là sản phẩm của phản ứng trùng hợp.
(3) Tơ nylon-6,6 được điều chế từ hexamethylendiamine và stearic acid.
(4) Cao su thiên nhiên không tan trong nước cũng như trong xăng, benzene.
(5) Tơ nitron (olon) được tổng hợp từ vinyl cyanide (acrylonitrile).
Số phát biểu đúng là
A. 4. B. 3. C. 5. D. 2.
(Xem giải) Câu 15: Thiết kế một pin điện hóa bằng cách nhúng thanh Zn và thanh Cu (không tiếp xúc với nhau) vào cốc đựng dung dịch H2SO4 loãng. Nối thanh kẽm và thanh đồng bằng dây dẫn (có một khóa X) như hình bên.
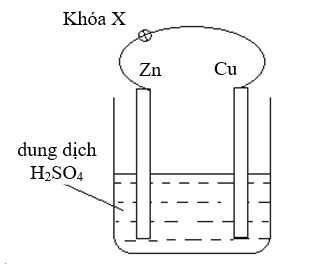
Cho các phát biểu sau:
(1) Khi mở khóa X có bọt khí thoát ra ở thanh Cu.
(2) Khi mở khóa X hay đóng khóa X thanh kẽm đều bị oxi hóa.
(3) Năng lượng hóa học dự trữ trong các chất phản ứng chủ yếu được chuyển hóa thành năng lượng điện khi pin hoạt động.
(4) Khi đóng khóa X thanh kẽm đóng vai trò cực âm của pin điện và bị oxi hóa.
(5) Khi thay thanh Cu bằng thanh Mg thì có dòng electron dịch chuyển từ Zn sang Mg.
(6) Cho thêm vào cốc dung dịch CuSO4 thấy cực Zn tan nhanh hơn, khối lượng cực Cu tăng đồng thời bọt H2 thoát ra ở cực Cu nhiều hơn
Số phát biểu đúng là
A. 5. B. 2. C. 3. D. 4.
(Xem giải) Câu 16: Tiến hành các thí nghiệm sau:
(a) Cho a mol bột Fe vào dung dịch chứa 3a mol AgNO3.
(b) Cho từ từ từng giọt dung dịch chứa a mol HCl vào dung dịch chứa a mol Na2CO3.
(c) Cho dung dịch chứa a mol Ca(HCO3)2 vào dung dịch chứa a mol NaOH.
(d) Cho dung dịch chứa a mol Ba(HCO3)2 vào dung dịch chứa a mol NaHSO4.
(e) Cho hỗn hợp gồm a mol Cu và a mol Fe3O4 vào dung dịch loãng chứa 5a mol H2SO4 loãng.
Sau khi các phản ứng hoàn toàn, số thí nghiệm thu được dung dịch chứa nhiều hơn một chất tan là
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 17: Cho sơ đồ phản ứng sau:
![]()
Cho các phát biểu sau:
(a) Nhiệt độ sôi của D > C > A > B.
(b) D có thể được điều chế trực tiếp từ A hoặc B hoặc C bằng một phản ứng hóa học.
(c) Thực hiện phản ứng cộng HCN vào chất D thu được sản phẩm hữu cơ là CH3CH(OH)CN
(d) Ba chất A, B, D đều có thể làm mất màu bromine trong dung môi CCl4.
(e) Cả A và D đều phản ứng với thuốc thử tollens cho ra kết tủa.
Số phát biểu đúng là
A. 5. B. 4. C. 3. D. 2.
(Xem giải) Câu 18: Cho sơ đồ mô tả cơ chế giặt rửa của xà phòng như hình bên dưới:
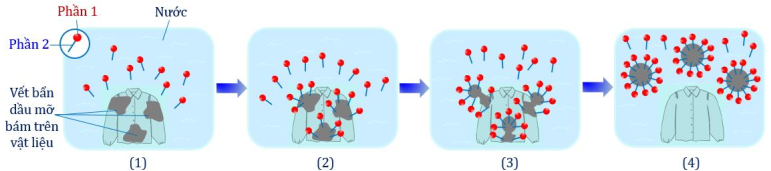
Cho các phát biểu sau:
(1) Tính giặt rửa của xà phòng tỏ ra hiệu quả hơn khi giặt đồ với nước có môi trường acid.
(2) Không nên giặt đồ với xà phòng bằng nước có tính cứng (chứa nhiều ion Ca2+, Mg2+).
(3) Phần 1 là phần ưa nước, phần 2 là phần kị nước.
(4) Phân tử xà phòng có khả năng xâm nhập vào vết bẩn dầu mỡ nhờ phần kị nước.
(5) Xà phòng bị thủy phân mạnh trong môi trường kiềm.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 19: Tiến hành hai thí nghiệm như hình vẽ bên:
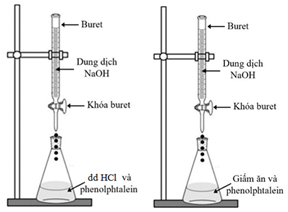
• Thí nghiệm 1: Chuẩn độ dung dịch NaOH chưa biết nồng độ bằng dung dịch HCl 0,1M với chất chỉ thị phenolphthalein.
• Thí nghiệm 2: Chuẩn độ acetic acid có trong một mẫu giấm ăn bằng dung dịch NaOH 0,1M với chất chỉ thị phenolphthalein.
Cho các phát biểu sau:
(a) pH của dung dịch HCl > pH của dung dịch CH3COOH
(b) Dung dịch chuẩn trong thí nghiệm 1 và thí nghiệm 2 lần lượt là HCl và CH3COOH
(c) Tại điểm tương đương, dung dịch trong bình tam giác của cả hai thí nghiệm đều không chuyển màu.
(d) Tại thời điểm kết thúc chuẩn độ, dung dịch trong bình tam giác của cả hai thí nghiệm đều có màu hồng nhạt
Số phát biểu đúng là
A. 1. B. 2. C. 3. D.4
(Xem giải) Câu 20: Tiến hành điện phân dung dịch (có màng ngăn) gồm NaCl, HCl, CuCl2 và phenolphthalein. Phát biểu nào sau đây đúng?
A. Nước bên anode bị điện phân trước so với bên cathode.
B. Trong quá trình điện phân pH của dung dịch giảm dần.
C. Khi nước bắt đầu điện phân ở anode thì dừng điện phân, lúc đó hỗn hợp khí thu được gồm ba khí.
D. Trong quá trình điện phân cho đến lúc nước bắt đầu bị điện phân ở cả hai điện cực thì màu của dung dịch biến đổi từ: Không màu → Hồng.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 21 đến câu 26. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 21: Trong một giờ thực hành, Giáo viên đưa ra yêu cầu: Vỏ trứng đã được loại bỏ các chất phản ứng được với hydrochloric acid trừ CaCO3. Hãy xác định hàm lượng CaCO3 trong vỏ trứng.
Một nhóm học sinh đã tiến hành như sau:
• Bước 1: Đặt câu hỏi nghiên cứu. Một số học sinh đưa ra câu hỏi nghiên cứu như sau:
HS1: “Trong vỏ trứng có bao nhiêu phần trăm khối lượng là calcium carbonate (CaCO3)?”
HS2: “Vỏ trứng có chứa calcium carbonate không?”
HS3: “Dùng bao nhiêu mL HCl để phản ứng hết vỏ trứng?”
HS4: “Trong 1 gam vỏ trứng có bao nhiêu gam CaCO3?”
• Bước 2: Xây dựng giả thuyết
• Bước 3: Tiến hành thí nghiệm
• • Bước 3.1: Cân khoảng 3,0 gam vỏ trứng đã được loại bỏ các chất phản ứng được với hydrochloric acid trừ CaCO3, nghiền mịn, khô, cho vào bình tam giác.
• • Bước 3.2: Thêm 50mL dung dịch HCl 1M vào bình tam giác. Lắc đều đến khi phản ứng hoàn toàn. Lọc lấy dung dịch sau hòa tan được 50mL (dung dịch 1).
• • Bước 3.3: Dùng pipette lấy 10mL dung dịch 1, cho vào bình tam giác rồi cho thêm vài giọt phenolphtalein. Dùng burette nhỏ giọt NaOH 0,1M cho đến khi dung dịch đổi màu hồng nhạt bền 20s. Lặp lại thí nghiệm chuẩn độ 3 lần ghi nhận dung dịch NaOH đã dùng lần lượt là 9,9mL; 10,1mL và 10,0mL.
• Bước 4: Phân tích dữ liệu và tính toán kết quả.
• Bước 5: Kết luận.
a) Kết quả thí nghiệm cho thấy, vỏ trứng chứa khoảng 81,67% khối lượng là CaCO3 (làm tròn đến hàng phần trăm).
b) Ở bước 3.3, khi dung dịch đổi màu hồng nhạt bền 20s, quan sát có một giọt dung dịch còn treo ở đầu dưới của burette. Học sinh cho rằng phải cộng thêm 0,03mL (ứng với 1 giọt chất lỏng) vào thể tích đã đọc ở burette nếu không sẽ ảnh hưởng đến kết quả tính nồng độ HCl được tính từ kết quả chuẩn độ.
c) Nếu học sinh đưa ra giả thuyết: “CaCO3 trong vỏ trứng phản ứng với dung dịch HCl tạo muối và giải phóng CO2. Dựa vào lượng acid phản ứng với CaCO3, có thể tính được hàm lượng CaCO3.” thì đây là giả thuyết đúng.
d) Trong bốn câu hỏi nghiên cứu của học sinh đưa ra, câu hỏi của HS1 là câu hỏi duy nhất phù hợp với mục tiêu thí nghiệm.
(Xem giải) Câu 22: Chlorine và sodium hydroxide là hoá chất được sử dụng để sản xuất nhiều chất trung gian trong các ngành công nghiệp hoá học (polymer, bột giấy, giấy), dược phẩm, thuốc bảo vệ thực vật, sản xuất xà phòng, luyện kim,… Công nghệ sử dụng phổ biến để điều chế Cl2 và NaOH là điện phân dung dịch NaCl có màng ngăn. Mô hình thiết bị điện phân được thể hiện trong hình sau:
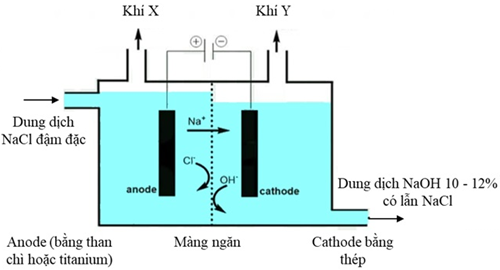
Dung dịch NaCl được đưa vào từ anode và được duy trì ở mức cao hơn bên cathode giúp chất lỏng chảy từ trái sang phải, ngăn không cho dung dịch NaOH chảy sang ngăn anode.
a) Phương trình hoá học của phản ứng điện phân: 2NaCl(aq) + 2H2O(l) → Cl2(g) + H2(g) + 2NaOH(aq)
b) Để thu được dung dịch NaOH tinh khiết hơn (nồng độ 50%) có thể tăng nồng độ dung dịch NaCl ban đầu.
c) Ở cathode, nước bị khử thay vì Na+ do thế điện cực chuẩn của cặp 2H+/H2 cao hơn Na+/Na.
d) Tiến hành điện phân liên tục 5,00 giờ với dòng điện không đôi 25,0 kA (hiệu suất dòng cho cả 2 điện cực là 96,5%) 2000 kg dung dịch muối ăn NaCl 25% được cấp vào ngăn anode. Dung dịch thu được ở cathode là NaOH 12,0% khối lượng, chứa 2,0% NaCl (do rò rỉ và kéo theo). Khối lượng NaCl còn lại ở anode là 214,83125 kg. Biết trong quá trình điện phân, màng ngăn không đảm bảo nên đã có 5% Cl2 sinh ra phản ứng với NaOH.
(Xem giải) Câu 23: Dưới đây là sơ đồ để tách hỗn hợp amine (RNH2) và phenol (ArOH). Giả sử các chất trên không tan trong nước nhưng tan trong diethyl ether. Hỗn hợp này được tách thành các phần A, B.
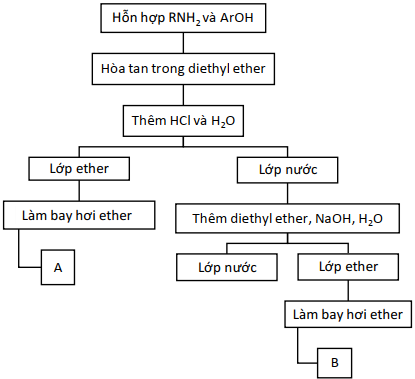
a) Chất A là amine.
b) Dung môi diethyl ether được thêm vào các bước cùng với dung môi nước nhằm mục đích hòa tan HCl và NaOH.
c) Quy trình tách trên dựa trên cở sở của phương pháp kết tinh.
d) Có thể áp dụng quy trình tách này cho hỗn hợp gồm chất béo tristearin và phenol.
(Xem giải) Câu 24: Muối copper(II) sulfate khan dễ hút ẩm tạo thành muối ngậm nước. Để xác định hàm lượng nước kết tinh trong muối CuSO4.nH2O (coi là không lẫn tạp chất) bằng phương pháp đun nóng, một nhóm học sinh thực hiện theo qui trình sau:
• Bước 1: Cân chén nung và ghi lại khối lượng vào bảng kết quả (m1)
• Bước 2: Thêm một lượng khoảng 2 gam CuSO4.nH2O vào chén nung. Cân và ghi khối lượng mới của chén nung có chứa muối (m2).
• Bước 3: Đặt chén nung có chứa CuSO4.nH2O lên lưới amiang và đun nóng khoảng 2 phút (nhiệt độ khoảng 150°C- 200°C).
• Bước 4: Để nguội, sau đó cân lại chén nung cùng phần chất rắn còn lại bên trong và ghi lại khối lượng (m3).
Lặp lại bước 3 và bước 4 cho đến khi khối lượng cân được ở bước 4 không đổi. Kết quả của nhóm học sinh thu được ở bảng bên dưới:
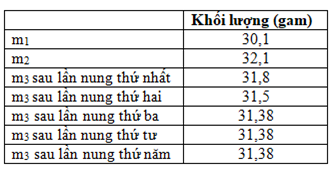
a) Sau khi khối lượng cân được ở bước 4 không đổi nếu để chất rắn ngoài không khí ẩm, khối lượng chất rắn sẽ tăng.
b) Giả thuyết khoa học phù hợp với thí nghiệm trên là khi đun nóng, lượng nước kết tinh trong muối CuSO4.nH2O bay hơi, làm khối lượng chất rắn giảm, từ khối lượng giảm có thể xác định được công thức của CuSO4.nH2O.
c) Từ số liệu của thí nghiệm trên nhóm học sinh tính toán và xác định được n = 5.
d) Muối CuSO4 khan không màu, khi tan trong nước tạo thành dung dịch có màu xanh.
(Xem giải) Câu 25: Enzyme catalase là một protein có khả năng xúc tác cho phản ứng phân hủy hydrogen peroxide (H2O2). Hoạt tính xúc tác của enzyme càng cao thì phản ứng phân hủy H2O2 diễn ra càng nhanh. Hoạt tính xúc tác của enzyme phụ thuộc vào các yếu tố như nhiệt độ, pH,… Một nhóm học sinh dự đoán “pH càng giảm thì hoạt tính xúc tác của enzyme catalase càng cao”. Từ đó, học sinh tiến hành thí nghiệm ở nhiệt độ không đổi nhưng thay đổi pH của môi trường để kiểm tra dự đoán trên như sau:
• Bước 1: Lấy 2 mL dung dịch H2SO4 10% vào ống nghiệm (1). Sau đó thêm khoảng 0,5 mL dung dịch KMnO4 0,02M vào lắc nhẹ.
• Bước 2: Thêm 2,0 mL dung dịch một loại enzyme catalase vào một ống nghiệm (2) chứa 5,0 mL dung dịch có vai trò duy trì ổn định pH bằng 5.
• Bước 3: Thêm tiếp 2,0 mL dung dịch (H2O2) vào ống nghiệm (2), lắc đều
• Bước 4: Sau khoảng mỗi 10 giây, dùng ống hút lấy 1-2 giọt hỗn hợp phản ứng trong ống nghiệm (2) và cho vào ống nghiệm (1), quan sát để từ đó xác định thời gian H2O2 phân hủy hết.
Lặp lại thí nghiệm theo ba bước trên, chỉ thay đổi pH dung dịch trong Buớc 2 lần lượt là 6; 7; 8; 9.
Nhóm học sinh ghi lại kết quả thời gian (giây) mà hydrogen peroxide phân hủy hết trong môi trường pH = 5; 6; 7; 8; 9. Kết quả như sau:
| pH | 5 | 6 | 7 | 8 | 9 |
| Thời gian phân hủy (giây) | 150 | 120 | 60 | 90 | 120 |
a) Ở các giá trị pH nghiên cứu, hoạt tính xúc tác của enzyme catalase cao nhất tại pH = 7.
b) Theo số liệu thu được, phản ứng phân hủy H2O2 ở pH = 7 diễn ra nhanh hơn ở pH = 6.
c) Từ kết quả thí nghiệm, kết luận được hoạt tính xúc tác của enzyme catalase tăng khi pH tăng.
d) pH tối ưu của enzyme catalase là pH trung tính.
(Xem giải) Câu 26: Hiện nay, pin lithium ion được sử dụng phổ biến trong nhiều thiết bị như điện thoại, laptop, xe điện,… do có ưu điểm gọn nhẹ và có mật độ năng lượng cao. Xét một pin lithium ion có cathode làm từ LiMn2O4 và anode làm từ graphite. Giữa các lớp của graphite có các nguyên tử xâm nhập tạo thành hợp chất ion có công thức dạng LixC6. Phản ứng tổng cộng xảy ra trong pin khi phóng điện và khi nạp điện như sau: Li1-xMn2O4 + LixC6 ⇋ Li1Mn2O4 + C6 (chiều thuận phóng điện, chiều nghịch nạp điện).
a) Số oxi hoá của Mn trong Li1-xMn2O4 cao hơn trong LiMn2O4.
b) Nếu x = 0,3 thì khi phóng điện, 1 mol LixC6 cung cấp 0,3 mol electron.
c) Khi pin nạp điện, ở anode xảy ra quá trình oxy hóa LiMn2O4 thành Li1-xMn2O4 và x Li+.
d) Khi pin phóng điện, ở anode xảy ra quá trình oxi hoá LixC6 thành xLi+ và C6.
PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 27 đến câu 32.
(Xem giải) Câu 27: Cho các phản ứng sau theo đúng tỉ lệ:
2X + O2 (xt, t°) → 2Y + 2H2O
Y + 4AgNO3 + 6NH3 + 2H2O (t°) → (NH4)2CO3 + 4Ag + 4NH4NO3
X + CH3COOH (H2SO4 đặc, t°) → Z + H2O
Cho các nhận định sau
(1) Dung dịch X hoà tan Cu(OH)2 tạo thành dung dịch màu xanh lam đặc trưng.
(2) Y có một tín hiệu mạnh trong phổ IR ở số sóng 1750 cm-1.
(3) Z có nhiệt độ sôi thấp hơn propionic acid do Z không tạo liên kết hydrogen.
(4) X rất độc, nếu uống phải dễ mù mắt, uống nhiều có thể gây tử vong.
Sắp xếp các nhận định đúng theo trật tự từ nhỏ đến lớn (ví dụ 1234, 134,…)
(Xem giải) Câu 28: Chiết lỏng – lỏng là phương pháp tách chất dựa trên sự phân bố khác nhau của chất tan giữa hai dung môi không trộn lẫn (như nước và ether). Kỹ thuật này thường dùng để tách, làm sạch hoặc phân tích hợp chất hữu cơ trong phòng thí nghiệm và công nghiệp. Một cốc thủy tinh chứa 145 gam nước (H2O) và 225 gam chloroform (CHCl3). Các chất lỏng không tan vào nhau, thêm vào 55 gam acetone (C3H6O), sau đó lắc đều và để cân bằng. Cho hệ số phân phối của acetone trong 2 dung môi là 1,72 và được tính theo công thức sau: k = (% khối lượng chất trong pha hữu cơ) / (% khối lượng chất trong pha nước).
Có bao nhiêu gam acetone tan trong dung môi hữu cơ? (kết quả được làm tròn đến hàng phần chục).
(Xem giải) Câu 29. Một nhà máy luyện kim sản xuất Zn từ 2,5 tấn quặng sphalerite (chứa 80% ZnS về khối lượng, còn lại là tạp chất không chứa kẽm (zinc)) với hiệu suất cả quá trình đạt 90% theo sơ đồ: ZnS → ZnO → Zn. Toàn bộ lượng kẽm (zinc) tạo ra được tráng cho x ống thép dài 6 m hình hộp chữ nhật: 40 × 80 (mm), độ dày của lớp mạ là 20 micromet (bỏ qua độ dày của ống thép) . Biết khối lượng riêng của kẽm là 7,14 g/cm³. Tìm giá trị của x (chỉ làm tròn kết quả ở bước tính cuối cùng và làm tròn đến hàng đơn vị)
(Xem giải) Câu 30: Trong trà xanh có chứa catechin, là một chất có rất nhiều lợi ích cho sức khỏe như chống oxi hóa, bảo vệ tim mạch, giúp giảm cân, ổn định đường huyết, tăng miễn dịch, hỗ trợ chống ung thư, tốt cho da và não bộ. Catechin có công thức cấu tạo như hình bên:
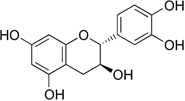
Một công ty sản xuất đồ uống muốn kiểm tra hàm lượng catechin trong nguyên liệu trà xanh thô. Theo tiêu chuẩn, trong 1 gam lá trà khô phải có ít nhất 80 mg catechin. Phòng kiểm nghiệm chiết 2,00 g lá trà khô trong dung dịch ethanol 70% và thực hiện phân tích UV–Vis. Tại bước sóng 278 nm, với 50,0 mL dung dịch chiết có độ hấp thụ (A) đo được là 0,432. Từ đồ thị biểu diễn mối quan hệ giữa độ hấp thụ (A) và nồng độ catechin (C), người ta có phương trình tuyến tính: A = 0,0052 × C, Trong đó: C là nồng độ catechin (mg/L) và A là độ hấp thụ.
Cho các phát biểu sau
(1) Catechin có công thức phân tử là C15H14O6.
(2) 1 mol Catechin phản ứng được với tối đa 5 mol NaOH.
(3) Phương pháp tách catechin ra khỏi lá trà là phương pháp chiết lỏng – lỏng.
(4) Nồng độ catechin trong dung dịch chiết bằng 83,1 mg/L (kết quả làm tròn đến hàng phần chục)
(5) Kết quả kiểm nghiệm cho thấy mẫu trà này đã đạt tiêu chuẩn về hàm lượng catechin.
Sắp xếp các nhận định đúng theo trật tự từ nhỏ đến lớn (ví dụ 1234, 134,…)
(Xem giải) Câu 31: Cellulose là carbohydrate có nhiều ứng dụng quan trọng trong đời sống và sản xuất. Hai tính chất hóa học quan trọng của cellulose là phản ứng thủy phân trong môi trường acid và phản ứng của nhóm -OH.
– Khi cho cellulose phản ứng với HNO3 đặc nóng có H2SO4 đặc làm xúc tác sẽ tạo thành hỗn hợp cellulose trinitrate và cellulose dinitrate.
– Khi cho cellulose phản ứng với lượng dư (CH3CO)2O trong CH3COOH có H2SO4 đặc làm xúc tác sẽ tạo thành cellulose triacetate [C6H7O2(OCOCH3)3]n. Thủy phân không hoàn toàn cellulose triacetate trong dung dịch CH3COOH sẽ tạo ra cellulose diacetate.
a) Trong cấu trúc phân tử cellulose diacetate, mỗi mắt xích có chứa một nhóm hydroxyl (-OH).
b) Phản ứng của cellulose với HNO3 đặc nóng thuộc loại phản ứng thủy phân trong môi trường acid.
c) Từ 16,20 tấn cellulose, với hiệu suất phản ứng tính theo cellulose là 90%, sẽ sản xuất tối đa được 26,73 tấn cellulose trinitrate
d) Hỗn hợp của cellulose triacetate và cellulose diacetate gọi là tơ cellulose acetate, có dạng sợi, mềm mại, thường được dùng làm vải may mặc.
Số phát biểu đúng là bao nhiêu?
(Xem giải) Câu 32: Chỉ số acid của chất béo là số mg KOH cần dùng để trung hòa hết lượng acid béo tự do có trong 1 gam chất béo. Nhà máy sản xuất xà phòng lifebuoy sử dụng m kg mỡ lợn (có chỉ số acid của chất béo bằng 7) chứa 5% tạp chất thì trong một ngày sẽ sản xuất được khoảng 8677 bánh xà phòng chứa 72% khối lượng muối của acid béo, còn lại là chất phụ gia và chất độn. Khối lượng NaOH đã tham gia phản ứng là 140 kg. Mỗi bánh xà phòng nặng 120 gam, hiệu suất phản ứng chất béo là 70%. Giá tiền của một bánh xà phòng mà nhà máy trên đã sản xuất là x nghìn đồng. Giá trị của x là bao nhiêu? (chỉ làm tròn kết quả ở bước tính cuối cùng và làm tròn đến hàng phần chục), dưới đây là bảng giá nguyên liệu và các chi phí:
| STT | Nội dung | Đơn giá |
| 1 | Mỡ lợn | 60000/1kg |
| 2 | Dung dịch NaOH 40% | 18000/1kg |
| 3 | Phụ gia + Chất độn | 25000/1kg |
| 4 | Nhân công, máy móc, chi phí khác | 5000/120 gam thành phẩm |


Bình luận