[2025 – 2026] Thi học sinh giỏi lớp 12 – Tỉnh Nghệ An
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 005-H12B năm 2025-2026
⇒ Thời gian làm bài: 150 phút
⇒ Bảng đáp án phần trắc nghiệm:
| Phần 1 | Phần 2 | 13 | 14 | 15 | 16 | ||
| 1C | 2A | 3C | (a) | Đ | S | S | S |
| 4A | 5A | 6B | (b) | S | Đ | Đ | S |
| 7A | 8B | 9A | (c) | S | Đ | Đ | Đ |
| 10D | 11A | 12C | (d) | Đ | S | Đ | Đ |
| Phần 3 | Câu 17 | 212 | Câu 18 | 2152 |
A. PHẦN TRẮC NGHIỆM (8,0 điểm)
PHẦN I (3,0 điểm): Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Ester E có công thức phân tử C4H8O2. Khi đun nóng E với dung địch acid loãng thu được carboxylic acid X (có phản ứng với thuốc thử Tollens) và alcohol Y. Oxi hóa Y bằng CuO thu được hợp chất hữu cơ Z có phản ứng iodoform. Công thức cấu tạo cùa E là
A. HCOOCH2CH2CH3. B. CH3COOCH2CH3.
C. HCOOCH(CH3)2. D. CH3CH2COOCH3.
(Xem giải) Câu 2. Một nhóm học sinh được yêu cầu kiểm chứng nhận định: “Khi tăng nồng độ thì tốc độ của phản ứng tăng”. Nhóm học sinh đã tiến hành các bước sau:
• Lập kế hoạch: Nhóm học sinh trên dự kiến cho 2 mẫu Zn giống nhau tác dụng với lượng dư dung dịch H2SO4 loãng có nồng độ khác nhau, trường hợp nào có thời gian phản ứng bé hơn thì có tốc độ lớn hơn.
• Tiến hành thí nghiệm: Nhóm học sinh đã tiến hành hai thí nghiệm (ở cùng các điều kiện nhiệt độ áp suất): chuẩn bị 2 mẫu kim loại Zn có hình dạng, kích thước tương đương và đều có khối lượng 1,0 gam.
– Thí nghiệm 1: Cho mẫu Zn thứ nhất vào 5 mL dung dịch H2SO4 1M.
– Thí nghiệm 2: Cho mẫu Zn thứ hai vào 5 mL dung dịch H2SO4 2M.
(a) Khi kết thúc phản ứng, khối lượng ZnSO4 thu được ở 2 thí nghiệm như nhau.
(b) Khi kết thúc phản ứng, cả 2 thí nghiệm đều không dư H2SO4.
(c) Dựa vào tốc độ thoát khí, nhóm học sinh có thể so sánh được tốc độ phản ứng trong 2 thí nghiệm.
(d) Nhóm học sinh đã làm sai bước tiến hành thí nghiệm so với kế hoạch.
Số nhận định đúng là
A. 3. B. 1. C. 4. D. 2.
(Xem giải) Câu 3. Khi nghiên cứu phản ứng ester hóa giữa etanoic acid và metanol người ta sử dụng kỹ thuật “đánh dấu đồng vị” bằng cách thay cả hai nguyên tử oxygen trong etanoic acid bằng đồng vị 18O, trong khi nguyên tử oxygen của methanol vẫn là 16O (các nguyên tử khác 12C, 1H). Khi phân tích sản phẩm ester bằng phổ khối (MS), xuất hiện tín hiệu m/z cực đại là
A. 74. B. 78. C. 76. D. 72.
(Xem giải) Câu 4. Xét cân bằng hóa học: CO(g) + H2O(g) ⇋ CO2(g) + H2(g). Biết giá trị ![]() và
và ![]() của các chất trong phản ứng trên như sau:
của các chất trong phản ứng trên như sau:
| Chất | CO(g) | H2O(g) | CO2(g) | H2(g) |
| -110,5 | -241,8 | -393,5 | 0,0 | |
| 197,7 | 188,8 | 213,8 | 130,7 |
Biết rằng ΔrHº, ΔrSº không phụ thuộc nhiệt độ, phản ứng trên đạt trạng thái cân bằng ở nhiệt độ bao nhiêu? (làm tròn kết quả đến hàng đơn vị)
A. 708°C. B. 1°C. C. 981°C. D. 272°C.
(Xem giải) Câu 5. Trong số các hợp chất: KCl, CO2, CH4, H2S, hợp chất có nhiệt độ nóng chảy cao nhất là
A. KCl. B. H2S. C. CH4. D. CO2.
(Xem giải) Câu 6. Ethyl iodide có khối lượng riêng 1,94 g/mL, nhiệt độ sôi 72,5°C; ethyl alcohol có khối lượng riêng 0,789 g/mL, nhiệt độ sôi 78,3°C. Ethyl alcohol tan vô hạn trong nước, còn ethyl iodide rất ít tan trong nước nhưng tan tốt trong ethyl alcohol. Để tinh chế ethyl iodide ra khỏi hỗn hợp ethyl iodide và ethyl alcohol dùng phương pháp nào sau đây?
A. Kết tinh.
B. Chiết lỏng – lỏng, dung môi là nước.
C. Chiết lỏng – lỏng, dung môi là ethanol.
D. Chưng cất.
(Xem giải) Câu 7. Trong công nghiệp sản xuất thùng gỗ đựng rượu vang, để diệt khuẩn và ngăn nấm mốc người ta đốt một dải giấy tẩm sulfur trong thùng gỗ rồi nhanh chóng đậy kín miệng thùng. Chất nào sau đây là tác nhân chính trong việc diệt khuẩn và ngăn nấm mốc?
A. SO2. B. SO3. C. H2S. D. H2SO4.
(Xem giải) Câu 8. Cho vào 2 ống nghiệm, mỗi ống 3 – 4 giọt dung dịch CuSO4 2% và 2 – 3 giọt dung dịch NaOH 10%, lắc nhẹ. Tiếp tục nhỏ 2 – 3 giọt glycerol (dư) vào ống nhiệm thứ nhất, 2 – 3 giọt dung dịch glucose (dư) vào ống nghiệm thứ 2. Lắc đều cả 2 ống nghiệm. Phát biểu nào sau đây đúng?
A. Kết thúc thí nghiệm, cả 2 ống nghiệm đều có kết tủa.
B. Kết thúc thí nghiệm, cả 2 ống nghiệm đều thu được dung dịch trong suốt.
C. Kết thúc thí nghiệm, ống thứ nhất thu được kết tủa, ống thứ hai thu được dung dịch trong suốt.
D. Kết thúc thí nghiệm, ống thứ nhất thu được dung dịch trong suốt, ống thứ hai thu được kết tủa.
(Xem giải) Câu 9. Acrolein là một chất lỏng có mùi khó chịu có công thức cấu tạo: CH2=CH-CHO. Trong công nghiệp, acrolein được sản xuất từ propylen và nó được sử dụng như một chất diệt khuẩn và nguyên liệu để sản xuất các hợp chất hóa học khác. Cho các phát biểu sau về acrolein:
(a) Acrolein là aldehyde không no.
(b) Hydrogen hóa acrolein trong điều kiện thích hợp thu được propyl alcohol.
(c) Acrolein tác dụng được với dung dịch nước bromine.
(d) Acrolein có nhiệt độ sôi cao hơn acrylic acid (CH2=CH-COOH).
Số nhận định đúng là
A. 3. B. 4. C. 1. D. 2.
(Xem giải) Câu 10. Tiến hành thí nghiệm: Cho khoảng 1,0 mL dung dịch phenol vào ống nghiệm rồi thêm tiếp vài giọt nước bromine và lắc đều. Cho các nhận xét:
(a) Sau phản ứng xuất hiện kết tủa trắng.
(b) Cho một mẩu giấy quỳ vào dung dịch sau phản ứng, mẫu giấy quỳ không đổi màu.
(c) Trong thí nghiệm trên xảy ra phản ứng thế bromine vào nhân thơm.
(d) Sản phẩm của phản ứng là 2,4,6-tribromophenol.
(e) Từ thí nghiệm trên cho thấy khả năng thế nguyên tử hydrogen ở vòng benzene của phenol khó hơn so với benzene.
Số nhận xét đúng là:
A. 2. B. 5. C. 4. D. 3.
(Xem giải) Câu 11. Trong số các hydrocarbon: ethane, propene, butyne, benzene. Ở nhiệt độ thường, số chất làm nhạt màu dung dịch nước bromine là
A. 3. B. 4. C. 2. D. 1.
(Xem giải) Câu 12. Trong quá trình sản xuất bromine từ nước biển, người ta dùng chất nào sau đây để oxi hóa Br- thành Br2?
A. F2. B. I2. C. Cl2. D. O2.
PHẦN II (4,0 điểm). Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, học sinh chọn đúng hoặc sai.
(Xem giải) Câu 13. Trong nuôi trồng thủy sản, người ta thường theo dõi chỉ số TAN (Total Ammonia Nitrogen) là tổng hàm lượng nguyên tố N có trong ion NH4+ (tan trong nước, ít độc) và NH3 (khí hòa tan, nồng độ tự do trong nước ao nếu vượt 0,05 mg/L sẽ gây nguy hiểm cho động vật thủy sinh). TAN có đơn vị mg/L.
Trong nước, ion NH4+ và NH3 tồn tại cân bằng: NH4+ ⇋ NH3 + H+ Ka = 10^-9,25
Tiến hành khảo sát pH của ao nuôi trong ngày có TAN cố định là 0,52 mg/L, kết quả thu được theo đồ thị sau:
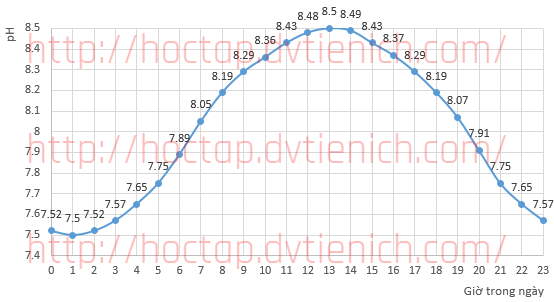
a) Để làm giảm TAN trong vụ mới, người ta hút cạn ao, thêm vôi bột rồi tiến hành “phơi ao” dưới ánh nắng.
b) Nồng độ NH3 vượt ngưỡng cho phép khoảng 8 giờ mỗi ngày
c) Nồng độ NH3 của ao nuôi trong ngày lớn nhất vào lúc 1 giờ.
d) Nồng độ TAN cao có thể gây nên hiện tượng phú dưỡng.
(Xem giải) Câu 14. Tiến hành thí nghiệm theo các bước sau:
• Bước 1: Cho vào 1 mL hexane (d = 0,660 g/mL) vào ống nghiệm (1) và 1 mL hex-1-ene (0,673 g/mL) vào ống nghiệm (2).
• Bước 2: Thêm vào mỗi ống 2 mL nước cất (d = 1,000 g/mL) lắc đều rồi để yên khoảng 2 phút.
• Bước 3: Thêm vào mỗi ống 1 mL Br2 lỏng (d = 3,100 g/mL), lắc đều rồi để yên khoảng 2 phút.
a) Sau bước 3, chất lỏng trong ống (2) tách thành hai lớp đều không màu.
b) Sau bước 3, chất lỏng trong ống (1) tách thành hai lớp, lớp phía trên không màu, còn lớp phía dưới có màu vàng đậm.
c) Sau bước 2, chất lỏng trong cả hai ống đều tách thành hai lớp, lớp trên là hydrocarbon, lớp dưới là nước.
d) Sau bước 3, sản phẩm hữu cơ thu được trong ống (2) có tên gọi là 1,2-dibromohexane.
(Xem giải) Câu 15. Tiến hành thí nghiệm: Phản ứng thủy phân cellulose trong môi trường acid theo các bước:
• Bước 1: Cho 10 mL dung dịch H2SO4 70% vào cốc thuỷ tinh, thêm một lượng nhỏ cellulose (bông) vào cốc và dùng đũa thủy tinh khuấy đều. Sau đó, đặt cốc thuỷ tinh vào cốc nước nóng và khuấy trong khoảng 3 phút để cellulose tan hết tạo dung dịch đồng nhất.
• Bước 2: Trung hoà dung dịch bằng cách thêm từ từ NaHCO3 đến khi dừng sủi bọt khí, sau đó thêm tiếp 5 mL dung dịch NaOH 10%.
• Bước 3: Cho 5 mL dung dịch thu được ở trên vào ống nghiệm chứa Cu(OH)2 (được điều chế bằng cách cho 0,5 mL dung dịch CuSO4 5% vào 2 mL dung dịch NaOH 10%, lắc nhẹ).
• Bước 4: Đun nóng đều ống nghiệm khoảng 2 phút, sau đó để ống nghiệm trên giá khoảng 3 phút.
a) Trong thí nghiệm trên, thay dung dịch H2SO4 70% bằng dung dịch H2SO4 98% thì hiện tượng thu được vẫn tương tự.
b) Ở bước 3, bước 4, các phản ứng xảy ra trong môi trường kiềm.
c) Phản ứng xảy ra ở bước 4 là phản ứng oxi hóa – khử.
d) Ở bước 2, khi dùng NaHCO3 sẽ xác định được thời điểm acid bị trung hòa hết chính xác hơn khi dùng NaOH.
(Xem giải) Câu 16. Một nhóm học sinh nghiên cứu về phương pháp chuẩn độ acid – base và nhận thấy: Khi chuẩn độ NaOH bằng HCl với chỉ thị phenolphthalein hoặc chuẩn độ Na2CO3 bằng HCl với chỉ thị methyl orange đều cho kết quả có độ chính xác cao. Nhóm học sinh đưa ra giả thuyết: “Có thể xác định được nồng độ NaOH và Na2CO3 trong dung dịch hỗn hợp của chúng bằng phương pháp chuẩn độ acid – base với các chỉ thị phenolphthalein và methyl orange với sai số không vượt quá 5%”. Để kiểm tra giả thuyết của mình, nhóm học sinh tiến hành như sau:
• Bước 1: Lấy 50,0 mL dung dịch chuẩn NaOH 1M và 10,0 mL dung dịch chuẩn Na2CO3 1M cho vào bình định mực 500 mL, thêm tiếp nước cất và lắc đều cho đến vạch định mức thu được dung dịch X. Cho dung dịch X vào chai polyethylene có nút kín
• Bước 2: Dùng pipette hút 10,0 mL dung dịch X cho vào bình tam giác dung tích 200 mL, thêm 10 mL nước cất sau đó thêm 3 giọt phenolphthalein. Dùng dung dịch chuẩn HCl 0,1M chuẩn độ đến dung dịch mất màu (CO32- chuyển hết sang HCO3-) thể tích dung dịch HCl tiêu tốn là V1 mL. Thêm tiếp vào bình tam giác 2 giọt methyl orange rồi tiếp tục chuẩn độ đến khi dung dịch ở bình tam giác chuyển từ màu vàng sang màu đỏ cam (HCO3- chuyển hết thành CO2), tổng thể tích dung dịch HCl tiêu tốn là V2 mL. Lặp lại quá trình chuẩn độ 3 lần, thu được giá trị V1, V2 trung bình lần lượt là 11,93 mL và 13,97 mL. (Biết phenolphthalein có màu hồng khi pH > 8,3 và không màu khi pH < 8,3; methyl orange có màu vàng khi pH > 4,4 và màu đỏ hoặc cam khi pH < 4,4)
a) Nếu cho chỉ thị methyl orange cùng với phenolphthalein vào bình tam giác ngay từ đầu thì không ảnh hưởng đến độ chính xác của phép chuẩn độ.
b) Nếu cho HCl 0,1M và methyl orange vào bình tam giác, dung dịch X vào burette rồi nhỏ từ từ dung dịch X vào dung dịch HCl đến khi dung dịch chuyển từ màu đỏ cam sang màu vàng, sau đó thêm phenolphthalein và tiếp tục chuẩn độ đến khi dung dịch chuyến sang màu đỏ. Dựa vào thể tích dung dịch X tiêu tốn thì vẫn xác định chính xác nồng độ NaOH và Na2CO3.
c) Trong phép chuẩn độ trên, xác định được nồng độ NaOH thấp hơn thực tế còn nồng độ Na2CO3 cao hơn thực tế.
d) Kết quả của thí nghiệm ủng hộ giả thuyết của nhóm học sinh.
PHẦN III (1,0 điểm). Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 17 đến câu 18.
(Xem giải) Câu 17. Một nhà máy sản xuất ammonia theo quy trinh Haber – Bosch với nguyên liệu ban đầu là hỗn hợp khí N2 và H2 (tỉ lệ 1 : 3 về thể tích) được nén đến 200 atm ở 25°C. Trước khi nạp vào buồng phản ứng, nguyên liệu cần được gia nhiệt lên 500°C. Khi quy trình hoạt động ổn định, lưu lượng nguyên liệu nạp vào buồng phản ứng không đổi là 10^6 mol/giờ. Trong buồng tổng hợp xảy ra phản ứng:
N2 + 3H2 ⇋ 2NH3 ![]() = -184 kJ
= -184 kJ
Biết mức độ chuyển hoá N2 mỗi lần đi qua buồng phản ứng là 15%. Hỗn hợp khí ra khỏi buồng phản ứng được làm lạnh xuống -20°C để ngưng tụ và tách NH3 lỏng. Phần N2 và H2 chưa phản ứng được dẫn trở lại và bổ sung nguyên liệu mới (để đủ 10^6 mol/giờ) và được gia nhiệt lên 500°C rồi lại nạp vào buồng phản ứng.
Biết năng lượng cần cung cấp để làm tăng nhiệt độ của 1 mol khí lên 1°C của N2 và H2 lần lượt là 29,1 (J/mol) và 28,8 (J/mol), 90% năng lượng tỏa ra từ phản ứng tổng hợp được dùng làm nóng nguyên liệu, phần năng lượng còn thiếu được cung cấp bằng phản ứng đốt cháy CH4. Khi đốt cháy 1 mol CH4 tỏa ra 802 kJ, 81% nhiệt lượng này được dùng để làm nóng nguyên liệu. Lượng CH4 cần đốt mỗi giờ là bao nhiêu kg? (làm tròn đến hàng đơn vị)
(Xem giải) Câu 18. Biodiesel (methyl ester của acid béo) là một loại nhiên liệu lỏng, thân thiện với môi trường so với diesel truyền thống. Biodiesel được sản xuất từ các loại chất béo rẻ tiền hoặc dầu ăn đã qua sử dụng. Một loại dầu thải có thành phần gồm:
| Chất | (C17H35COO)3C3H5 | (C17H33COO)3C3H5 | C17H35COOH | C17H33COOH | tạp chất trơ |
| % khối lượng | 28,391 | 56,576 | 5,254 | 8,037 | 1,742 |
Quá trình sản xuất biodiesel diễn ra qua hai giai đoạn chính:
1. Este hóa acid béo tự do: RCOOH + CH3OH ⇋ RCOOCH3 + H2O
2. Transester hóa triglyceride: (RCOO)3C3H5 + 3CH3OH ⇋ 3RCOOCH3 + C3H5(OH)3
Các acid béo tham gia phản ứng ester hóa với hiệu suất 91%, các triglyceride tham gia phản ứng transester hóa với hiệu suất 94%. Để sản xuất được 2000 kg biodiesel, cần dùng bao nhiêu kg dầu thải trên (làm tròn đến hàng đơn vị)?
B. TỰ LUẬN (12 điểm)
Câu I (3,0 điểm)
(Xem giải) I.1. Số hiệu nguyên tử của C, N, P, S lần lượt là 6, 7, 15, 16. Viết công thức theo mô hình VSEPR và cho biết dạng hình học của các phân tử: CO2, NO2, PCl3, SO3.
(Xem giải) I.2. Xét phản ứng nung vôi: CaCO3(s) → CaO(s) + CO2(g).
Biết các số liệu sau:
| Chất | CaCO3(s) | CaO(s) | CO2(g) |
| 92,9 | 38,2 | 213,7 | |
| -1206,9 | -635,1 | -393,5 |
a) Tính ![]() ,
, ![]() và
và ![]() .
.
b) Ở nhiệt độ nào thì phản ứng trên có thể tự xảy ra? Giả sử ΔrHº và ΔrSº không thay đổi theo nhiệt độ.
(Xem giải) I.3. Cho dung dịch acid yếu CH3COOH.
a) Trong dung dịch trên tồn tại cân bằng nào? (bỏ qua sự phân li của nước).
b) Khi:
+ Thêm NaOH rắn vào dung dịch.
+ Sục khí HCl vào dung dịch.
Cân bằng trên chuyển dịch theo chiều nào? Vì sao?
Câu II. (3,0 điểm)
(Xem giải) II.1. Viết phương trình hóa học của các phản ứng xảy ra trong các trường hợp sau:
a) Cho Cl2 tác dụng với dung dịch NaOH ở điều kiện thường.
b) Cho Cl2 tác dụng với dung dịch KOH đun nóng.
c) Hòa tan Au vào dung dịch hỗn hợp HNO3 và HCl tạo ra sản phẩm NO.
d) Nhiệt phân NH4NO3.
(Xem giải) II.2. Đốt cháy hoàn toàn 150,00 gam một mẫu nhiên liệu, tạo ra sản phẩm gồm CO2, SO2, H2O. Dẫn toàn bộ sản phẩm vào nước để SO2 hòa tan hoàn toàn thu được 500,0 mL dung dịch. Lấy 10,0 mL dung dịch này cho tác dụng vừa đủ với 18,75 mL dung dịch KMnO4 4,0.10^-3 mol/L. Biết SO2 tác dụng với dung dịch KMnO4 tạo ra sản phẩm gồm K2SO4, MnSO4 và H2SO4.
a) Tính phần trăm khối lượng sulfur có trong mẫu nhiên liệu trên.
b) Em hãy nêu các nguồn phát thải khí sulfur dioxide gây ô nhiễm môi trường.
(Xem giải) II.3. CuSO4.5H2O là một hóa chất thông dụng trong phòng thí nghiệm. Trong quá trình bảo quản, chúng thường hút ẩm. Để xác định lại hàm lượng phần trăm về khối lượng có trong mẫu hóa chất trên người ta tiến hành như sau:
• Bước 1: Cân chính xác 10,00 gam mẫu hóa chất ở trên cho vào bình định mức 250 mL, thêm một ít nước cất lắc đều cho tan hết rồi tiếp tục thêm nước cất đến vạch định mức.
• Bước 2: Lấy 10,0 mL dung dịch ở bước 1 cho vào bình tam giác 250 mL, thêm khoảng 5,0 mL dung dịch KI 10% (dư) thấy xuất hiện kết tủa và dung dịch chuyển sang màu nâu. Khi đó xảy ra phản ứng:
2CuSO4 + 4KI → 2CuI + I2 + K2SO4
• Bước 3: Lắc đều hỗn hợp, rồi chuẩn độ ngay với dung dịch Na2S2O3 theo phương trình:
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Đến khi phần dung dịch chuyển sang màu vàng nhạt, thêm vài giọt hồ tinh bột rồi tiếp tục chuẩn độ cho đến khi dung dịch vừa mất màu xanh. Lặp lại 3 lần thí nghiệm ở bước 2, bước 3, thể tích trung bình của dung dịch Na2S2O3 0,1M cần dùng là 14,73 mL. Các phản ứng ở bước 2, bước 3 xảy ra hoàn toàn.
a) Xác định hàm lượng % về khối lượng CuSO4 có trong mẫu hóa chất trên.
b) Lập kế hoạch (dự kiến dụng cụ, hóa chất) và trình bày cách pha chế 500 mL dung dịch CuSO4 1M từ loại hóa chất trên (hóa chất lấy chính xác đến phần nghìn gam).
Câu III: (3,5 điểm)
(Xem giải) III.1. Từ quả vanilla người ta phân lập được vanilline là một chất được sử dụng nhiều trong hương liệu, hóa dược, trung gian tổng hợp. Vanilline là hợp chất hữu cơ có 1 vòng benzene với 3 nhóm thế: -OH, -OCH3, -CHO (biết các nhóm -OCH3, -CHO lần lượt ở vị trí ortho, para so với nhóm -OH).
a) Viết công thức cấu tạo, xác định công thức phân tử của vanilline.
b) Viết phương trình hóa học của các phản ứng xảy ra khi:
+ Vanilline tác dụng với LiAlH4 (có thể viết dưới dạng sơ đồ) thu được vanillyl alcohol (nguyên liệu dược).
+ Vanilline tác dụng với KMnO4 trong H2SO4 loãng thu được vanilic acid (chất chống oxy hóa).
(Xem giải) III.2. Một hợp chất X được tách ra từ hạt cây guarana có thành phần phần trăm khối lượng nguyên tố như sau: %C = 49,484%, %H = 5,155%, %O = 16,495%, %N = 28,866%. Phân tích phổ khối (MS) cho thấy xuất hiện peak cực đại tại m/z = 194.
a) Xác định công thức phân tử của hợp chất X.
b) Trong phương pháp chiết lỏng – lỏng để tách X khỏi dung dịch nước, người ta dùng một dung môi hữu cơ (không tan trong nước, dễ hòa tan X). Ở trạng thái cân bằng, hệ số phân bố được định nghĩa: K = Ch/Cn
Trong đó:
– Ch: nồng độ chất X trong pha hữu cơ.
– Cn: nồng độ chất X trong pha nước.
Ở 25°C, độ tan bão hòa của X trong nước là 21,7 g/L. Người ta tiến hành chiết 200 mL dung dịch dung môi CH2Cl2 với hệ số phân bố K = 9,9.
+ Tính khối lượng X tối đa thu hồi được vào pha hữu cơ sau 1 lần chiết khi dùng 40 mL dung môi CH2Cl2.
+ Nếu muốn thu hồi 90% chất X từ pha nước vào pha hữu cơ bằng 1 lần chiết, cần dùng tối thiểu bao nhiêu mL CH2Cl2?
(Xem giải) III.3. Trong công nghiệp, dầu ăn sau khi sử dụng chiên rán nhiều lần thường chứa nhiều acid béo tự do, sản phẩm oxi hóa và cặn bẩn. Nếu thải bỏ trực tiếp sẽ gây ô nhiễm môi trường nghiêm trọng. Tuy nhiên, thành phần chính của dầu thải gồm triglyceride và acid béo tự do là những nguyên liệu có thể dùng để sản xuất xà phòng.
Vì vậy, việc tận dụng dầu thải để sản xuất xà phòng vừa góp phần xử lý chất thải, giảm tác động tiêu cực đến môi trường, vừa mang lại sản phẩm hữu ích.
Một loại dầu thải sau khi xử lý được dùng làm nguyên liệu sản xuất xà phòng, có thành phần: 77,6% triglyceride, 19,8% acid béo tự do, 2,6% tạp chất trơ. Kết quả phân tích mẫu dầu thải này thấy chỉ số xà phòng hóa là 187,4, chỉ số acid hóa là 39,8 (chỉ số acid hóa là số mg KOH cần để trung hòa hết lượng acid tự do có trong 1 gam chất béo, chỉ số xà phòng hóa là số mg KOH cần để trung hòa hết lượng acid tự do và phản ứng hết với lượng triglyceride có trong 1 gam chất béo). Khi xà phòng hóa loại dầu thải trên, các phản ứng đều đạt hiệu suất 100%.
a) Tính khối lượng NaOH để trung hòa lượng acid béo tự do có trong 1 kg nguyên liệu trên.
b) Tính phân tử khối trung bình của triglyceride trong nguyên liệu trên.
c) Tính khối lượng nguyên liệu cần để sản xuất 1000 kg xà phòng (chứa 70% muối sodium của acid béo). Tính khối lượng glycerol tối đa thu hồi được trong quá trình này.
(Xem giải) Câu IV: (1,0 điểm)
Một nhà máy nhiệt điện có lưu lượng khí thải trung bình là 100000 m³/giờ với tổng nồng độ NOx là 800 ppmv (nồng độ phần triệu theo thể tích), trong đó NO và NO2 lần lượt chiếm 80% và 20% về thể tích. Để đảm bảo theo quy định tổng nồng độ NOx thoát ra môi trường không quá 300 ppmv. Nhà máy đã áp dụng quy trình công nghệ khử chọn lọc xúc tác (SCR). NH3 được phun vào khí thải để khử NOx theo các phản ứng:
(1) Fast-SCR: NO + NO2 + 2NH3 → 2N2 + 3H2O
(2) Standard-SCR: 4NO + 4NH3 + O2 → 4N2 + 6H2O
Trong quy trình này, quá trình Fast-SCR xảy ra hoàn toàn sau đó mới xảy ra Standard-SCR với hiệu suất 92%.
a) Tính lưu lượng NO, NO2 (mol/giờ) trong khí thải chưa xử lí.
b) Tính lưu lượng NH3 tối thiểu (kg/giờ) cần dùng cho quá trình Fast-SCR và Standard-SCR để khử NOx về mức cho phép.
c) Người ta xác định được trong khí thải có 3% O2 (về thể tích), lượng O2 này có đủ để xử lí lượng NOx trong khí thải về mức cho phép hay không? Vì sao?
(Xem giải) Câu V: (1,5 điểm) Hydrocarbon X no, mạch hở có mạch carbon không phân nhánh là sản phẩm của quá trình chưng cất dầu mỏ. Từ phổ khối lượng xác định được phân tử khối của X là 114 amu.
a) Xác định công thức phân tử, công thức cấu tạo của X.
b) X được dùng làm nguyên liệu để tổng hợp các chất hữu cơ, viết các phương trình hóa học theo sơ đồ chuyển hóa sau (các chất hữu cơ viết dưới dạng công thức cấu tạo):
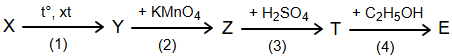
Biết reforming X thu được arene Y có công thức phân tử C8H10, E là o-C2H5OOC-C6H4-COOC2H5 được sử dụng làm thuốc trị ghẻ ngứa, côn trùng đốt.


cho mình hỏi tài liệu có tải được không
Câu xà phòng có trừ tạp chất không thầy ơi