[2025] Thi thử TN chuyên Gia Định – TP Hồ Chí Minh
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 158
⇒ Đề thi, đáp án và giải chi tiết:
| 1B | 2D | 3B | 4B | 5D | 6A | 7B | 8C | 9C |
| 10D | 11A | 12D | 13C | 14B | 15A | 16C | 17D | 18A |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | S | Đ | Đ | Đ | 5704 | 121 | 21,9 |
| (b) | Đ | S | Đ | S | 26 | 27 | 28 |
| (c) | S | Đ | Đ | Đ | 21 | 135 | 250 |
| (d) | Đ | Đ | S | S |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Khi xảy ra cháy xăng dầu, tuyệt đối không được dùng nước để dập lửa vì có thể khiến lửa lan rộng hơn. Thay vào đó, cần sử dụng bọt chữa cháy hoặc cát khô để dập tắt đám cháy. Cho các phát biểu sau:
(a) Xăng dầu nhẹ hơn nước nên sẽ nổi lên trên và tiếp tục cháy nếu dùng nước để dập lửa.
(b) Bọt chữa cháy có tác dụng cách ly nhiên liệu với không khí, giúp dập lửa hiệu quả.
(c) Lớp bọt cũng giúp ngăn chặn hơi xăng dầu thoát ra ngoài, giảm nguy cơ bắt lửa trở lại.
(d) Có thể sử dụng carbon dioxide thay cho bọt chữa cháy để dập tắt các đám cháy do xăng dầu.
Số phát biểu đúng là
A. 1. B. 4. C. 3. D. 2.
(Xem giải) Câu 2. Poly(vinyl chloride) (PVC) được điều chế từ phản ứng trùng hợp monomer nào sau đây?
A. CH2=CH2. B. CH3–CH2–Cl. C. CH2=CH–CH3. D. CH2=CH–Cl.
(Xem giải) Câu 3. Một thí nghiệm được mô tả như hình bên dưới:
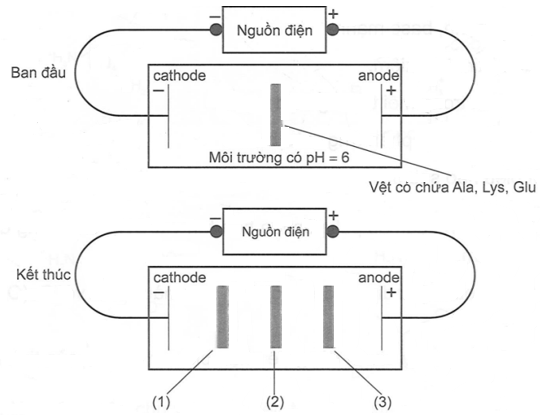
Giá trị pH mà khi đó amino acid có nồng độ ion lưỡng cực đạt cực đại gọi là điểm đẳng điện (pI). Mỗi amino acid có điểm đẳng điện khác nhau: alanine (pI = 6,0), lysine (pI = 9,74) và glutamic acid (pI = 3,08). Khi pH < pI thì amino acid tồn tại chủ yếu ở dạng cation, còn khi pH > pI thì amino acid đó tồn tại chủ yếu ở dạng anion.
Cho các nhận định sau:
(a) Thí nghiệm trên biểu diễn sự điện li của amino acid.
(b) Ion tồn tại chủ yếu của Lys là cation, sẽ di chuyển về cực âm của nguồn điện nên vệt (1) là cation của Lys.
(c) Ion tồn tại chủ yếu của Ala là ion lưỡng cực, không di chuyển nên vệt (2) là Ala.
(d) Ion tồn tại chủ yếu của Glu là anion, sẽ di chuyển về cực dương của nguồn điện nên vệt (3) là anion của Glu.
Các nhận định đúng là
A. (a), (b), (c). B. (b), (c), (d). C. (a), (b), (d). D. (a), (c), (d).
(Xem giải) Câu 4. Cho các cặp oxi hoá – khử và thế điện cực chuẩn tương ứng:
| Cặp oxi hoá – khử | Cu2+/Cu | Zn2+/Zn | Fe2+/Fe | Ag+/Ag |
| Thế điện cực chuẩn (V) | +0,34 | –0,762 | –0,44 | +0,799 |
Pin có sức điện động chuẩn lớn nhất là
A. Fe – Ag. B. Zn – Ag. C. Fe – Cu. D. Cu – Ag.
(Xem giải) Câu 5. Amine nào sau đây phản ứng được với nitrous acid ở nhiệt độ thấp tạo thành muối diazonium, một chất trung gian quan trọng trong tổng hợp hữu cơ?
A. Propylamine. B. Ethylamine. C. Methylamine. D. Aniline.
(Xem giải) Câu 6. Vanilin là hợp chất thiên nhiên, được sử dụng rộng rãi với chức năng phụ gia bổ sung hương thơm trong các loại đồ ăn, đồ uống, bánh kẹo, nước hoa,… Vanilin có cấu tạo như sau:
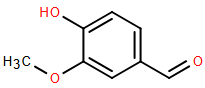
Phát biểu nào sau đây sai về vanilin?
A. Phân tử vanilin có chứa nhóm chức alcohol.
B. Vanilin có công thức phân tử C8H8O3.
C. Vanilin thuộc loại hợp chất hữu cơ tạp chức.
D. Phân tử vanilin có nhóm chức aldehyde.
(Xem giải) Câu 7. Các kim loại kiềm có khối lượng riêng nhỏ và độ cứng thấp hơn nhiều so với các kim loại khác. Nguyên nhân là do
(1) tinh thể có kiểu mạng lập phương tâm khối.
(2) chúng đều là các nguyên tố nhóm A
(3) có lực liên kết kim loại yếu.
A. (2) và (3). B. (1) và (3). C. (1) và (2). D. (1), (2) và (3).
(Xem giải) Câu 8. Phản ứng thuỷ phân 1-bromobutane bằng dung dịch NaOH có cơ chế được mô tả bằng sơ đồ sau:
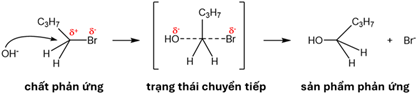
Nhận định nào sau đây không đúng?
A. Ở trạng thái chuyển tiếp, có sự phân cắt liên kết C–Br và sự hình thành liên kết C–O.
B. Trong phân tử 1-bromobutane, do độ âm điện của Br lớn hơn C nên liên kết bị phân cực về phía Br.
C. Phản ứng thuỷ phân 1-bromobutane là phản ứng tách nguyên tử halogen.
D. Oxi hóa hữu hạn alcohol tạo thành bằng CuO/t°, thu được sản phẩm làm mất màu nước bromine.
(Xem giải) Câu 9. Thạch cao được dùng để làm vách, trần thạch cao, tăng tính thẩm mĩ trong xây dựng. Trong lĩnh vực y tế, thạch cao được dùng để bó bột định hình xương. Thành phần chính của thạch cao là
A. CaO. B. Ca(OH)2. C. CaSO4.nH2O. D. CaCO3.
(Xem giải) Câu 10. Benzyl acetate là ester có mùi thơm của hoa nhài. Công thức của benzyl acetate là
A. C2H5COOC6H5. B. CH3COOC6H5. C. C6H5COOCH3. D. CH3COOCH2C6H5.
(Xem giải) Câu 11. Nguyên tố chlorine (Cl) có số hiệu nguyên tử là 17. Ở trạng thái cơ bản, cấu hình electron của ion Cl- là
A. 1s2 2s2 2p6 3s2 3p6. B. 1s2 2s2 2p6 3s2 3p5.
C. 1s2 2s2 2p6 3s2 3p4. D. 1s2 2s2 2p6 3s2 3p6 4s1.
(Xem giải) Câu 12. Cho peptide có cấu tạo như sau: H2NCH2CO-NHCH(CH3)CO-NHCH2COOH. Tên viết tắt của peptide là
A. Ala-Ala-Gly. B. Ala-Gly-Gly. C. Gly-Gly-Ala. D. Gly-Ala-Gly.
(Xem giải) Câu 13. Để làm mềm nước cứng vĩnh cửu, người ta có thể sử dụng hóa chất nào sau đây?
A. NaCl. B. HCl. C. Na3PO4. D. Ca(OH)2.
(Xem giải) Câu 14. Những vùng đất bị nhiễm phèn, do trong keo đất chứa nhiều ion Al3+, Fe3+ và NH4+, làm cho pH của đất thấp, cây lúa kém phát triển. Người ta thường dùng chất nào sau đây bón cho đất để tăng pH của đất?
A. NH4NO3 (viên nhỏ). B. CaO (bột). C. CaCO3 (bột). D. CaSO4 (bột).
(Xem giải) Câu 15. Maltose được cấu tạo từ
A. hai đơn vị glucose qua liên kết α-1,4-glycoside.
B. một đơn vị glucose và một đơn vị fructose qua liên kết α-1,4-glycoside.
C. hai đơn vị fructose qua liên kết β-1,4-glycoside.
D. một đơn vị glucose và một đơn vị fructose qua liên kết α-1,2-glycoside.
(Xem giải) Câu 16. Trong nước, thế điện cực chuẩn của kim loại M2+/M càng lớn thì dạng khử có tính khử …(1)… và dạng oxi hoá có tính oxi hoá …(2)… Cụm từ cần điền vào (1) và (2) lần lượt là
A. càng yếu; càng yếu. B. càng mạnh; càng mạnh. C. càng yếu; càng mạnh. D. càng mạnh; càng yếu.
(Xem giải) Câu 17. Nhận định nào sau đây sai?
A. Các ester đều tham gia phản ứng thủy phân. B. Các ester thường ít tan trong nước.
C. Các ester thường có mùi thơm đặc trưng. D. Các ester đều tồn tại ở thể lỏng.
(Xem giải) Câu 18. Để bảo vệ vỏ tàu biển làm bằng thép, người ta thường gắn vào vỏ tàu (phần chìm dưới nước) các khối kim loại nào sau đây?
A. Zn. B. Cu. C. Ag. D. Na.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Muối iron(III) chloride có màu nâu – đen. Khi hoà tan trong nước thu được dung dịch có màu vàng và môi trường acid. Màu sắc và môi trường được giải thích do sự tạo thành phức chất và sự thuỷ phân của phức chất trong nước. Một trong những lí giải được đưa ra là do các phản ứng sau:
FeCl3 + 6H2O(l) ⇋ [Fe(OH2)6]3+(aq) + 3Cl-(aq); (1)
[Fe(H2O)6]3+(aq) ⇋ [Fe(OH2)5(OH)]2+(aq) + H+(aq); (2)
a) [Fe(H2O)6]3+ là phức chất aqua và có 6 liên kết σ.
b) Các phức chất [Fe(OH2)6]3+ và [Fe(OH2)5(OH)]2+ đều là các phức chất bát diện.
c) Trạng thái oxi hoá của Fe trong phức chất [Fe(OH2)6]3+ và [Fe(OH2)5(OH)]2+ là khác nhau.
d) Khi thêm dung dịch HCl vào, cân bằng (2) chuyển dịch theo chiều nghịch.
(Xem giải) Câu 20. Một nhóm học sinh nghiên cứu về khả năng xúc tác của enzyme α-amylase tới quá trình thủy phân tinh bột. Trong thí nghiệm này, nhóm học sinh thực hiện thí nghiệm thủy phân tinh bột với enzyme α-amylase ở nhiệt độ và pH khác nhau. Kết quả được mô tả bằng hai đồ thị sau:
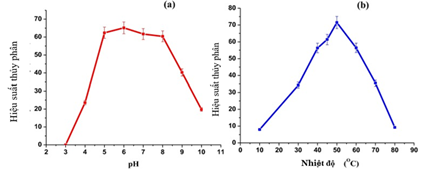
Từ hai đồ thị trên, nhóm học sinh đưa đến các nhận định về hoạt tính xúc tác của enzyme α-amylase tới quá trình thủy phân tinh bột ở các nhiệt độ và pH khác nhau.
a) Sau khi các phản ứng xảy ra, để nguội hỗn hợp sau phản ứng thì có thể dùng dung dịch iodine để đánh giá sự thủy phân của tinh bột trong các phản ứng trên.
b) Theo kết quả trên, dung dịch HCl 0,01 M tạo môi trường tốt nhất cho phản ứng thủy phân xảy ra.
c) Để hiệu suất thủy phân tinh bột xảy ra tốt nhất thì phản ứng cần được tiến hành ở môi trường có pH = 6 và nhiệt độ 50°C.
d) Khi nhiệt độ tăng trên 60°C, hoạt hoạt tính xúc tác của enzyme sẽ giảm xuống.
(Xem giải) Câu 21. Trong phòng thí nghiệm, ethyl acetate được điều chế từ acetic acid và ethanol, xúc tác H2SO4 đặc, theo mô hình thí nghiệm sau:
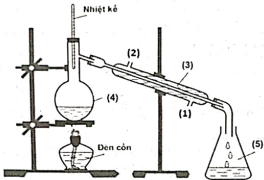
Biết nhiệt độ trong bình cầu (4) giữ ở mức 65-70°C, nhiệt độ trong ống sinh hàn (3) duy trì ở 25°C. Sau thí nghiệm, tiến hành phân tách sản phẩm. Ghi phổ hồng ngoại của acetic acid, ethanol và ethyl acetate. Cho biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng ngoại như sau:
| Liên kết | O–H (alcohol) | O–H (carboxylic acid) | C–O (ester, carboxylic acid) |
| Số sóng (cm-1) | 3650 – 3200 | 3300 – 2500 | 1780 – 1650 |
a) Vai trò của ống sinh hàn (3) để ngưng tụ hơi, nước sẽ vào ống sinh hàn từ vị trí (1) và ra khỏi ống ở vị trí (2).
b) Trong thí nghiệm trên, xảy ra phản ứng hóa học: CH3COOH + CH3CH2OH ⇋ CH3COOC2H5 + H2O.
c) Dựa vào phổ hồng ngoại, có thể phân biệt được acetic acid, ethanol và ethyl acetate.
d) Chất lỏng trong bình hứng (5) có methyl acetate.
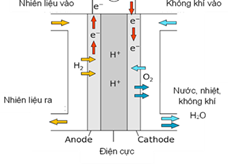
(Xem giải) Câu 22. Pin nhiên liệu là một loại pin điện hóa, sử dụng năng lượng của phản ứng hóa học chuyển hóa thành điện năng. Cấu tạo của một pin nhiên liệu hydrogen được mô tả như sau:
– Anode (cực âm) là nơi cung cấp dòng electron để sinh ra dòng điện. Khi nhiên liệu (khí H2) được đưa từ bên ngoài vào, khi gặp điện cực sẽ bị oxi hóa thành ion H+.
– Dòng electron di chuyển theo dây dẫn qua cathode (cực dương). Tại đây, O2 trong không khí sẽ phản ứng với H+ ở điện cực tạo thành H2O. Dòng electron di chuyển từ anode qua cathode tạo ra dòng điện trong pin.
– Sau phản ứng, pin nhiên liệu không sinh ra khí thải mà sinh ra nước, nước có thể được tái sử dụng hoặc sử dụng cho những mục đích khác.
Cho giá trị thế điện cực tiêu chuẩn của một số điện cực ở 25°C trong bảng sau:
| Phản ứng của điện cực | E° (Volt) | Phản ứng của điện cực | E° (Volt) |
| 2H2O + 2e → H2 + 2OH– | –0,414 | O2 + H2O + 4e → 4OH– | +0,40 |
| 2H+ + 2e → H2 | 0,00 | O2 + 4H+ + 4e → 2H2O | +1,23 |
(Cho biết: điện tích của 1 mol electron là 96500 C/mol; công thức: q = I.t, trong đó q là điện tích (C), I là cường độ dòng điện (A), t là thời gian (s)), công suất đầu ra P = U.I (W))
a) Phản ứng xảy ra tại cathode là 4H+ + O2 + 4e → 2H2O
b) Sức điện động chuẩn của pin là 0,43 V.
c) Một hệ thống pin nhiên liệu hydrogen được sử dụng để cung cấp năng lượng dự phòng cho một trạm viễn thông. Hệ thống này cần đảm bảo cung cấp một công suất điện ổn định là 5 kW. Điện áp đầu ra của khối pin nhiên liệu là 48 V. Hiệu suất tổng thể của pin nhiên liệu là 55%. Để duy trì hoạt động trong 24 giờ liên tục, hệ thống cần tiêu thụ 170 gam khí H2 (làm tròn kết quả đến hàng đơn vị).
d) Phản ứng xảy ra tại anode là 2H+ + 2e → H2.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Để sản xuất được 1 triệu chiếc chảo gang có hàm lượng sắt là 95% thì cần dùng tối thiểu x tấn quặng magnetite chứa 80% Fe3O4. Giả sử mỗi chiếc chảo nặng 3,2 kg và lượng sắt bị hao hụt trong quá trình là 8%. Giá trị của x là bao nhiêu (làm tròn kết quả đến hàng đơn vị)?
(Xem giải) Câu 24. Một loại dầu olive được phân tích thấy có chứa 11% tripalmitin; 84% triolein; 5% trilinolein, còn lại các chất khác không đáng kể (thành phần % về khối lượng). Tiến hành thí nghiệm xà phòng hóa 100 gam dầu olive trên bằng dung dịch chứa m1 gam NaOH (vừa đủ), sau khi các phản ứng xảy ra hoàn toàn, tách lấy toàn bộ muối, trộn với một số phụ gia thì thu được m2 gam xà phòng (có 96% muối). Tổng giá trị m1 + m2 là bao nhiêu (làm tròn kết quả đến hàng đơn vị)?
(Xem giải) Câu 25. Lysine là một amino acid thiết yếu, cơ thể con người không tự tổng hợp được mà phải bổ sung từ nguồn bên ngoài như thịt, cá, trứng, các sản phẩm từ sữa… Hãy cho biết thành phần phần trăm theo khối lượng của nguyên tố oxygen trong lysine là bao nhiêu (làm tròn kết quả đến hàng phần mười)?
(Xem giải) Câu 26. Cho rằng sự hòa tan của muối NH4NO3 vào trong nước gồm hai giai đoạn:
– Giai đoạn 1: Tinh thể NH4NO3 bị phá vỡ thành các ion, các ion được khuếch tán trong dung môi nước.
– Giai đoạn 2: Sự kết hợp giữa các ion và nước để tạo thành dung dịch đồng nhất (quá trình hydrate hóa).
Quá trình hòa tan này làm cho nước thay đổi nhiệt độ. Cho 56,56 gam muối NH4NO3 vào 1000 gam nước ở 25°C. Biết năng lượng phân li thành các ion của NH4NO3 là +646 kJ/mol, tổng năng lượng hydration của hai ion NH4+ và NO3- là -621 kJ/mol, nhiệt dung riêng của dung dịch (nhiệt lượng cần cung cấp để tăng nhiệt độ của 1 gam dung dịch lên 1°C) là 4,184 J/g.K. Sau quá trình hòa tan, nhiệt độ của dung dịch là a °C. Giá trị của a là bao nhiêu (làm tròn kết quả đến hàng đơn vị)?
(Xem giải) Câu 27. Cho các phát biểu sau:
(1) Saccharose, amylose và cellulose đều tham gia phản ứng thủy phân trong môi trường acid đun nóng.
(2) Tinh bột và cellulose đều có công thức là (C6H10O5)n và là đồng phân của nhau.
(3) Cellulose được tạo bởi các gốc β-glucose liên kết với nhau bởi liên kết β-1,4-glycoside.
(4) Có thể phân biệt glucose và fructose bằng thuốc thử Tollens.
(5) Khi lên men 1 tấn ngô chứa 65% tinh bột thu được thể tích ethyl alcohol 46° là 802 L. Biết khối lượng riêng của ethyl alcohol là 0,8 g/mL, hiệu suất cả quá trình là 80% (làm tròn kết quả đến hàng đơn vị).
Liệt kê các phát biểu đúng theo số thứ tự tăng dần.
(Xem giải) Câu 28. Một bạn học sinh đã đo độ cứng của một mẫu nước giếng khoan theo các bước sau:
– Bước 1: Đong chính xác 10 mL mẫu nước cho vào bình tam giác, thêm tiếp 1 mL dung dịch đệm (để duy trì pH ≈ 10), thêm 3 giọt chất chỉ thị “Eriochrome Black T”, được dung dịch có màu đỏ rượu vang.
– Bước 2: Cho dung dịch chứa muối của EDTA nồng độ 0,001 M (được ký hiệu là H2Y2–, là một chất có thể tạo hợp chất bền với ion Ca2+, Mg2+) vào burette. Tiến hành chuẩn độ mẫu nước ở bước 1 bằng dung dịch EDTA. Phản ứng trong quá trình chuẩn độ xảy ra như sau: (M là ký hiệu cho Ca, Mg)
M2+(aq) + H2Y2– (aq) → MY2– (aq) + 2H+(aq)
Tại điểm tương đương, dung dịch trong bình tam giác xuất hiện màu xanh da trời. Kết thúc quá trình chuẩn độ. Ghi lại thể tích EDTA đã dùng.
– Bước 3: Lặp lại quy trình chuẩn độ 3 lần, ghi nhận thể tích dung dịch EDTA đã dùng như sau:
| Thí nghiệm | Lần 1 | Lần 2 | Lần 3 |
| Vdd EDTA (mL) | 25,0 | 25,2 | 24,9 |
Độ cứng của nước có thể được quy đổi theo số mg CaCO3 trong 1 lít nước (ví dụ: nước có tổng nồng độ ion Ca2+ và Mg2+ là 2 mmol/L sẽ có độ cứng là 200 mg CaCO3/L). Từ thí nghiệm trên, bạn học sinh tính được độ cứng của mẫu nước trên là a (mg CaCO3/L). Hãy tính giá trị của a (làm tròn kết quả đến hàng đơn vị).

Bình luận