[2025] Thi thử TN sở GDĐT Lào Cai (Lần 1)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 069
⇒ Đề thi, đáp án và giải chi tiết:
| 1D | 2B | 3D | 4D | 5B | 6B | 7D | 8D | 9D |
| 10D | 11A | 12B | 13D | 14B | 15C | 16B | 17C | 18B |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | Đ | S | S | Đ | 2 | 170 | 18,1 |
| (b) | Đ | Đ | Đ | S | 26 | 27 | 28 |
| (c) | Đ | Đ | S | Đ | 2 | 34 | 10,2 |
| (d) | Đ | S | Đ | S |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Điện phân dung dịch CuSO4 với anode bằng đồng (anode tan) và điện phân dung dịch CuSO4 với anode bằng graphite (điện cực trơ) đều có đặc điểm chung là
A. ở anode xảy ra sự khử: 2H2O → O2 + 4H+ + 4e.
B. ở cathode xảy ra sự oxi hoá: 2H2O + 2e → 2OH– + H2.
C. ở anode xảy ra sự oxi hoá: Cu → Cu2+ + 2e.
D. ở cathode xảy ra sự khử: Cu2+ + 2e → Cu.
(Xem giải) Câu 2. Để kiểm tra sự có mặt của một số cation kim loại có trong dung dịch ta tiến hành thí nghiệm sau: Cho khoảng 4-6 giọt dung dịch NaOH vào ống nghiệm chứa khoảng 1 mL dung dịch cần xác định cation trong muối, thấy có kết tủa màu nâu đỏ xuất hiện ngay. Trong dung dịch này chứa cation nào sau đây?
A. Cu2+. B. Fe3+. C. Cr2+. D. Fe2+.
(Xem giải) Câu 3. Chất béo X (có cấu tạo như sau) là thành phần chính trong một loại dầu thực vật:
CH2-OOC(CH2)14CH3
|
CH-OOC(CH2)7CH=CH(CH2)7CH3
|
CH2-OOC(CH2)7CH=CHCH2CH=CH(CH2)4CH3.
Cho các phát biểu sau:
a) Thủy phân X trong môi trường acid sẽ thu được acid béo omega-6.
b) Ở điều kiện thường, X ở trạng thái lỏng.
c) Khi hydrogen hóa hoàn toàn X thu được chất béo có tên gọi là tristearin.
d) Công thức phân tử của X là C55H100O6.
Những phát biểu nào đúng?
A. (a), (c) và (d). B. (a), (b) và (c). C. (b), (c) và (d). D. (a), (b) và (d).
(Xem giải) Câu 4. Theo QCVN 01-1:2018/BYT, hàm lượng sắt tối đa cho phép trong nước sinh hoạt là 0,3 mg/L. Một mẫu nước có hàm lượng sắt tồn tại ở dạng Fe2(SO4)3 và FeSO4 với tỉ lệ mol tương ứng là 1 : 8. Để đánh giá hàm lượng sắt trong mẫu nước trên người ta tiến hành tách loại sắt trong 10 m³ mẫu nước bằng cách sử dụng 122,1 gam vôi tôi (vừa đủ) để tăng pH, sau đó sục không khí:
Fe2(SO4)3 + Ca(OH)2 → Fe(OH)3 + CaSO4 (1)
FeSO4 + Ca(OH)2 + O2 + H2O → Fe(OH)3 + CaSO4 (2)
Giả thiết vôi tôi chỉ chứa Ca(OH)2. Hàm lượng sắt cao gấp bao nhiêu lần so với ngưỡng cho phép?
A. 25. B. 34. C. 18. D. 28.
(Xem giải) Câu 5. Trong nước, thế điện cực chuẩn của kim loại Mn+/M càng nhỏ thì dạng khử có tính khử …(I)… và dạng oxi hoá có tính oxi hoá …(II)….Các cụm từ cần điền vào (I) và (II) lần lượt là
A. càng yếu và càng yếu. B. càng mạnh và càng yếu.
C. càng mạnh và càng mạnh. D. càng yếu và càng mạnh.
(Xem giải) Câu 6. Nhỏ vài giọt nước bromine vào ống nghiệm chứa aniline, hiện tượng quan sát được là
A. xuất hiện màu tím. B. có kết tủa màu trắng.
C. có bọt khí thoát ra. D. xuất hiện màu xanh.
(Xem giải) Câu 7. Carbohydrate nào dưới đây không có nhóm -OH hemiacetal (hoặc hemiketal)?
A. Glucose. B. Fructose. C. Maltose. D. Saccharose.
(Xem giải) Câu 8. Lỗ rỗng của viên than tổ ong càng nhiều thì than sẽ cháy nhanh hơn. Yếu tố nào đã làm tăng tốc độ cháy của viên than tổ ong?
A. Nồng độ. B. nhiệt độ.
C. Áp suất. D. Diện tích bề mặt tiếp xúc.
(Xem giải) Câu 9. Tiến hành thí nghiệm theo các bước sau:
• Bước 1: Chuẩn bị hai ống nghiệm, ống (1) chứa 2 mL dung dịch CaCl2, ống (2) chứa 2 mL dung dịch BaCl2 1M.
• Bước 2: Nhỏ đồng thời vào mỗi ống nghiệm 3 giọt dung dịch CuSO4 1 M, thấy ống (1) xuất hiện kết tủa chậm hơn và ít hơn so với ống (2).
Nhận định nào sau đây đúng khi so sánh CaSO4 với BaSO4?
A. Khó thuỷ phân hơn. B. Khó nhiệt phân hơn.
C. Dễ kết tủa hơn. D. Dễ tan hơn.
(Xem giải) Câu 10. X là Isopropyl formate là một ester có trong cà phê Arabica. Công thức cấu tạo của X là
A. HCOOCH3. B. HCOOCH2CH2CH3 C. HOOCCH(CH3)2. D. HCOOCH(CH3)2.
(Xem giải) Câu 11. Trong dung dịch, dạng tồn tại của mỗi amino acid tùy thuộc vào giá trị pH của dung dịch đó. Giá trị pH mà khi đó amino acid tồn tại chủ yếu ở dạng ion lưỡng cực (nồng độ ion lưỡng cực là cực đại) được gọi là điểm đẳng điện (pI). Khi pH > pI thì amino acid tồn tại chủ yếu ở dạng anion, pH < pI thì amino acid tồn tại chủ yếu ở dạng cation. Khi đặt dung dịch amino acid trong một điện trường thì dạng lưỡng cực không di chuyển về phía điện cực nào cả (nằm giữa hai điện cực), dạng anion sẽ di chuyển về phía cực dương còn dạng cation sẽ di chuyển về phía cực âm. Cho hai amino acid sau: H2N(CH2)4CH(NH2)COOH (Lysine); HOOC(CH2)2CH(NH2)COOH (Glutamic acid). Một nhóm học sinh nghiên cứu về tính điện di của glutamic acid (pI = 3,2) và lysine (pI = 9,7) rồi đưa ra kết luận:
(a) Khi pH = 1 thì glutamic acid và lysine đều di chuyển về cực âm.
(b) Khi pH = 13 thì glutamic acid tồn tại chủ yếu dạng anion -OOC-CH2-CH2-CH(NH2)-COO- và di chuyển về phía cực dương.
(c) Khi pH = 6 thì glutamic acid di chuyển về phía cực âm còn lysine di chuyển về phía cực dương.
(d) Có thể tách được glutamic acid và lysine ra khỏi hỗn hợp trong dung dịch ở pH = 6 bằng phương pháp điện di.
Số kết luận đúng là
A. 3. B. 2. C. 1. D. 4.
(Xem giải) Câu 12. Với xúc tác của các ion kim loại trong khói bụi, các oxide của sulfur và nitrogen bị oxi hóa bởi oxygen, ozone, hydrogen peroxide, gốc tự do,… rồi hòa tan vào nước mưa tạo thành các acid tương ứng. Hai acid chính tạo thành từ quá trình trên là
A. H2S và H2SO4. B. H2SO4 và HNO3. C. H2S và HNO3. D. H2CO3 và HNO3.
(Xem giải) Câu 13. Phương trình hoá học thuỷ phân 2-bromo-2-methylpropane trong NaOH là (CH3)3CBr + NaOH → (CH3)3COH + NaBr
Phản ứng trên diễn ra theo 2 giai đoạn được mô tả như sau:
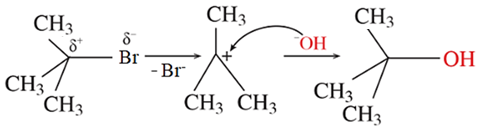
Nhận định nào sau đây đúng?
A. Trong giai đoạn (1) do độ âm điện C lớn hơn Br nên liên kết phân cực về phía Br.
B. Phản ứng thuỷ phân 2-bromo-2-methylpropane là phản ứng tách nguyên tử halogen.
C. Dẫn xuất 2-bromo-2-methylpropane là dẫn xuất halogen bậc 4.
D. Trong giai đoạn (2) có sự hình thành liên kết σ.
(Xem giải) Câu 14. Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện?
A. Na. B. Fe. C. Mg. D. Al.
(Xem giải) Câu 15. Hai chất nào sau đều được dùng để làm mềm nước có tính cứng vĩnh cửu?
A. Na2CO3 và Ca(OH)2. B. NaCl và Ca(OH)2.
C. Na2CO3 và Na3PO4. D. Na2CO3 và HCl.
(Xem giải) Câu 16. Diêm tiêu được dùng chế tạo thuốc nổ đen (làm mìn phá đá), làm phân bón (cung cấp nguyên tố N và K cho cây trồng) có công thức hoá học là
A. K2SO4. B. KNO3. C. K2CO3. D. KCl.
(Xem giải) Câu 17. Nổ bụi là vụ nổ gây ra bởi quá trình bốc cháy nhanh của các hạt bụi mịn phân tán trong không khí bên trong một không gian hạn chế, tạo ra sóng nổ. Nổ bụi xảy ra khi có đủ năm yếu tố: nguồn oxygen, nguồn nhiệt, nhiên liệu (bụi có thể cháy được), nồng độ bụi mịn đủ lớn và không gian đủ kín. Năm 2007, một vụ nổ bụi xảy ra khi các công nhân hàn bảo trì bể chứa bột mì tại phân xưởng sản xuất bột mì ở tỉnh Bình Dương khiến 5 công nhân bị bỏng nặng. Cho các phát biểu sau:
(a) Nổ bụi là một vụ nổ vật lí.
(b) Vụ nổ bụi xảy ra khi có đủ các yếu tố nguồn oxygen, nguồn nhiệt, không gian đủ kín.
(c) Nhiên liệu trong vụ nổ bụi tại phân xưởng bột mì ở Bình Dương là bụi bột mì.
(d) Bụi càng mịn khả năng gây nổ càng cao do phát tán nhanh và dễ lơ lửng trong không khí.
Các phát biểu đúng là
A. (b), (d). B. (a), (b), (c), (d).
C. (c), (d). D. (a), (c), (d).
(Xem giải) Câu 18. Trên hộp xốp cách nhiệt, hộp đựng thức ăn mang về, cốc, chén đĩa dùng một lần,… thường được in kí hiệu như hình bên.

Polymer dùng làm các đồ dùng đó được tổng hợp từ monomer nào sau đây?
A. CH2=CHCl. B. CH2=CHC6H5 C. CH2=CHCH3. D. CH2=CH2.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Aspirin là một hợp chất được sử dụng làm giảm đau, hạ sốt. Sau khi uống, aspirin bị thủy phân trong cơ thể sẽ tạo thành acid salicylic. Salicylic acid ức chế quá trình sinh tổng hợp prostaglandin (chất gây đau, sốt và viêm khi nồng độ trong máu cao hơn mức bình thường).
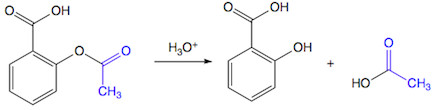
a) Do là phản ứng thuận nghịch nên thu được hỗn hợp phản ứng luôn có chất ban đầu và sản phẩm, do có nhóm -OH nên các chất trong phản ứng đều tạo được liên kết hydrogen với nước.
b) Với những chất trong phản ứng trên, hợp chất tạp chức là aspirin và salicylic acid.
c) Công thức phân tử của aspirin là C9H8O4.
d) Nếu xét phản ứng thủy phân trên nhờ xúc tác acid thì quá trình thủy phân aspirin ở dạ dày thuận lợi hơn so với ở trong máu của người bình thường.
(Xem giải) Câu 20. Đất chua là đất có độ pH dưới 6,5. Khi đất chua, các khoáng sét trong đất bị phá vỡ, giải phóng ra các ion Al3+ tự do gây bất lợi cho cây trồng. Nếu đất chua nhiều, ion Al3+ di động cao có thể gây độc cho hệ rễ cây, làm cho rễ bị bó và chùn lại không phát triển. Muốn sản xuất được trên nền đất này cần phải cải thiện độ chua đất trước khi gieo trồng. Một nông nhân đã làm thí nghiệm xác định độ pH của đất trồng của mình như sau: Lấy một lượng đất cho vào nước vừa lọc lấy phần dung dịch dùng máy pH đo được giá trị pH là 3,602.
a) Nồng độ [H+] trong mẫu đất trên bằng khoảng 3.10-5M.
b) Mẫu đất trên có môi trường acid, thuộc loại đất chua.
c) Nếu bón tro thực vật (K2CO3) sẽ làm tăng giá trị pH của đất vì ion CO32- bị thuỷ phân tạo môi trường base.
d) Có thể cải tạo mẫu đất trên bằng cách bón đạm ammonium như NH4Cl.
(Xem giải) Câu 21. Saccharose octaacetate có công thức C28H38O19 hay (C2H3O2)8C12H14O3, là ester của acetic acid với saccharose. Saccharose octaacetate được dùng làm chất nhũ hoá, chất kháng nấm trong các chế phẩm thuộc lĩnh vực dược phẩm, mĩ phẩm. Cơ quan Quản lí Thực phẩm và Dược phẩm Mỹ (FDA) cho phép sử dụng saccharose octaacetate làm chất phụ gia thực phẩm, chất chống cắn móng tay và mút ngón tay ở trẻ do tính chất rất đắng của nó.
a) Phân tử khối của saccharose octaacetate là 686.
b) Để tổng hợp saccharose octaacetate theo phương pháp “Hoá học xanh” (green chemistry), người ta tiến hành ester hoá saccharose trong điều kiện chiếu xạ siêu âm (ultrasonic irradiation), cho 10 gam saccharose phản ứng với 30 mL acetic anhydride (D = 1,08 g/mL) với hiệu suất 75% thì thu được khối lượng saccharose octaacetate (làm tròn đến hàng phần mười) là 14,9 gam.
c) Trong phân tử saccharose octaacetate có 6 nhóm chức ester.
d) Saccharose octaacetate không độc nên được ứng dụng trong lĩnh vực dược phẩm, mỹ phẩm.
(Xem giải) Câu 22. Bộ phận quan trọng nhất của máy tạo nhịp tim là một hệ pin điện hóa lithium – iodine (gồm hai cặp oxi hóa khử Li+/Li và I2/2I-). Hai điện cực được đặt vào tim, phát sinh dòng điện nhỏ kích thích tim đập ổn định. Cho biết: E°Li+/Li = -3,04V; E°I2/2I- = +0,54V; Nguyên tử khối của Li = 6,9; điện tích của 1 mol electron là 96500 C/mol; q = I.t, trong đó q là điện tích (C), I là cường độ dòng điện (A), t là thời gian (s), 1 năm = 365 ngày.
a) Máy tạo nhịp tim có thể được đặt tạm thời hay vĩnh viễn trong cơ thể tùy theo tình trạng sức khỏe và các bệnh lý kèm theo của bệnh nhân.
b) Khi pin hoạt động Lithium đóng vai trò là anode, tại anode xảy ra quá trình khử.
c) Sức điện động chuẩn của pin E°pin = 3,58V.
d) Nếu pin tạo ra một dòng điện ổn định bằng 2,5.10^-5 (A) thì một pin được chế tạo bởi 0,5 gam lithium có thể hoạt động tối đa trong thời gian 8 năm.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Cho các chất sau: C15H31COONa; C15H31COOK; CH3[CH2]11OSO3Na; CH3[CH2]11C6H4SO3Na; C17H33COOK. Số chất là thành phần chính của chất giặt rửa tổng hợp?
(Xem giải) Câu 24. Một gói làm nóng thức ăn (FRH) được sử dụng trong quân đội chứa 8 gam hỗn hợp (Mg 90%, Fe 4%, NaCl 6% về khối lượng), khi tiếp xúc với nước sẽ xảy ra phản ứng: Mg(s) + 2H2O(l) → Mg(OH)2(s) + H2(g). Phản ứng này tỏa ra nhiều nhiệt và làm nóng phần thức ăn đi kèm. Nếu sử dụng gói FRH trên để làm nóng nước từ 25°C lên 100°C, thì lượng nước tối đa (theo mL) được làm nóng là bao nhiêu? (Làm tròn kết quả đến hàng đơn vị).
Cho biết:
– Ethalpy tạo thành chuẩn (kJ/mol) của Mg(OH)2(s) và H2O(l) lần lượt là –928,4 và –285,8.
– Nhiệt dung riêng của nước, C = 4,2 J/g/°C; Khối lượng riêng của nước là D = 1 g/cm³.
– Phần nước được làm nóng chỉ nhận được tối đa 50% lượng nhiệt tỏa ra.
– Lượng nhiệt mà nước nhận được để thay đổi Δt (°C) được tính theo công thức: Q = m.C.Δt
(Xem giải) Câu 25. Vàng (Au) đơn chất tồn tại trong tự nhiên chủ yếu ở dạng quặng với hàm lượng thấp. Trong công nghiệp, người ta thu hồi vàng bằng phương pháp cyanide, trong đó quặng vàng được nghiền mịn và hòa tách trong dung dịch KCN có mặt oxygen, giúp vàng tạo thành phức chất tan trong nước:
4Au(s) + 8KCN(aq) + O2(g) + 2H2O(l) → 4K[Au(CN)2](aq) + 4KOH(aq) (1)
Sau đó, vàng được tách ra khỏi dung dịch bằng phương pháp kết tủa với kẽm:
Zn(s) + 2K[Au(CN)2] (aq) → K2[Zn(CN)4](aq) + 2Au(s) (2)
Trong thực tế, quá trình thu hồi vàng không đạt hiệu suất 100% do tổn thất trong quá trình hòa tách và kết tủa. Giả sử hiệu suất chung của cả quá trình là 92%, hãy tính khối lượng vàng có thể thu hồi được từ 13 kg KCN theo chuỗi phản ứng trên. (Làm tròn kết quả đến hàng phần mười).
(Xem giải) Câu 26. Kim loại X tác dụng với H2SO4 loãng cho khí H2. Măṭ khác, oxide của X bị CO khử thành kim loại ở nhiệt độ cao. Có bao nhiêu kim loại trong số các kim loại sau: K, Zn, Cu, Fe, Mg, Ag, Al phù hợp với X?
(Xem giải) Câu 27. Để làm đậu phụ từ đậu tương, ban đầu người ta xay đậu tương với nước lọc và đun sôi. Sau đó, thêm nước chua vào dung dịch nước đậu tương đã được nấu chín, khi đó “óc đậu” sẽ bị kết tủa. Sau khi trải qua quá trình lọc, ép, chế biến, sẽ thu được thành phẩm đậu phụ. Nước chua có thể làm từ nước đậu phụ lên men hoặc giấm ăn. Để thu hồi đậu phụ nhanh và mịn, thay vì dùng nước chua để làm óc đậu, người ta có thể sử dụng thạch cao với hàm lượng an toàn sức khỏe là không quá 1 g /1 kg đậu phụ. Cho các nhận xét sau:
(1) Nước chua có tính acid nên làm protein trong nước đậu thủy phân tạo thành α-amino acid dạng rắn.
(2) Thành phần chính của thạch cao là calcium carbonate.
(3) Sự tạo thành ‘óc đậu’ từ nước đậu là quá trình đông tụ protein.
(4) Nếu hàm lượng thạch cao vượt ngưỡng 1 g /1 kg đậu phụ thì ảnh hưởng không tốt đến sức khỏe người tiêu dùng.
Viết các câu phát biểu đúng thành dãy số theo thứ tự tăng dần (ví dụ: 24, 134…)
(Xem giải) Câu 28. Hai nhà khoa học Charles Martin Hall và Paul L. T. Héroult đã phát minh ra phương pháp sản xuất nhôm bằng cách điện phân nóng chảy Al2O3, sử dụng điện cực làm bằng than chì. Trong quá trình điện phân, khí oxi (O2) sinh ra ở nhiệt độ cao phản ứng với carbon ở anode tạo thành một hỗn hợp khí X gồm 10% O2, 10% CO và 80% CO2 (theo thể tích). Để sản xuất 32,4 tấn nhôm, lượng than chì làm anode bị tiêu hao tối đa là m tấn. Giá trị của m là bao nhiêu ? (Làm tròn kết quả đến hàng phần mười)


dạ ad ơi, cái câu cuối đáp án bị sai rồi ạ, cái bước tìm x ad làm tròn quá nên lệch lắm luôn
Uh, do ad nhẩm sai chứ không phải làm tròn (ad tính 4 + 2 = 8). Đã cập nhật lại