[2025] Thi tốt nghiệp THPT (Đề 1)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 164
⇒ Đề thi, đáp án và giải chi tiết:
| 1B | 2D | 3D | 4D | 5B | 6A | 7B | 8C | 9A |
| 10D | 11B | 12A | 13B | 14D | 15D | 16D | 17B | 18B |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | Đ | S | S | Đ | 4 | 4 | 92,3 |
| (b) | S | Đ | S | S | 26 | 27 | 28 |
| (c) | S | Đ | Đ | S | 1,68 | 1,45 | 12,9 |
| (d) | S | S | Đ | Đ |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1: Ở điều kiện thường, kim loại nào sau đây tồn tại ở thể lỏng?
A. Ag. B. Hg. C. Al. D. Cu.
(Xem giải) Câu 2: Trong phức chất, số liên kết σ (sigma) tạo thành giữa một phối tử với nguyên tử trung tâm được gọi là dung lượng phối trí của phối tử đó. Cấu tạo của phức chất [Cu(OH2)6]2+ (hay [Cu(H2O)6]2+) được cho ở hình bên.
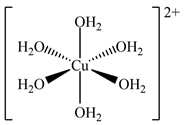
Dung lượng phối trí của mỗi phối tử H2O trong phức chất đã cho là
A. 2. B. 6. C. 3. D. 1.
(Xem giải) Câu 3: Trong phòng thí nghiệm, dung dịch chất nào sau đây phù hợp để kiểm tra sự có mặt của ion Ca2+(aq)?
A. HCl. B. NaNO3. C. NaCl. D. Na2CO3.
(Xem giải) Câu 4: Phản ứng điều chế ethanol từ ethene theo phương trình hoá học C2H4 + H2O (H3PO4, t°) → C2H5OH là phản ứng
A. hydrogen hoá. B. trùng ngưng. C. ester hoá. D. hydrate hoá.
(Xem giải) Câu 5: Từ phổ khối lượng, phân tử khối của ester X được xác định là 88. Công thức phù hợp với X là
A. C5H11OH. B. CH3COOC2H5. C. C3H7COOH. D. HCOOC2H5.
(Xem giải) Câu 6: Tên gọi theo danh pháp thay thế của chất có công thức cấu tạo CH3NH2 là
A. methanamine. B. ethylamine. C. methylamine. D. ethanamine.
(Xem giải) Câu 7: Trong phản ứng tách kim loại Cu từ CuSO4 theo phương trình hoá học Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s), phương pháp tách kim loại nào sau đây đã được áp dụng?
A. Nhiệt luyện. B. Thủy luyện.
C. Điện phân nóng chảy. D. Điện phân dung dịch.
(Xem giải) Câu 8: Cho các phát biểu sau về tính chất của methylamine:
(a) Methylamine làm giấy quỳ tím ẩm hoá đỏ.
(b) Methylamine phản ứng được với HCl trong dung dịch.
(c) Methylamine không phản ứng được với dung dịch FeCl3 ở điều kiện thường.
(d) Dung dịch methylamine phản ứng được với Cu(OH)2.
Số phát biểu đúng là
A. 4. B. 3. C. 2. D. 1.
(Xem giải) Câu 9: Cho thế điện cực chuẩn của Ag+/Ag và Zn2+/Zn lần lượt là E°1 = +0,799V và E°2 = -0,763V. Sức điện động chuẩn của pin Galvani (E°pin) tạo bởi hai cặp oxi hoá – khử Ag+/Ag và Zn2+/Zn được tính theo công thức nào sau đây?
A. E°pin = E°1 – E°2. B. E°pin = E°1 + E°2
C. E°pin = -E°2 – E°1. D. E°pin = E°2 – E°1
(Xem giải) Câu 10: Phát biểu nào sau đây về fructose không đúng?
A. Fructose có công thức phân tử C6H12O6.
B. Fructose phản ứng được với Cu(OH)2 trong môi trường kiềm ở điều kiện thường.
C. Fructose thuộc loại monosaccharide.
D. Fructose làm mất màu nước bromine ở điều kiện thường.
(Xem giải) Câu 11: Cho phản ứng thuận nghịch sau: H2(g) + I2(g) ⇋ 2HI(g). Ở trạng thái cân bằng, nồng độ (mol/L) của H2(g), I2(g) và HI(g) được kí hiệu lần lượt là [H2], [I2] và [HI]. Biểu thức hằng số cân bằng Kc của phản ứng là
A. Kc = [H2][2]/[HI]. B. Kc = [HI]²/[H2][I2].
C. Kc = [H2][2]/[HI]². D. Kc= [HI]/[H2][I2].
(Xem giải) Câu 12: Số lượng phối tử trong phức chất [Co(NH3)6]3+ là
A. 6. B. 7. C. 3. D. 1.
(Xem giải) Câu 13: Trong các phản ứng hữu cơ thường có sự tạo thành các tiểu phân trung gian hoạt động như gốc tự do, carbanion, carbocation. Carbocation là ion mang điện tích dương trên nguyên tử carbon. Có bao nhiêu carbocation trong số các tiểu phân (CH3)3C⁺, (CH3)2C⁻H, •CH3 và (CH3)2C⁺H?
A. 3. B. 2. C. 1. D. 4.
(Xem giải) Câu 14: “…(1)… là những hợp chất hữu cơ trong phân tử có nhóm hydroxy liên kết với nguyên tử carbon no”. Nội dung phù hợp trong chỗ trống (1) là
A. Ketone. B. Phenol. C. Aldehyde. D. Alcohol.
(Xem giải) Câu 15: Nhiệt tạo thành chuẩn (![]() ) của MgCO3(s), MgO(s) và CO2(g) lần lượt là –1096,0 kJ/mol; –602,0 kJ/mol và –393,5 kJ/mol. Biến thiên enthalpy chuẩn (
) của MgCO3(s), MgO(s) và CO2(g) lần lượt là –1096,0 kJ/mol; –602,0 kJ/mol và –393,5 kJ/mol. Biến thiên enthalpy chuẩn (![]() ) của phản ứng MgCO3(s) → MgO(s) + CO2(g) là bao nhiêu?
) của phản ứng MgCO3(s) → MgO(s) + CO2(g) là bao nhiêu?
A. -100,5 kJ. B. -494,0 kJ. C. +494,0 kJ. D.+100,5 kJ.
(Xem giải) Câu 16: Silicon (Si) là chất bán dẫn quan trọng, được sử dụng rộng rãi trong chế tạo các vi mạch và thiết bị điện tử. Ở trạng thái cơ bản, cấu hình electron của nguyên tử Si (số hiệu nguyên tử bằng 14)
A. 1s2 2s2 2p6 3s2 3p1. B. 1s2 2s2 2p6 3s3 3p1.
C. 1s2 2s2 2p6 3p2 3s2. D. 1s2 2s2 2p6 3s2 3p2.
Sử dụng thông tin cho dưới đây để trả lời các câu số 17 – 18:
Các công trình làm bằng thép (hợp kim của Fe và C) dễ bị ăn mòn điện hoả khi tiếp xúc với nước biển. Một trong số các phương pháp bảo vệ các công trình bằng thép khỏi sự ăn mòn điện hoá là gắn các khối nhôm (aluminium, Al) hoặc kẽm (zinc, Zn) hoặc hợp kim của chúng vào phần chìm dưới nước biển của các công trình đó.
(Xem giải) Câu 17: Cho các phát biểu sau về ăn mòn điện hoá và phương pháp bảo vệ đối với các công trình bằng thép nêu trên:
(a) Các khối nhôm hoặc khối kẽm bảo vệ thép theo phương pháp điện hoá.
(b) Khi thép bị ăn mòn điện hoá, sắt trong thép bị oxi hoá.
(c) Thép bị ăn mòn điện hoá mà không cần tiếp xúc với dung dịch chất điện li.
(d) Khi bảo vệ thép theo phương pháp điện hoá, nhôm hoặc kẽm đóng vai trò là cathode nên bị ăn mòn trước.
Số phát biểu đúng
A. 3. B. 2. C. 1. D. 4.
(Xem giải) Câu 18: Cho biết thế điện cực chuẩn của Na+/Na và Fe2+/Fe lần lượt là –2,713V và –0,440V. Khi thảo luận về phương pháp bảo vệ các công trình bằng thép nêu trên khỏi sự ăn mòn điện hoá, một học sinh đề xuất: “Có thể sử dụng khối kim loại natri (sodium, Na) thay thế cho các khối nhôm hoặc kẽm để bảo vệ các công trình bằng thép đó”. Một số nhận định đồng tình và không đồng tình với đề xuất này được đưa ra như sau:
(1) Có thể sử dụng khối kim loại natri do kim loại này có tính khử mạnh hơn sắt.
(2) Có thể sử dụng khối kim loại natri do kim loại này và nhôm đều có khối lượng riêng nhỏ.
(3) Không thể sử dụng khối kim loại natri do kim loại này dễ phản ứng với nước biển.
(4) Không thể sử dụng khối kim loại natri do kim loại này có tính khử yếu hơn sắt.
Nhận định đúng là
A. nhận định (4). B. nhận định (3). C. nhận định (2). D. nhận định (1).
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19: Tơ capron là loại tơ có tính dai, độ đàn hồi và độ bóng cao, ít thấm nước và được sử dụng để dệt vải may mặc. Tơ capron được tổng hợp từ caprolactam theo phương trình hoá học sau:
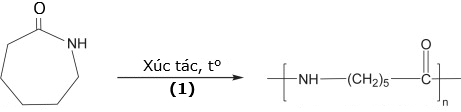
a) Trong phản ứng (1), các phân tử monomer bị mở vòng.
b) Tơ capron là tơ bán tổng hợp.
c) Do tơ capron và tơ nylon-6,6 đều có các nhóm -CO-NH- nên hai loại tơ này đều bền với dung dịch kiềm mạnh.
d) Do tơ capron có các nhóm -CO-NH- nên tơ capron là peptide.
(Xem giải) Câu 20: Một nhà máy sản xuất sodium hydroxide (NaOH) và chlorine (Cl2) bằng phương pháp điện phân dung dịch sodium chloride (NaCl) có màng ngăn với điện cực trơ theo phương trình hoá học sau:
2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + H2(g) + Cl2(g) (đpdd, có màng ngăn)
Sodium hydroxide rắn thu được bằng cách cô đặc rồi hạ nhiệt độ dung dịch chứa NaOH sau điện phân.
a) Trong quá trình điện phân, dung dịch ở khu vực cathode có pH < 7.
b) Màng ngăn giúp ngăn phản ứng giữa sodium hydroxide và chlorine trong quá trình điện phân.
c) Tại anode, khí chlorine thu được từ sự oxi hoá ion chloride.
d) Sodium hydroxide rắn thu được từ dung dịch chứa NaOH bằng phương pháp chiết.
(Xem giải) Câu 21: Trong phòng thí nghiệm, một nhóm học sinh tìm hiểu ảnh hưởng của thời gian lưu giữ tới nồng độ FeSO4 trong dung dịch. Giả thuyết của nhóm học sinh là: “Khi để lâu, nồng độ FeSO4 trong dung dịch giảm”. Nhóm học sinh chuẩn bị 250,0 mL dung dịch FeSO4 (nồng độ khoảng 0,1 M) đựng trong bình kín (dán nhãn bình là Y) và tiến hành các thí nghiệm ở hai thời điểm khác nhau như sau:
– Ngày thứ nhất:
• Bước 1: Lấy 10,00 mL dung dịch trong bình Y cho vào bình tam giác rồi thêm tiếp 5 mL dung dịch H2SO4 2 M.
• Bước 2: Chuẩn độ dung dịch trong bình tam giác bằng dung dịch KMnO4 2,20×10^-2 M đến khi xuất hiện màu hồng nhạt (bền trong khoảng 20 giây) thì dừng. Ghi lại thể tích dung dịch KMnO4 đã dùng.
Lặp lại thí nghiệm chuẩn độ thêm 2 lần. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 10,70 mL. Nồng độ của Fe(II) xác định được là C1 M.
– Ngày thứ tám:
Xác định lại hàm lượng Fe(II) của dung dịch chứa trong bình Y theo các bước tương tự như ngày thứ nhất. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 9,92 mL. Nồng độ của Fe(II) xác định được là C2 M.
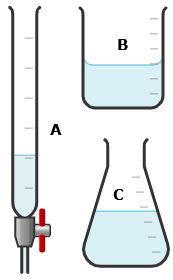
Nồng độ dung dịch KMnO4 như nhau trong các thí nghiệm chuẩn độ. Sự thay đổi nồng độ của Fe(II) (q%) được tính theo công thức: q% = (C1 – C2)/C1
a) Khi chuẩn độ, dung dịch KMnO4 được nhỏ trực tiếp vào bình tam giác từ dụng cụ kí hiệu là (B) được minh họa ở hình trên.
b) Giá trị của q là 7,9. (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến hàng phần mười).
c) Giá trị của C2 là 0,109. (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến hàng phần nghìn).
d) Kết quả thu được từ các thí nghiệm phù hợp với giả thuyết ban đầu của nhóm học sinh.
(Xem giải) Câu 22: Trong phòng thí nghiệm, benzoic acid được điều chế từ toluene theo sơ đồ gồm hai giai đoạn được đánh số (1) và (2) như sau:
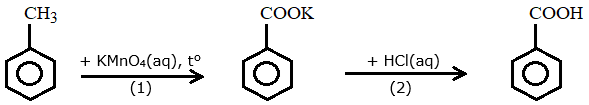
Trong một thí nghiệm tổng hợp benzoic acid theo sơ đồ trên, từ 2,0 mL toluene (khối lượng riêng bằng 0,867 g/mL) thu được 1,40 gam benzoic acid. Biết KMnO4 và HCl được lấy dư. Hiệu suất của quá trình tổng hợp benzoic acid từ toluene là h%. Cho biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng ngoại như sau:
| Liên kết | O-H (alcohol) | O-H (carboxylic acid) | C=O (ester, carboxylic acid) |
| Số sóng (cm-1) | 3650 – 3200 | 3300 – 2500 | 1780 – 1650 |
a) Giá trị của h là 60,9. (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến hàng phần mười).
b) Trong phản ứng với KMnO4(aq) ở giai đoạn (1), toluene đóng vai trò là chất oxi hoá.
c) Trên phổ hồng ngoại của benzoic acid, tín hiệu (peak) ở 1690 cm-1 đặc trưng cho liên kết O-H.
d) Trong phản ứng ở giai đoạn (2), anion C6H5COO- là một base theo thuyết Brønsted – Lowry.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23: Có bao nhiêu công thức cấu tạo của aldehyde ứng với công thức phân tử C5H10O?
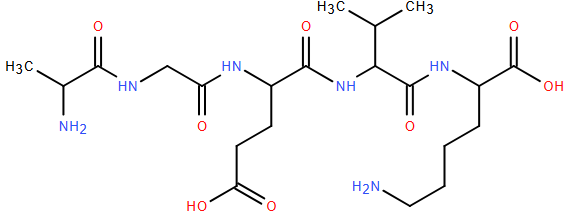
(Xem giải) Câu 24: Trong phân tử peptide cho dưới đây có bao nhiêu liên kết peptide?
(Xem giải) Câu 25: Phần trăm khối lượng carbon trong benzene là a%. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
(Xem giải) Câu 26: Lượng nhiệt tỏa ra khi đốt cháy hoàn toàn 1 gam nhiên liệu (kí hiệu là Q, tính theo kJ/g) được sử dụng để đánh giá mức độ “giàu năng lượng” của nhiên liệu đó. Ở điều kiện chuẩn, giá trị Q của ethanol lỏng và một loại khí đốt G lần lượt là QE và QG. Cho biết: G chỉ chứa propane và butane với tỉ lệ mol tương ứng là 1 : 2; nhiệt tạo thành chuẩn (![]() ) của các chất được cho trong bảng:
) của các chất được cho trong bảng:
| Chất | C2H5OH(l) | C3H8(g) | CH3(CH2)2CH3(g) | CO2(g) | H2O(l) | O2(g) |
| -277,6 | -105,0 | -129,0 | -393,5 | -285,8 | 0,0 |
Đặt k = QG/QE, giá trị của k bằng bao nhiêu? (Không làm tròn kết quả các phép tính trung gian, chỉ làm tròn kết quả cuối cùng đến hàng phần trăm).
(Xem giải) Câu 27: Luyện thép từ gang là quá trình làm giảm hàm lượng carbon và một số nguyên tố khác có trong gang. Một nhà máy luyện thép sử dụng loại gang nguyên liệu trong đó carbon chiếm 4,60% về khối lượng, còn lại là sắt (coi hàm lượng các nguyên tố khác không đáng kể). Khi tiến hành luyện thép, một lượng 2,88 tấn khí oxygen được thổi vào 45,0 tấn gang nguyên liệu nóng chảy để oxi hoá carbon thành CO và CO2. Hỗn hợp khí thu được chỉ gồm CO và CO2 có số mol bằng nhau. Phần trăm khối lượng carbon trong thép thu được là w%, còn lại là sắt. Coi sắt không bị mất đi trong quá trình luyện thép. Giá trị của w là bao nhiêu? (Không làm tròn kết quả các phép tính trung gian, chỉ làm tròn kết quả cuối đến hàng phần trăm).
(Xem giải) Câu 28: Oleum Z (H2SO4.nSO3) được tạo thành khi cho 100 kg dung dịch H2SO4 98% hấp thụ hoàn toàn 25 kg SO3. Phần trăm khối lượng SO3 trong Z là b%. Xác định giá trị của b. (Không làm tròn kết quả các phép tính trung gian, chỉ làm tròn kết quả cuối cùng đến hàng phần mười).

Bình luận