[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Quảng Bình
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề học sinh giỏi năm 2024-2025
⇒ Tổng hợp đề học sinh giỏi theo năm học
⇒ Mã đề 036-H12B năm 2024-2025
⇒ Thời gian làm bài: 140 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1A | 2D | 3B | 4D | 5D | 6D | 7D | 8B | 9D | 10D |
| 11C | 12C | 13C | 14A | 15D | 16B | 17D | 18B | 19A | 20A |
| 21C | 22C | 23C | 24A | 25C | 26A | 27C | 28A | 29B | 30B |
| 31B | 32D | 33D | 34A | 35C | 36C | 37C | 38C | 39A | 40A |
I. PHẦN TRẮC NGHIỆM (50 phút)
(Xem giải) Câu 1: Kim loại nào sau đây không tác dụng với nước ở nhiệt độ thường
A. Be. B. Na. C. K. D. Ba.
(Xem giải) Câu 2: Cắm 2 lá kim loại Zn và Cu nối với nhau bằng một sợi dây dẫn vào cốc thuỷ tinh. Rót dung dịch H2SO4 loãng vào cốc thuỷ tinh đó thấy khí H2 thoát ra từ lá Cu. Giải thích nào sau đây không đúng với thị nghiệm trên?
A. Zn bị ăn mòn điện hóa và sinh ra dòng điện.
B. Ở cực dương xảy ra phản ứng khử: 2H+ + 2e → H2.
C. Ở cực âm xảy ra phản ứng oxi hoá: Zn → Zn2+ + 2e.
D. Cu đã tác dụng với H2SO4 sinh ra H2.
(Xem giải) Câu 3: Công thức tổng quát của amine no, mạch hở có dạng là
A. CnH2n+3N. B. CnH2n+2+kNk. C. CnH2n+2-2a+kNk. D. CnH2n+1N.
(Xem giải) Câu 4: Chất nào sau đây không tạo được liên kết hydrogen giữa các phân tử
A. NH3. B. H2O. C. HF. D. CH4.
(Xem giải) Câu 5: Có bao nhiêu hợp chất đơn chức có công thức phân tử C4H8O2?
A. 2. B. 3. C. 4. D. 6.
(Xem giải) Câu 6: Phát biểu nào sau đây đúng?
A. Glucose bị thủy phân trong môi trường acid. B. Tinh bột là chất lỏng ở nhiệt độ thường.
C. Cellulose thuộc loại disaccharide. D. Dung dịch saccharose hòa tan được Cu(OH)2.
(Xem giải) Câu 7: Dạng ion chủ yếu nào của amino acid có trong môi trường acid mạnh (pH thấp)?
A. H2N-CH2-COO-. B. +H3N-CH2-COO-.
C. +H3N-CH(CH3)-COO- D. +H3N-CH(CH3)-COOH
(Xem giải) Câu 8: Dãy các chất nào dưới đây đều phản ứng được với Cu(OH)2 ở điều kiện thường?
A. Ethylene glycol, glycerol và ethyl alcohol. B. Glucose, glycerol và saccharose.
C. Glucose, glycerol và methyl acetate. D. Glycerol, glucose và ethyl acetate.
(Xem giải) Câu 9: Các nghiên cứu về cấu tạo cho biết glucose có một dạng mạch hở và hai dạng mạch vòng (α-glucose và β-glucose) chuyển hóa qua lại lẫn nhau như hình dưới:
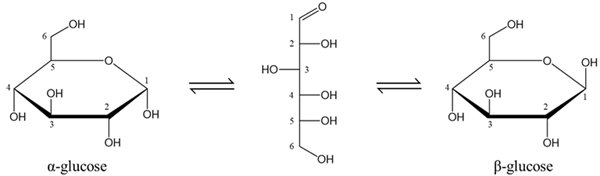
Phát biểu nào sau đây không đúng?
A. Ở dạng mạch hở, phân tử glucose có 5 nhóm hydroxy và 1 nhóm chức aldehyde.
B. Nhóm –OH ở vị trí carbon số 1 trong glucose dạng mạch vòng gọi là -OH hemiacetal.
C. Glucose làm mất màu dung dịch nước bromine.
D. Glucose có phản ứng hòa tan Cu(OH)2 ở điều kiện thường tạo dung dịch phức màu tím.
(Xem giải) Câu 10: Arylamine là hợp chất chứa nhóm amine liên kết trực tiếp với nguyên tử carbon của vòng benzene. Có bao nhiêu arylamine ứng với công thức phân tử C7H9N?
A. 3. B. 2. C. 5. D. 4.
(Xem giải) Câu 11: O-cresol có tên IUPAC là 2-methylphenol. Trong tự nhiên o-cresol được tìm thấy trong chiết xuất cặn than, dầu mỏ. Ngoài ra o-cresol là một thành phần của khói thuốc lá. Phát biểu nào sau đây không đúng?
A. O-cresol tác dụng được với Na
B. Công thức phân tử của o-cresol là C7H8O.
C. O-cresol tác dụng NaOH theo tỉ lệ mol 1 : 2.
D. Trong phân tử o-cresol có chứa 1 nhóm chức hydroxy.
(Xem giải) Câu 12: Chất X có công thức phân tử là C3H7O2N. X làm mất màu dung dịch bromine. CTCT của X là
A. H2NC2H4COOH. B. H2NCH2COOCH3.
C. CH2=CHCOONH4. D. CH3COOCH2NH2.
(Xem giải) Câu 13: Cho luồng khí CO dư qua hỗn hợp các oxide CuO, Fe2O3, Al2O3, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn thu được gồm
A. Cu, Fe, Al, Mg. B. Cu, FeO, Al2O3, MgO.
C. Cu, Fe, Al2O3, MgO. D. Cu, Fe, Al, MgO.
(Xem giải) Câu 14: Chất hữu cơ X có công thức phân tử là C3H9O2N. X tác dụng với NaOH đun nóng thu được muối Y có phân tử khối nhỏ hơn phân tử khối của X. X không thể là chất nào sau đây?
A. CH3CH2COONH4. B. CH3COONH3CH3.
C. HCOONH2(CH3)2. D. HCOONH3CH2CH3.
(Xem giải) Câu 15: Benzyl salicylate (HOC6H4COOCH2C6H5) được sử dụng làm chất cố định nước hoa, các sản phẩm khử mùi, kem chống nắng… Chất này được điều chế bằng phản ứng giữa salicylic acid (HOC6H4COOH) và benzyl alcohol (C6H5CH2OH). Nhận định nào sau đây đúng?
A. Benzyl salicylate tác dụng tối đa với NaOH trong dung dịch theo tỉ lệ mol 1 : 3.
B. Thuỷ phân benzyl salicylate trong dung dịch NaOH dư, đun nóng thu được 2 muối.
C. Benzyl salicylate là một ester đa chức.
D. Số liên kết π trong phân tử benzyl salicylate là 7.
(Xem giải) Câu 16: Thủy phân một tetrapeptide mạch hở X thu được 3 amino acid là Ala, Gly và Val. Phát biểu nào sau đây là đúng?
A. Công thức phân tử của X là C10H19N3O4.
B. Số liên kết peptide trong X là 3.
C. Có 6 công thức cấu tạo phù hợp với X.
D. Thủy phân hoàn toàn 1 mol X cần 3 mol HCl.
(Xem giải) Câu 17: X là isopropyl formate là một ester có trong cà phê Arabica; chất Y có công thức phân tử C4H6O4; biết rằng Y được tạo thành từ các chất alcohol bền và carboxylic acid đều chỉ có một loại nhóm chức. Trong các phát biểu sau đây:
(1) Công thức cấu tạo của X là HCOOCH(CH3)2.
(2) Có 3 đồng phân ester khác cùng công thức phân tử với X.
(3) Chất Y có hai công thức cấu tạo phù hợp.
(4) X và Y đều là ester no, mạch hở.
(5) Cả hai chất X, Y đều không thể tham gia phản ứng tráng bạc.
Số phát biểu đúng là
A. 3. B. 5. C. 4. D. 2.
(Xem giải) Câu 18: Thủy phân hoàn toàn ester X (chỉ chứa nhóm chức ester) trong dung dịch NaOH, thu được hỗn hợp các chất hữu cơ gồm: CH3COONa, NaOC6H4CH2OH và H2O. Công thức phân tử của X là
A. C9H10O3. B. C11H12O4. C. C10H12O4. D. C11H12O3.
(Xem giải) Câu 19: Cho các chất sau: ClH3NCH2COOH; H2NCH(CH3)CONHCH2COOH; (CH3NH3)2SO4; H2NCH2CONHCH2COOH; (CH3COO)2C2H4. Số chất khi tác dụng với dung dịch NaOH dư, đun nóng, thu được dung dịch chứa 2 muối là
A. 2. B. 1. C. 4. D. 3.
(Xem giải) Câu 20: Để hàn các vết đứt gãy trên đường ray xe lừa, người ta sử dụng hỗn hợp gồm Al và Fe2O3 theo tỉ lệ mol tương ứng 2 : 1. Khi tiến hành hàn đường ray bằng hỗn hợp trên xảy ra phản ứng hóa học:
2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s)
Biết nhiệt tạo thành chuẩn của Fe2O3(s) và Al2O3(s) lần lượt là -826 kJ/mol và -1666 kJ/mol, hiệu suất phản ủng đạt 95%. Nhiệt lượng tỏa ra (kJ) khi dùng 107 gam hỗn hợp trên là
A. 399. B. 798. C. 199. D. 420.
(Xem giải) Câu 21: Cho dãy các chất: phenylammonium chloride, benzyl chloride, isopropyl chloride, m-cresol, benzyl alcohol, sodium phenolate, allyl chloride. Số chất trong dãy tác dụng được với dung dịch NaOH loãng, đun nóng là
A. 2. B. 4. C. 5. D. 6.
(Xem giải) Câu 22: Cho các phát biểu sau về carbohydrate:
(a) Glucose và saccharose đều là chất rắn có vị ngọt, dễ tan trong nước.
(b) Tính bột và cellulose đều là polysaccharide.
(c) Trong dung dịch, glucose và saccharose đều hoà tan Cu(OH)2 tạo phức màu xanh lam.
(d) Khi đun nóng glucose (hoặc fructose) với dung dịch AgNO3 trong NH3 thu được Ag.
(e) Glucose và saccharose đều tác dụng với H2 (xúc tác Ni, đun nóng) tạo sorbitol.
Số phát biểu đúng là
A. 5. B. 2. C. 4. D. 3.
(Xem giải) Câu 23: Cho các polymer: poly(hexamethylene adipamide); amylose; capron; cellulose; polyethylene; poly(methyl methacrylate). Số polymer bị thuỷ phân trong môi trường acid là
A. 2. B. 4. C. 5. D. 6.
(Xem giải) Câu 24: Catechin là một chất kháng oxi hoá mạnh, ức chế hoạt động của các gốc tự do nên có khả năng phòng chống bệnh ung thư, nhồi máu cơ tim. Trong lá chè tươi, catechin chiếm khoảng 25 – 35% tổng trọng lượng khô. Công thức cấu tạo của catechin cho như hình bên.
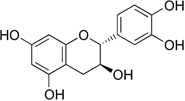
Phát biểu nào sau đây không đúng?
A. Phần trăm khối lượng của C trong catechin là 61,64%
B. Catechin có khả năng phòng chống các bệnh ung thư, tim mạch.
C. Công thức phân tử của catechin là C15H14O6.
D. Phân tử catechin có 4 nhóm -OH phenol.
(Xem giải) Câu 25: Tiến hành các thí nghiệm sau:
(a) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng.
(b) Đốt bột nhôm nguyên chất trong khí oxygen.
(c) Nhúng thanh gang (hợp kim sắt và carbon) vào dung dịch NaCl.
(d) Cho lá Zn vào dung dịch HCl.
(e) Nối một dây đồng với một dây sắt rồi để trong không khí ẩm.
Số thí nghiệm có xảy ra ăn mòn điện hóa là
A. 2. B. 5. C. 3. D. 4.
(Xem giải) Câu 26: Cho các phản ứng hóa học sau:
(a) Poly(vinyl acetate) bị thủy phân trong môi trường kiềm.
(b) Polyisoprene tham gia phản ứng cộng với hydrogen.
(c) Nhiệt phân polystyrene.
(d) Thủy phân cellulose trong môi trường acid.
(e) Quá trình lưu hóa cao su xảy ra khi đun nóng cao su với sulfur.
Số phản ứng giữ nguyên mạch polymer là bao nhiêu?
A. 2. B. 5. C. 3. D. 4.
(Xem giải) Câu 27: Hợp chất hữu cơ X (C5H11O2N) tác dụng với dung dịch NaOH dư, đun nóng thu được muối sodium của α-amino acid và alcohol. Số công thức cấu tạo của X là
A. 2. B. 4. C. 5. D. 6.
(Xem giải) Câu 28: Pin nhiên liệu được nghiên cứu rộng rãi nhằm thay thế nguồn nhiên liệu hóa thạch ngày càng cạn kiệt. Trong pin nhiên liệu, dòng điện được tạo ra do phản ứng oxi hóa nhiên liệu (hydrogen, carbon monoxide, methanol, ethanol, propane, …) bằng oxygen không khí. Trong pin propane – oxygen, phản ứng tổng cộng xảy ra khi pin hoạt động như sau:
C3H8 (g) + 5O2 (g) + 6OH- (aq) → 3CO32- (aq) + 7H2O (l)
Ở điều kiện chuẩn, khi đốt cháy hoàn toàn 1 mol propane theo phản ứng trên thì sinh ra một lượng năng lượng là 2497,66 kJ. Một bóng đèn LED công suất 20W được thắp sáng bằng pin nhiên liệu propane – oxygen. Biết hiệu suất quá trình oxi hóa propane là 80,0%; hiệu suất sử dụng năng lượng là 100% và trung bình cứ 1 giờ bóng đèn LED nói trên nếu được thắp sáng liên tục thì cần tiêu thụ hết một lượng năng lượng bằng 72,00 kJ. Thời gian bóng đèn được thắp sáng liên tục khi sử dụng 176 gam propane làm nhiên liệu ở điều kiện chuẩn là
A. 111,0 giờ. B. 138,7 giờ. C. 55,5 giờ. D. 69,4 giờ.
(Xem giải) Câu 29. Một pin điện hóa tạo bởi hai cặp oxi hóa – khử ở điều kiện chuẩn: Fe2+/Fe và Sn2+/Sn với thế điện cực chuẩn tương ứng là -0,44 V và -0,137 V.
Cho các phát biểu về pin điện hóa trên như sau:
(a) Anode của pin là Fe.
(b) Cathode của pin là Fe2+.
(c) Quá trình xảy ra ở anode khi pin hoạt động là: Fe2+ + 2e → Fe.
(d) Quá trình xảy ra ở cathode khi pin hoạt động là: Sn2+ + 2e → Sn.
(đ) Sức điện động chuẩn của pin là 0,203 V.
Số phát biểu đúng là
A. 4. B. 2. C. 3. D. 1.
(Xem giải) Câu 30: Cho sơ đồ phản ứng:
(a) X + H2O (xúc tác, t°) → Y
(b) Y + 2[Ag(NH3)2]OH → HOCH2[CHOH]4COONH4 + 2Ag + 3NH3 + H2O
(c) Y (xúc tác) → E + Z
(d) Z + H2O (ánh sáng, chất diệp lục) → X + G
X, Y và Z lần lượt là
A. tinh bột, glucose và ethyl alcohol. B. tinh bột, glucose và carbon dioxide.
C. cellulose, fructose và carbon dioxide. D. cellulose, glucose và carbon dioxide.
(Xem giải) Câu 31: Tiến hành các thí nghiệm sau:
(a) Cho kim loại Mg (dư) vào dung dịch Fe2(SO4)3.
(b) Dẫn khí H2 dư qua bột CuO nung nóng.
(c) Cho kim loại K vào dung dịch CuSO4 dư.
(d) Cho Al vào dung dịch Fe2(SO4)3 dư.
(e) Điện phân dung dịch AgNO3 với điện cực trơ.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 32: Hợp chất hữu cơ X (C8H15O4N) tác dụng với dung dịch NaOH dư, đun nóng, thu được sản phẩm hữu cơ gồm muối disodium glutamate và alcohol. Số công thức cấu tạo của X là
A. 2. B. 4. C. 5. D. 6.
(Xem giải) Câu 33: Một trong các phương pháp dùng để loại bỏ sắt trong nguồn nước nhiễm sắt là sử dụng lượng vôi tôi vừa đủ để tăng pH của nước nhằm kết tủa ion sắt khi có mặt oxi, theo sơ đồ phản ứng
(1) Fe3+ + OH- → Fe(OH)3
(2) Fe2+ + OH- + O2 + H2O → Fe(OH)3
Một mẫu nước có hàm lượng sắt cao gấp 28 lần so với ngưỡng cho phép là 0,30 mg/l (theo QCVN 01-1:2018/BYT). Giả thiết sắt trong mẫu nước trên chỉ tồn tại ở hai dạng là Fe3+ và Fe2+ với tỉ lệ mol Fe3+ : Fe2+ = 1 : 4. Cần tối thiểu m gam Ca(OH)2 để kết tủa hoàn toàn lượng sắt trong 10 m³ mẫu nước trên. Giá trị của m là
A. 155,4. B. 222,0. C. 288,6. D. 122,1.
(Xem giải) Câu 34: Một mẫu nước thải của nhà máy sản xuất X có pH = 4. Để thải ra ngoài môi trường theo đúng qui định thì cần phải điều chỉnh pH nằm trong khoảng từ 6,5 đến 7,5 nên nhà máy thường sử dụng vôi sống để xử lí. Khối lượng vôi sống cần dùng cho 1m³ nước để nâng pH của nước thải từ 4 lên 7 là (Giả thiết chỉ xảy ra phản ứng giữa ion H+ và OH- cũng như bỏ qua sự thủy phân của các muối nếu có)
A. 2,80 gam. B. 5,60 gam. C. 0,28 gam. D. 0,56 gam.
(Xem giải) Câu 35: Ester mạch hở E có công thức phân tử C10H14O6. Cho E tác dụng với dung dịch NaOH, thu được alcohol X và hai muối Y, Z của hai carboxylic acid đơn chức (MY < MZ, đều không tác dụng với thuốc thử Tollens). Cho các phát biểu sau:
(a) Có hai công thức cấu tạo thỏa mãn tính chất của E.
(b) Chất Y làm mất màu dung dịch bromine.
(c) 1 mol E tác dụng được tối đa 1 mol H2.
(d) Y tác dụng với HBr chỉ thu được một sản phẩm.
(e) Dung dịch X hòa tan được Cu(OH)2 tạo dung dịch xanh lam.
Số phát biểu đúng là
A. 2. B. 5. C. 3. D. 4.
(Xem giải) Câu 36: Cho 20 gam CuO tác dụng vừa đủ với dung dịch H2SO4 25% đun nóng, sau đó làm nguội dung dịch đến 10°C. Khối lượng tinh thể CuSO4.5H2O đã tách ra khỏi dung dịch là (Biết rằng ở 10°C cứ 100 gam H2O hòa tan 14,4 gam CuSO4).
A. 50 gam. B. 34,33 gam. C. 48,91 gam. D. 22,5 gam.
(Xem giải) Câu 37: Cho 10,08 gam hỗn hợp X gồm Fe3O4 và Cu vào dung dịch HCl thu được dung dịch Y chứa hai chất tan và còn lại 4,16 gam chất rắn. Cho dung dịch AgNO3 dư vào dung dịch Y thu được m gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 26,32. B. 28,27. C. 29,44. D. 22,96.
(Xem giải) Câu 38: Thực hiện các thí nghiệm sau:
(a) Cho x mol Fe vào dung dịch chứa 2,5x mol AgNO3.
(b) Nhỏ dung dịch chứa a mol KHSO4 vào cốc đựng dung dịch chứa a mol NaHCO3.
(c) Nhỏ dung dịch chứa a mol Ba(HCO3)2 vào cốc đựng dung dịch chứa 3a mol NaOH.
(d) Hòa tan hỗn hợp gồm Na2O và Al (tỉ lệ mol 1 : 1) vào cốc đựng nước dư.
(e) Đun nóng dung dịch gồm NaHCO3 và CaCl2 (tỉ lệ mol 2 : 1) đến phản ứng hoàn toàn.
Số thí nghiệm thu được dung dịch chỉ chứa hai chất tan có số mol bằng nhau là
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 39: Rutin là hợp chất hữu cơ có trong nụ hoa hòe, nó có tác dụng làm giảm các chứng suy giảm tĩnh mạch, giảm cholesterol trong máu. Ngoài ra rutin còn được dùng để điều chế thuốc quercetin có tác dụng chống oxy hóa mạnh, kháng viêm, chống dị ứng, ngăn ngừa tế bào ung thư. Công thức cấu tạo của rutin (bên trái) và quercetin (bên phải) như hình dưới đây:
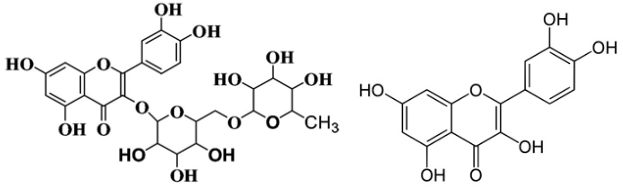
Trong môi trường acid, một phân tử rutin phản ứng với hai phân tử nước thu được sản phẩm gồm quercetin, glucose và rhamnose. Cho các phát biểu sau:
a) Công thức phân tử của rhamnose C5H10O5.
b) Để sản xuất 1 triệu viên thuốc (mỗi viên có khối lượng 500 mg, chứa 96,64% quercetin về khối lượng) cần 4009,74 kg bột hoa hòe. (Biết hàm lượng rutin trong bột hoa hòe là 30,20%, phần còn lại không tạo ra quercetin; hiệu suất toàn bộ quá trình sản xuất đạt 80%).
c) Phân tử quercetin có 5 nhóm -OH phenol.
d) Đốt cháy hoàn toàn 1 mol rutin thu được 27 mol CO2 và 15 mol H2O.
e) Công thức phân tử của quercetin là C15H10O7.
Số phát biểu đúng là
A. 2. B. 5. C. 3. D. 4
(Xem giải) Câu 40: Trên bao bì một loại phân bón NPK có ghi độ dinh dưỡng là 20-20-15, Để cung cấp 135,780 kg nitrogen, 15,500 kg phosphorus và 33,545 kg potassium cho 10000 m² đất trồng thì người nông dân cần trộn đồng thời phân NPK (ở trên) với đạm urea (độ dinh dưỡng là 46%) và phân kali (độ dinh dưỡng là 60%). Giả sử mỗi m² đất trồng đều được bón với lượng phân như nhau. Nếu người nông dân sử dụng 83,7 kg phân bón vừa trộn trên thì diện tích đất trồng được bán phân là bao nhiêu m²?
A. 2000. B. 3000. C. 4185. D. 1000.
II. PHẦN TỰ LUẬN (90 phút):
Câu 1. (2,0 điểm)
(Xem giải) 1. Viết phương trình hóa học của các phản ứng xảy ra dưới dạng công thức cấu tạo thu gọn:
a. Glucose + thuốc thử Tollens
b. CH3COOCH2CHClCH3 + dung dịch KOH dư
c. Trùng hợp caprolactam
d. N,N-dimethylpropan-1-amine + dung dịch HCl dư
e. Butanone + I2 + NaOH
(Xem giải) 2. Các chất A, B, C đều mạch hở, không phân nhánh, chỉ chứa một loại nhóm chức, có cùng công thức phân tử (C2H3O)n và số nguyên tử carbon nhỏ hơn 6. Xác định công thức cấu tạo thu gọn của A, B, C và viết các phương trình hóa học xảy ra. Biết:
– A, B cùng loại nhóm chức.
– A tác dụng được với dung dịch NaOH và Na; B có đồng phân hình học.
– C phản ứng với thuốc thử Tollens nhưng không phản ứng với dung dịch NaOH.
(Xem giải) 3. Hợp chất X chứa 46,67% iron còn lại là sulfur. Hoàn thành các phản ứng sau, ghi rõ điều kiện phản ứng (nếu có)
X + O2 → Y + …
Y + Br2 + Z → T + …
Mg + T → L + Z + …
L + O2 → M + Z
M + O2 → Y
Y + KMnO4 + Z →
L + Y →
Y + NO2 →
Câu 2. (1,0 điểm)
(Xem giải) 1. Viết dạng công thức theo mô hình VSEPR và dự đoán dạng hình học của các phân tử: CS2; SO2; BH3; SOBг2.
(Xem giải) 2. Ở trạng thái cơ bản, nguyên tử nguyên tố R có tổng số electron trên các phân lớp s bằng 7. Viết cấu hình electron của nguyên tử nguyên tố R và xác định vị trí (số thứ tự, chu kì, nhóm) của R trong bảng tuần hoàn.
Câu 3. (1,0 điểm)
(Xem giải) 1. X là hợp chất đơn chức, mạch không phân nhánh, công thức phân tử có dạng CnH2nO2. Phổ khối và phổ IR của X như sau:
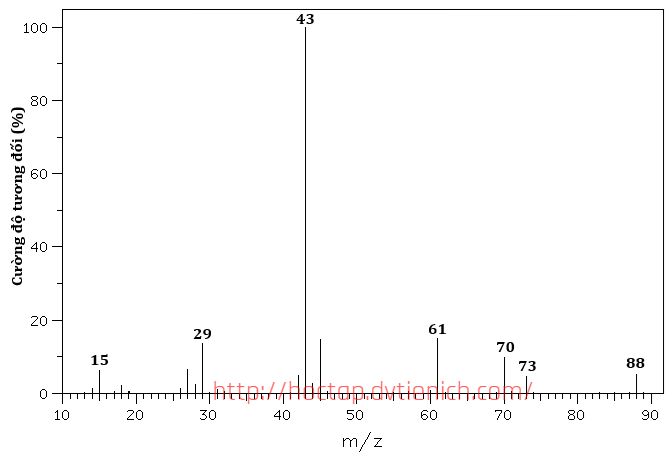

Bảng đối chiếu tín hiệu phổ hồng ngoại (IR) của các nhóm chức
| Hợp chất | Liên kết | Số sóng | Hợp chất | Liên kết | Số sóng |
| Alcohol | O-H | 3500-3200 | Carboxylic acid | C=O | 1760-1690 |
| Aldehyde | C-H | 2830-2695 | O-H | 3300-2500 | |
| C=O | 1740-1685 | Ester | C=O | 1750-1715 | |
| Ketone | C=O | 1715-1666 | C-O | 1300-1000 |
– Xác định công thức phân tử của X.
– Viết công thức cấu tạo của X. Giải thích ngắn gọn.
(Xem giải) 2. Cho các phản ứng:
X (C7H8O5) + 2NaOH → Y + Z + T
Y + 2 [Ag(NH3)2]OH → C2H4NO4Na + 2Ag + 3NH3 + H2O
Z + HCl → C3H6O3 + NaCl
T + Br2 + H2O → C2H4O2 + 2G
Xác định công thức cấu tạo của các chất X, Y, Z, T và viết các phương trình phản ứng trên. Biết X không phân nhánh.
Câu 4. (1,0 điểm)
(Xem giải) 1. Một pin điện hóa được thiết lập bởi một điện cực Zn nhúng trong dung dịch Zn(NO3)2 0,25M và một điện cực Ag nhúng trong dung dịch AgNO3 0,15M (ở 25°C).
a. Lập sơ đồ pin, viết quá trình oxi hóa, quá trình khử xảy ra ở mỗi điện cực và phương trình hóa học của phản ứng xảy ra trong pin.
b. Tính suất điện động của pin.
c. Tính hằng số cân bằng của phản ứng.
Cho E°Zn2+/Zn = -0,76V; E°Ag+/Ag = 0,8V.
(Xem giải) 2. Nồng độ tối đa cho phép của PO43- theo tiêu chuẩn nước ăn uống của WHO là 0,35 mg/lít. Để đánh giá sự nhiễm bẩn của nước máy sinh hoạt ở một thành phố, người ta lấy 5,0 lít nước đó cho tác dụng với dung dịch BaCl2 dư thì tạo ra 3,606.10^-3 gam kết tủa. Xác định nồng độ PO43- trong nước máy và xem xét có vượt quá giới hạn cho phép hay không?
Câu 5. (1,0 điểm)
(Xem giải) 1. Hỗn hợp E gồm chất X (C3H11N3O6) và Y (C4H12N2O6). Cho 38,65 gam E tác dụng tối đa với 0,83 mol KOH, thu được chất hữu cơ Z đa chức, bậc một và dung dịch T. Cô cạn T thu được m gam chất rắn khan.
a. Xác định công thức cấu tạo của X, Y và viết phương trình hóa học của các phản ứng xảy ra.
b. Tính giá trị của m.
(Xem giải) 2. Một loại xăng chứa 5% C2H5OH về thể tích (D = 0,8 g/mL), 95% còn lại là hỗn hợp X gồm C8H18 và C7H16 (có tỉ lệ mol tương ứng là 95 : 5; DX = 0,69 g/mL). Khi đốt cháy hoàn toàn 1 mol C2H5OH tỏa ra lượng nhiệt là 1365 kJ, 1 mol C8H18 tỏa ra lượng nhiệt là 5460 kJ và 1 mol C7H16 tỏa ra lượng nhiệt là 4825 kJ. Trung bình chiếc xe máy tay ga của chị A di chuyển được 1 km thì cần nhiệt lượng chuyển thành công cơ học là 250 kJ. Tính quãng đường xe di chuyển được khi dùng hết 110.000 đồng tiền xăng đổ cho xe máy của chị A. Biết hiệu suất sử dụng nhiên liệu của động cơ là 40%, giá xăng 22.000 đồng/lít.

Bình luận