[2025] Thi thử TN cụm trường Vĩnh Phúc – Tuyên Quang
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 155
⇒ Đề thi, đáp án và giải chi tiết:
| 1D | 2B | 3D | 4B | 5A | 6A | 7A | 8A | 9A |
| 10B | 11A | 12B | 13C | 14C | 15B | 16D | 17A | 18D |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | S | Đ | Đ | Đ | 1234 | 6 | 25,5 |
| (b) | Đ | S | Đ | Đ | 26 | 27 | 28 |
| (c) | Đ | S | Đ | Đ | 4 | 38 | 91,8 |
| (d) | Đ | Đ | Đ | S |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Tinh bột là nguồn cung cấp năng lượng chủ yếu cho con người. Giả sử 1 gam tinh bột có thể cung cấp 17 kJ và năng lượng từ tinh bột chiếm khoảng 60% tổng năng lượng thức ăn. Mỗi ngày, một học sinh cần năng lượng 9180 kJ thì nên ăn bao nhiêu gam tinh bột cho phù hợp?
A. 675 gam. B. 450 gam. C. 540 gam. D. 324 gam.
(Xem giải) Câu 2. Hydrogen sulfide (H2S) là một chất khí không màu, mùi trứng thối, độc. Theo tài liệu của Cơ quan Quản lí an toàn và sức khoẻ nghề nghiệp Hoa Kì, nồng độ H2S khoảng 100 ppm gây kích thích màng phổi (không gây nguy hiểm đến tính mạng). Nồng độ khoảng 400 – 700 ppm, H2S gây nguy hiểm đến tính mạng chỉ trong 30 phút. Nồng độ trên 800 ppm gây mất ý thức và làm tử vong ngay lập tức. Một gian phòng trống (25°C; 1 bar) diện tích 24 m², cao 3m bị nhiễm 10,2 gam khí H2S. Dựa vào nồng độ ppm của H2S trong gian phòng trên, để đánh giá mức độ độc hại của H2S trong trường hợp này (Cho biết 1 mol khí ở 25°C và 1 bar có thể tích 24,79 L. Nồng độ ppm (parts per million – thành phần phần triệu) của H2S trong không khí là số lít khí H2S có trong 1000000 L không khí). Chỉ làm tròn kết quả cuối cùng đến hàng phần trăm.
A. 468,13 ppm, gây nguy hiểm đến tính mạng.
B. 103,29 ppm, không gây nguy hiểm đến tính mạng.
C. 268,62 ppm, không gây nguy hiểm đến tính mạng.
D. 450,35 ppm, gây nguy hiểm đến tính mạng.
(Xem giải) Câu 3. Một mẫu nước sinh hoạt chứa nhiều các ion: Ca2+, Mg2+, Cl-, SO42-. Mẫu nước này thuộc loại
A. nước có tính cứng toàn phần. B. nước mềm.
C. nước có tính cứng tạm thời. D. nước có tính cứng vĩnh cửu.
(Xem giải) Câu 4. Năng lượng hoạt hóa (kí hiệu Ea) là năng lượng tối thiểu mà các chất phản ứng cần phải có để phản ứng có thể xảy ra. Phương trình kinh nghiệm Arrhenius biểu diễn mối liên hệ giữa nhiệt độ, năng lượng hoạt hóa với hằng số tốc độ phản ứng: ![]() , trong đó:
, trong đó:
• k: hằng số tốc độ của phản ứng
• A: hằng số đặc trưng cho mỗi phản ứng
• e = 2,7183 (cơ số logarit tự nhiên)
• R: hằng số khí lí tưởng (R = 8,314 J/(mol.K))
• T: nhiệt độ theo thang Kelvin: T(K) = to (C) + 273
• Ea: năng lượng hoạt hóa, đơn vị J/mol
Cho các phát biểu sau:
(a) Năng lượng hoạt hóa càng lớn thì phản ứng càng dễ xảy ra.
(b) Khi nhiệt độ phản ứng càng cao thì tốc độ phản ứng càng lớn.
(c) Chất xúc tác làm giảm năng lượng hoạt hóa từ đó làm tăng tốc độ phản ứng.
(d) Nếu một phản ứng có hằng số tốc độ là 11 M-1.s-1 tại nhiệt độ 345 K và hằng số thực nghiệm Arrhenius (A) là 20 M-1.s-1 thì năng lượng hoạt hoá của phản ứng trên là 1418 J.mol-1.
Các phát biểu sai là
A. (c) và (d). B. (a) và (d). C. (b) và (c). D. (a) và (b).
(Xem giải) Câu 5. Đồ thị dưới đây biểu diễn kết quả thực nghiệm độ giảm khối lượng của tinh thể CuSO4.5H2O theo sự tăng dần nhiệt độ nung:
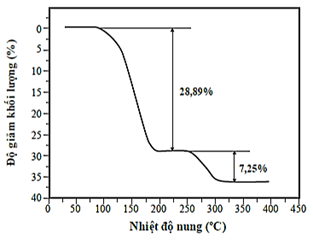
Từ kết quả thực nghiệm, công thức hóa học của muối thu được phù hợp nhất tại 220°C là
A. CuSO4.H2O B. CuSO4.3H2O C. CuSO4.2H2O D. CuSO4.4H2O
(Xem giải) Câu 6. Cấu hình electron ở phân lớp ngoài cùng của ion R+ là 2p6. Nguyên tử R là
A. Na. B. K. C. Ca. D. Ne.
(Xem giải) Câu 7. Phức chất pentacarbonyliron(II)) (hoặc iron pentacarbonyl) có công thức cấu tạo như hình bên.

Số liên kết cho – nhận mà nguyên tử trung tâm iron tạo được với các phối tử là
A. 5. B. 6. C. 3. D. 4.
(Xem giải) Câu 8. Chất ứng với công thức nào sau đây không phải là chất giặt rửa?
A. (CH3[CH2]14COO)3C3H5. B. CH3[CH2]10CH2OSO3Na.
C. CH3[CH2]16COOK. D. CH3[CH2]10CH2C6H4SO3Na.
(Xem giải) Câu 9. Một người có nguy cơ bị loét dạ dày do có nồng độ acid trong dạ dày cao hơn mức bình thường. Để trung hòa 100 ml acid hydrochloric có trong dạ dày cần dùng vừa đủ 0,042 gam sodium bicarbonate có trong viên nén thuốc trị bệnh dạ dày. Nồng độ acid có trong dạ dày người đó là
A. 0,005 M. B. 0,05 M. C. 0,02 M. D. 0,002 M.
(Xem giải) Câu 10. Trong đời sống, người ta dùng baking soda (là một hợp chất của sodium) để khử mùi hôi và tẩy trắng vết ố trên quần áo, vệ sinh đồ gia dụng… Baking soda có thành phần chính là
A. NaHSO3. B. NaHCO3. C. Na2CO3. D. Na2SO3.
(Xem giải) Câu 11. Loại polymer nào sau đây có chứa nguyên tố nitrogen?
A. Nylon-6,6. B. Polystyrene.
C. Poly(vinyl chloride). D. Polyisoprene.
(Xem giải) Câu 12. Carbohydrate nào dưới đây không có nhóm -OH hemiacetal hoặc hemiketal?
A. Maltose. B. Saccharose. C. Glucose. D. Fructose.
(Xem giải) Câu 13. Tên gọi của ester C2H5COOCH3 là
A. Methyl acetate. B. Ethyl acetate.
C. Methyl propionate. D. Ethyl formate.
(Xem giải) Câu 14. Chất nào sau đây thuộc loại amine bậc một?
A. CH3NHCH3. B. CH3CH2NHCH3. C. CH3NH2. D. (CH3)3N.
(Xem giải) Câu 15. Các hợp chất dễ tan của kim loại kiềm, kiềm thổ là thành phần cung cấp dinh dưỡng của nhiều loại phân bón hoá học phổ biến. Hợp chất nào sau đây dễ tan, là thành phần dinh dưỡng chính trong phân bón superphosphate?
A. CaSO4.2H2O. B. Ca(H2PO4)2. C. NaNO3. D. KCl.
(Xem giải) Câu 16. Phản ứng xảy ra trong acquy chì khi sạc điện là: 2PbSO4(s) + 2H2O(l) → Pb(s) + PbO2(s) + 2H2SO4(aq). Chất được sinh ra ở cực âm khi acquy chì sạc điện là
A. PbO2(s). B. H2O(l). C. PbSO4(s). D. Pb(s).
(Xem giải) Câu 17. Ứng dụng nào sau đây không phải của chất béo?
A. Nguyên liệu sản xuất cồn và giấm ăn.
B. Nguồn cung cấp và dự trữ năng lượng ở người và động vật.
C. Nguồn cung cấp acid béo thiết yếu cho cơ thể.
D. Nguyên liệu sản xuất xà phòng và glycerol.
(Xem giải) Câu 18. Một phản ứng hoá học có ![]() < 0. Phản ứng này thuộc loại phản ứng
< 0. Phản ứng này thuộc loại phản ứng
A. thu nhiệt. B. oxi hóa khử. C. phân hủy. D. tỏa nhiệt.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Aspartame ngọt hơn khoảng 200 lần so với đường ăn thông thường (saccharose/sucrose) và được sử dụng trong đồ uống và thực phẩm dành cho người ăn kiêng vì có ít calo hơn đường ăn thông thường. Aspartame có cấu tạo như hình vẽ.
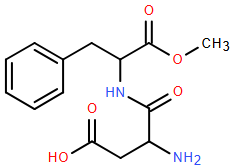
a) Aspartame là hợp chất hữu cơ tạp chức chứa đồng thời 4 loại nhóm chức ester, amine, carboxylic acid và ketone.
b) Công thức phân tử của Aspartame C14H18N2O5.
c) Trong dung dịch, a mol Aspartame có thể phản ứng tối đa với 3a mol NaOH.
d) Liên kết -CO-NH- trong phân tử Aspartame được gọi là liên kết peptide.
(Xem giải) Câu 20. Trong các sản phẩm lẩu tự sôi, cơm tự sôi,… có “gói tạo nhiệt” chứa CaO. Khi cho “gói tạo nhiệt” vào nước thì CaO sẽ phản ứng với nước tạo ra sản phẩm duy nhất là chất X. Cho biết:
| Chất | CaO(s) | H2O(l) | X(aq) |
| -635,09 | -285,83 | -1002,82 |
a) Chất X là Ca(OH)2.
b) Lượng nhiệt tỏa ra khi cho 1,0 mol CaO tác dụng với nước là 89,1kJ.
c) Để làm sôi 500 gam nước lẩu từ 25°C lên 100°C cần “gói tạo nhiệt” chứa 84 gam CaO. (Biết nhiệt cần để làm cho 1 gam nước tăng thêm 1°C là 4,2J).
d) Phản ứng khi cho “gói tạo nhiệt” vào nước là phản ứng tỏa nhiệt.
(Xem giải) Câu 21. Phản ứng thủy phân ester trong môi trường kiềm được biểu diễn như sau: RCOOR’ + NaOH → RCOONa + R’OH
Một nhóm học sinh dự đoán “nồng độ NaOH càng lớn thì tốc độ phản ứng thủy phân càng lớn”. Từ đó, học sinh tiến hành thí nghiệm ở nhiệt độ không đổi (60°C) nhưng thay đổi nồng độ NaOH để kiểm tra dự đoán trên như sau:
• Bước 1: Thêm vào 5 ống nghiệm, mỗi ống 4 mL ethyl acetate (d = 0,9 g/mL) và 20 mL dung dịch NaOH nồng độ C (mol/L). Các giá trị nồng độ này không giống nhau giữa các thí nghiệm.
• Bước 2: Ngâm các ống nghiệm trong nồi nước nóng (nhiệt độ nước khoảng 60°C) và đo thời gian cho đến khi phần chất lỏng trong ống nghiệm trở nên đồng nhất.
Kết quả thí nghiệm được cho ở bảng sau:
| Nồng độ NaOH (mol/L) | 4,0 | 3,6 | 3,2 | 2,8 | 2,4 |
| Thời gian hỗn hợp đồng nhất (phút) | 5,2 | 6,0 | 7,0 | 8,2 | 9,5 |
a) Sau bước 1, phần chất lỏng trong các ống nghiệm tách thành hai lớp.
b) Phản ứng thủy phân ethyl acetate xảy ra ở bước 2 của các thí nghiệm.
c) Phản ứng thủy phân hoàn toàn tại thời điểm hỗn hợp trong ống nghiệm đồng nhất.
d) Kết quả thí nghiệm chứng tỏ dự đoán của học sinh ban đầu là chính xác.
(Xem giải) Câu 22. Một nhóm học sinh nghiên cứu về tinh chế kim loại đồng (copper) bằng phương pháp điện phân từ một thanh đồng không tinh khiết (chứa tạp chất không tham gia vào quá trình điện phân). Nhóm học sinh đã thực hiện thí nghiệm theo các bước sau:
• Bước 1: Cân để xác định khối lượng ban đầu của thanh đồng nguyên chất (3,21 gam) và thanh đồng không tinh khiết (3,30 gam).
• Bước 2: Nối thanh đồng nguyên chất với một điện cực và thanh đồng không tinh khiết với điện cực còn lại của nguồn điện một chiều, rồi nhúng vào bình điện phân chứa dung dịch copper (II) sulfate đã acid hóa bằng dung dịch sulfuric acid.
• Bước 3: Điện phân ở hiệu điện thế phù hợp. Sau thời gian điện phân t giây, các điện cực được lấy ra, làm khô cẩn thận, rồi cân để xác định lại khối lượng của thanh đồng nguyên chất và thanh đồng không tinh khiết, thấy khối lượng thanh đồng nguyên chất là 3,51 gam và khối lượng thanh đồng không tinh khiết là 2,98 gam.
a) Ở cathode xảy ra quá trình khử: Cu2+ + 2e → Cu.
b) Màu của dung dịch copper (II) sulfate không thay đổi.
c) Trong thí nghiệm trên, thanh đồng nguyên chất được nối với điện cực âm, thanh đồng không tinh khiết được nối với điện cực dương của nguồn điện.
d) Sau thời gian điện phân t giây, khối lượng đồng trong thanh đồng không tinh khiết tan ra là 0,32 gam.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Cho các phát biểu sau:
(1) Phân tử Valine có 5 nguyên tử C.
(2) Có thể dùng nước bromine để phân biệt glucose và fructose.
(3) Ứng với CTPT C3H7O2N có 2 đồng phân amino acid.
(4) Protein dạng hình cầu như albumin có thể tan trong nước cho dung dịch keo.
Liệt kê các phát biểu đúng theo số thứ tự tăng dần. (Ví dụ : 12 , 123, 234,…)
(Xem giải) Câu 24. Thí nghiệm: Phản ứng copper(II) sulfate với dung dịch ammonia.
• Chuẩn bị:
– Hóa chất: Dung dịch CuSO4 2%, dung dịch NH3 khoảng 10%.
– Dụng cụ: Ống nghiệm, ống hút nhỏ giọt.
• Tiến hành: Cho từ từ từng giọt dung dịch NH3 vào ống nghiệm chứa 5 mL dung dịch CuSO4. Lắc ống nghiệm trong quá trình thêm dung dịch NH3. Khi dung dịch trong ống nghiệm chuyển sang màu xanh lam thì dừng thêm dung dịch NH3.
Cho các phát biểu sau:
(a) Hiện tượng thí nghiệm là xuất hiện kết tủa màu xanh nhạt, lượng kết tủa tăng dần đến cực đại. Sau đó, kết tủa tan dần đến hết tạo dung dịch màu xanh lam đặc trưng.
(b) Ion OH− thay thế phối tử H2O trong [Cu(OH2)6]2+(aq) tạo kết tủa [Cu(OH)2(OH2)4] có màu xanh nhạt.
(c) NH3 dư tiếp tục thay thế phối tử OH− và H2O trong [Cu(OH)2(OH2)4] làm cho kết tủa tan dần và hình thành phức chất [Cu(NH3)4(OH2)2]2+(aq) có màu xanh lam.
(d) Phương trình hóa học của thí nghiệm như sau:
[Cu(OH2)6]2+(aq) + 2OH−(aq) ⟶ [Cu(OH)2(OH2)4](s) + 2H2O(l)
[Cu(OH)2(OH2)4](s) + 4NH3(aq) ⟶ [Cu(NH3)4(OH2)2]2+(aq) + 2OH−(aq) + 2H2O(l)
(e) Có thể thay thế ammonia bằng methylamine (CH3NH2) để thu được kết quả tương tự.
(f) Ammonia dư trong dung dịch có thể được loại bỏ bằng cách đun nóng dung dịch.
Trong số các phát biểu trên, có bao nhiêu phát biểu đúng?
(Xem giải) Câu 25. Trong công nghiệp, Al2O3 là nguyên liệu quan trọng cho quá trình sản xuất Al bằng phương pháp điện phân nóng chảy. Al2O3 được tách từ quặng bauxite (thành phần chính là Al2O3.nH2O) theo sơ đồ sau:
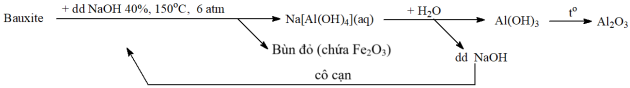
Trong quá trình tách Al2O3 từ quặng bauxite, 5% lượng NaOH bị hao hụt. Một nhà máy tách Al2O3 bằng dây chuyển hoạt động liên tục. Mỗi ngày, lượng NaOH cần bổ sung để bù đắp lượng NaOH bị hao hụt là 1000 kg. Mỗi ngày nhà máy tách được bao nhiêu tấn Al2O3? (Làm tròn kết quả đến hàng phần mười).
(Xem giải) Câu 26. Cho các chất: maltose, saccharose, glucose, fructose, ethyl formate, formic acid và acetic aldehyde. Trong các chất trên, có bao nhiêu chất vừa có khả năng tham gia phản ứng tráng bạc vừa có khả năng phản ứng với Cu(OH)2 ở điều kiện thường?
(Xem giải) Câu 27. Pin nhiên liệu sử dụng ethanol (C2H5OH) được đặc biệt quan tâm do có nguồn nhiên liệu sinh học dồi dào. Phản ứng xảy ra khi một pin ethanol – oxygen phóng điện ở 25°C trong dung dịch chất điện li là potassium hydroxide như sau: C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(l)
Một pin ethanol – oxygen được dùng để thắp sáng 5 bóng đèn LED, mỗi bóng có công suất 6 W (6 J/s) liên tục trong t giờ, tiêu thụ hết 230 gam ethanol với hiệu suất quá trình oxi hoá ethanol ở anode là 60%. Cho biết nhiệt tạo thành chuẩn của các chất:
| Chất | C2H5OH(l) | O2(g) | CO2(g) | H2O(l) |
 (kJ/mol) (kJ/mol) |
−277,6 | 0,00 | −393,5 | −285,8 |
Giá trị của t bằng bao nhiêu? (Kết quả làm tròn đến hàng đơn vị).
(Xem giải) Câu 28. Chỉ số xà phòng hóa là số mg KOH cần để trung hòa acid tự do và xà phòng hóa hết lượng ester có trong 1 gam chất béo. Một nhóm học sinh tiến hành thí nghiệm điều chế xà phòng từ nguyên liệu ban đầu là KOH và 500 gam dầu dừa thì thấy dầu dừa có chỉ số xà phòng hóa là 257. Nếu thay KOH bằng NaOH thì khối lượng NaOH tương ứng cần lấy là bao nhiêu? (Kết quả làm tròn đến hàng phần mười)

Bình luận