[2022-2023][Hóa 10] Kiểm tra giữa kỳ 1 trường Lương Thế Vinh – Quảng Nam
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Giải chi tiết và đáp án:
⇒ Mã đề: 003
| 1C | 2B | 3A | 4C | 5A | 6A | 7C | 8D | 9D | 10A |
| 11B | 12A | 13D | 14B | 15C | 16D | 17D | 18D | 19D | 20C |
| 21A |
A. TRẮC NGHIỆM: (7.0 điểm).
(Xem giải) Câu 1. Lớp M có số phân lớp electron là
A. 2. B. 1. C. 3. D. 4.
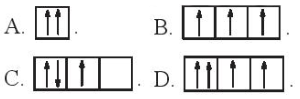
(Xem giải) Câu 2. Sự phân bố electron theo ô orbital nào dưới đây là đúng?
(Xem giải) Câu 3. Các đám mây gây hiện tượng sấm sét tạo bởi những hạt nước nhỏ li ti mang điện tích. Một phép đo thực nghiệm cho thấy một giọt nước có đường kính 50 μm, mang một lượng điện tích âm là -3,204 × 10^-17C. Điện tích âm của giọt nước trên tương đương với điện tích của bao nhiêu electron?
A. 200. B. 40. C. 400. D. 3,52.10^13.
(Xem giải) Câu 4. Orbital nguyên tử (kí hiệu là AO) là
A. đám mây chứa electron dạng hình cầu.
B. đám mây chứa electron có dạng hình số 8 nổi.
C. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước và năng lượng xác định.
(Xem giải) Câu 5. Cho các nguyên tử sau: 8X16; 9Y19; 11Z23; 8M17; 8T18. Những nguyên tử nào là đồng vị của nhau?
A. X, M, T. B. X, Y, Z. C. Y, M, T. D. Y, Z, M.
(Xem giải) Câu 6. Hãy cho biết dữ kiện nào trong thí nghiệm Rutherford chứng minh nguyên tử có cấu tạo rỗng?
A. Hầu hết các hạt alpha đều xuyên thẳng qua lá vàng.
B. Một số ít hạt alpha đi lệch hướng ban đầu.
C. Màn huỳnh quang phát sáng.
D. Một số rất ít hạt alpha bị bật ngược lại phía sau khi chạm lá vàng.
(Xem giải) Câu 7. Sự khác biệt cơ bản giữa mô hình Rutherford – Bohr và mô hình hiện đại về nguyên tử là
A. electron chuyển động (Rutherford – Bohr) và electron không chuyển động (mô hình hiện đại).
B. electron chuyển động theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt trời (mô hình hiện đại) và electron chuyển động không theo quỹ đạo xác định (mô hình Rutherford – Bohr).
C. electron chuyển động theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt trời (mô hình Rutherford – Bohr) và electron chuyển động không theo quỹ đạo xác định (mô hình hiện đại).
D. electron chuyển động xung quanh hạt nhân (mô hình Rutherford – Bohr) và electron chỉ chuyển động ở một khu vực nhất định bên ngoài hạt nhân (mô hình hiện đại).
(Xem giải) Câu 8. Chọn phát biểu đúng khi nói về nguyên tử?
A. Mg có 24 proton. B. Mg có 24 electron. C. Mg có 24 neutron. D. Mg có 12 electron.
(Xem giải) Câu 9. Nguyên tử trung hòa về điện vì
A. được tạo nên bởi các hạt không mang điện.
B. có tổng số hạt electron bằng tổng số hạt neutron.
C. tổng số hạt neutron bằng tổng số hạt proton.
D. có tổng số hạt proton bằng tổng số hạt electron.
(Xem giải) Câu 10. Những vấn đề về khí thải động cơ ô tô, xe máy cần được xử lí để đạt tiêu chuẩn cho phép thuộc vai trò của hóa học về
A. môi trường. B. năng lượng. C. vật liệu. D. sản xuất hóa chất.
(Xem giải) Câu 11. Cấu hình electron của một nguyên tử được biểu diễn dưới dạng các ô orbital như sau:
![]()
![]()
![]()
Số electron ở lớp ngoài cùng và tính chất đặc trưng của nguyên tố hóa học này là
A. 3, tính kim loại. B. 5, tính phi kim. C. 7, tính phi kim. D. 4, tính kim loại.
(Xem giải) Câu 12. Nguyên tử của nguyên tố neon (Z = 10) có cấu hình electron là
A. 1s2 2s2 2p6. B. 1s2 2s2 2p4 3s2.
C. 1s2 2s2 2p6 3s2. D. 1s2 2s2 2p6 3s1.
(Xem giải) Câu 13. Nội dung nào dưới đây không phải đối tượng nghiên cứu của hóa học?
A. Ứng dụng của chất. B. Tính chất và sự biến đổi của chất.
C. Thành phần, cấu trúc của chất. D. Sự lớn lên và sinh sản của tế bào.
(Xem giải) Câu 14. Kí hiệu 1s2 cho biết
A. phân lớp 2s có 1 AO. B. phân lớp 1s có 2 electron.
C. phân lớp 2s có 1 electron. D. phân lớp 1s có 2 AO.
(Xem giải) Câu 15. Trong nguyên tử, hạt mang điện là
A. proton. B. electron. C. electron và proton. D. neutron.
(Xem giải) Câu 16. Các phân lớp s, p, d và f lần lượt có các số AO tương ứng là
A. 1; 4; 9; 16. B. 1; 2; 3; 4. C. 2; 6; 10; 14. D. 1; 3; 5; 7.
(Xem giải) Câu 17. Thứ tự các bước trong phương pháp nghiên cứu hóa học là
A. xác định vấn đề nghiên cứu; nêu giả thuyết khoa học; viết báo cáo: thảo luận kết quả và kết luận vấn đề; thực hiện nghiên cứu.
B. nêu giả thuyết khoa học; xác định vấn đề nghiên cứu; thực hiện nghiên cứu; viết báo cáo: thảo luận kết quả và kết luận vấn đề.
C. nêu giả thuyết khoa học; xác định vấn đề nghiên cứu; viết báo cáo: thảo luận kết quả và kết luận vấn đề; thực hiện nghiên cứu.
D. xác định vấn đề nghiên cứu; nêu giả thuyết khoa học; thực hiện nghiên cứu; viết báo cáo: thảo luận kết quả và kết luận vấn đề.
(Xem giải) Câu 18. Nguyên tố hóa học là tập hợp các nguyên tử có cùng
A. số neutron. B. số proton và neutron. C. số khối. D. điện tích hạt nhân.
(Xem giải) Câu 19. Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là
A. 28. B. 23. C. 26. D. 27.
(Xem giải) Câu 20. Mỗi orbital nguyên tử chứa tối đa bao nhiêu electron?
A. 3 electron. B. 4 electron. C. 2 electron. D. 1 electron.
(Xem giải) Câu 21. Nguyên tử fluorine có 9 electron, hạt nhân nguyên tử này có điện tích là
A. +9. B. 9. C. 9+. D. -9.
B. TỰ LUẬN (3,0 điểm).
(Xem giải) Câu 1. Cho kí hiệu nguyên tử ![]() .
.
a. Viết cấu hình electron nguyên tử của nguyên tố aluminium (Al) và biểu diễn cấu hình electron theo ô obital. Từ đó, xác định số electron độc thân của nguyên tử này.
b. Aluminium là nguyên tố có tính chất hóa học đặc trưng gì?
(Xem giải) Câu 2: Cho phổ khối lượng của neon (Ne) như sau:
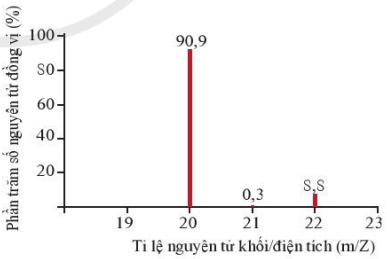
a. Em hãy chỉ ra các đồng vị của neon với phần trăm số nguyên tử tương ứng?
b. Tính nguyên tử khối trung bình của neon?
(Xem giải) Câu 3: Một bạn học sinh muốn xây dựng một mô hình nguyên tử hydrogen cỡ lớn theo đúng tỉ lệ để trưng bày trong hội chợ khoa học ở trường. Nếu nguyên tử có đường kính 1,00 m thì học sinh đó phải xây dựng hạt nhân có kích thước là bao nhiêu? Điều đó có dễ dàng thực hiện với các công cụ thông thường không? Mô hình đó có phù hợp để quan sát bằng mắt thường không? Biết rằng đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 10^4 lần.

Bình luận