[2024 – 2025] Đề tham khảo thi HSG tỉnh Nghệ An (Đề 2)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 150 phút
⇒ Bảng đáp án phần trắc nghiệm:
| Phần 1 | Phần 2 | 13 | 14 | 15 | 16 | ||
| 1A | 2A | 3D | (a) | Đ | Đ | S | Đ |
| 4B | 5A | 6C | (b) | S | Đ | Đ | Đ |
| 7A | 8D | 9A | (c) | Đ | S | S | S |
| 10B | 11B | 12D | (d) | Đ | S | Đ | Đ |
| Phần 3 | Câu 17 | 13,7 | Câu 18 | 55,8 |
A. PHẦN TRẮC NGHIỆM (8,0 điểm)
Phần 1: Câu hỏi trắc nghiệm nhiều phương án lựa chọn (3,0 điểm).
(Xem giải) Câu 1. Nguyên tử oxygen và nguyên tử magnesium có xu hướng nhường hay nhận bao nhiêu electron để đạt được cấu hình electron bền vững của khí hiếm?
A. Nhận 2 elctron và nhường 2 electron.
B. Nhận 2 electron và nhường 1 electron.
C. Nhường 2 electron và nhận 2 electron.
D. Nhận 1 electron và nhường 2 electron.
(Xem giải) Câu 2. Phản ứng hóa học trong đó có sự truyền năng lượng từ hệ sang môi trường xung quanh nó được gọi là
A. Phản ứng tỏa nhiệt. B. Phản ứng trung hòa.
C. Phản ứng trao đổi. D. Phản ứng thu nhiệt.
(Xem giải) Câu 3. Phản ứng giữa bromite ion và bromide ion trong môi trường acid xảy ra như sau: BrO2- + 3Br- + 4H+ (t°) → 2Br2 + 2H2O.
Sau khoảng thời gian 10 giây, đo được thông số của Br-: ΔC/Δt = -1,5.10-2 (M.s-1)
Tốc độ trung bình của phản ứng trong khoảng thời gian nói trên là
A. 1,5.10-2 (M.s-1). B. 1,5.10-3 (M.s-1).
C. 5.10-4 (M.s-1). D. 5.10-3 (M.s-1).
(Xem giải) Câu 4. Nung nóng hai ống nghiệm chứa NaHCO3 và P thấy phản ứng hóa học xảy ra như sau:
2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(g) (1)
4P(s) + 5O2(g) → 2P2O5(s) (2)
Khi ngừng đun nóng phản ứng (1) dừng lại còn phản ứng (2) tiếp tục xảy ra. Nhận định nào dưới đây là đúng?
A. Phản ứng (1) tỏa nhiệt, phản ứng (2) thu nhiệt.
B. Phản ứng (1) thu nhiệt, phản ứng (2) tỏa nhiệt.
C. Cả 2 phản ứng đều tỏa nhiệt.
D. Cả 2 phản ứng đều thu nhiệt.
(Xem giải) Câu 5. Hòa tan 12,675 gam một oleum A vào nước được 300 mL dung dịch Y. Chuẩn độ 10 mL dung dịch Y bằng dung dịch NaOH 0,25M thì kết quả cho ở bảng sau:
| Chuẩn độ | Lần 1 | Lần 2 | Lần 3 |
| Thể tích dung dịch NaOH 0,25M (mL) | 39,9 | 40,0 | 40,1 |
Khối lượng phân tử của oleum (amu) là
A. 338 B. 418. C. 258 D. 178.
(Xem giải) Câu 6. Phân bón nào sau đây khi bón cho cây trồng có thể làm đất bị chua
A. potassium chloride. B. potassium carbonate
C. ammonium nitrate. D. urea
(Xem giải) Câu 7. Tiến hành các thí nghiệm sau :
Bước 1. Cho lần lượt 2 mL mỗi dung dịch CaCl2 1M; BaCl2 1M và Na2SO4 1M vào các ống nghiệm tương ứng (1), (2) và (3).
Bước 2. Thêm từ từ từng giọt 2 mL dung dịch Na2SO4 1M vào ống (1) và (2).
Bước 3. Thêm từ từ từng giọt 2 mL dung dịch BaCl2 1M vào ống (3).
Cho các phát biểu sau :
(a) Thí nghiệm ở bước (3) nhằm kiểm tra sự có mặt của ion SO42- có trong dung dịch.
(b) Kết tủa ở ống (2) nhiều hơn kết tủa ở ống (1).
(c) Kết tủa ở ống (3) nhiều hơn kết tủa ở ống (2).
(d) Cả 3 ống nghiệm đều xuất hiện kết tủa màu trắng.
Số phát biểu đúng là
A. 3. B. 4. C. 1. D. 2.
(Xem giải) Câu 8. Cho các chất: glucose, fructose, maltose, sacchorose. Có bao nhiều chất phản ứng với thuốc thử Tollens sinh ra Ag?
A. 4. B. 2. C. 1. D. 3.
(Xem giải) Câu 9. Một thí nghiệm tách chất được mô tả như hình dưới đây:
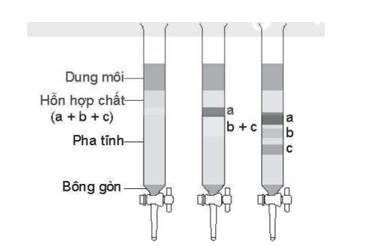
Cho các phát biểu sau:
(a) Phương pháp tách các chất trong thí nghiệm bên là phương pháp sắc kí cột.
(b) Chất bị hấp phụ mạnh nhất là a, chất bị hấp phụ kém nhất là c.
(c) Trong dung môi đó thì chất hòa tan tốt nhất là b, chất hòa tan kém nhất là a.
(d) Vai trò của bông gòn là để giữ cho pha tĩnh không bị rơi xuống làm tắc khóa.
Số phát biểu đúng là
A. 3. B. 4. C. 1. D. 2.
(Xem giải) Câu 10. Hợp chất cinnamaldehyde có nhiều trong vỏ cây quế, nó tạo nên mùi thơm của quế. Cinnamaldehyde có công thức cấu tạo như hình dưới
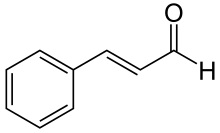
Phát biểu nào sau đây là không đúng ?
A. Khi để ngoài không khí, cinnamaldehyde bị oxi hóa làm cho quế mất dần mùi thơm.
B. Cinnamaldehyde có phản ứng iodoform.
C. Công thức phân tử của cinnamaldehyde là C9H8O.
D. Cinnamaldehyde có đồng phân hình học.
(Xem giải) Câu 11: Albuterol được sử dụng như một loại thuốc cho đường hô hấp, trị hen suyễn, có công thức:
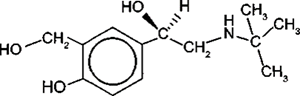
Phát biểu nào sau đây không đúng?
A. Albuterol có 2 nhóm -OH thuộc nhóm chức alcohol và 1 nhóm –OH thuộc chức phenol.
B. Albuterol có 3 nhóm -OH thuộc nhóm chức alcohol.
C. 1 mol albuterol phản ứng hết với kim loại Na thu được tối đa 1,5 mol khí H2.
D. Số nguyên tử carbon trong phân tử albuterol là 13.
(Xem giải) Câu 12. Thí nghiệm phản ứng xà phòng hóa chất béo được tiến hành theo các bước sau:
Bước 1: Cho 2 gam chất béo (mỡ lợn hoặc dầu lạc) và 4 mL dung dịch NaOH 40% vào một bát sứ.
Bước 2: Đun nóng hỗn hợp khoảng 10 phút đồng thời khuấy đều và thêm nước vào để hỗn hợp không bị cạn.
Bước 3. Đổ toàn bộ hỗn hợp vào cốc thủy tinh chứa 30 mL dung dịch NaCl bão hòa, khuấy đều rồi để yên.
Cho các phát biểu sau:
(a) Ngay sau bước 1, chất lỏng trong chén sứ tách thành hai lớp, phía trên là chất béo, phía dưới là dung dịch NaOH.
(b) Ở bước 2 xảy ra phản ứng thủy phân chất béo tạo thành sản phẩm là glycerol và acid béo.
(c) Sau bước 3, có lớp chất rắn màu trắng nổi lên phía trên là muối sodium của acid béo.
(d) Khi trộn chất rắn thu được ở bước 3 với chất phụ gia (chất diệt khuẩn, chất hương,…) thì được xà phòng.
Số phát biểu đúng là
A. 2. B. 4. C. 1. D. 3.
Phần 2: Câu hỏi trắc nghiệm dạng Đúng/Sai (4,0 điểm).
(Xem giải) Câu 13. Methyl cinnamate (ester của cinnamic acid) là chất rắn có mùi thơm nồng. Nó được tìm thấy tự nhiên trong nhiều loại thực vật như dâu tây, húng quế, bạch đàn trắng…
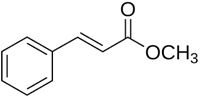
a) Methyl cinnamate là ester đơn chức.
b) Methyl cinnamate có thể cộng hợp với Br2 trong CCl4 theo tỉ lệ mol 1 : 4.
c) Trong phân tử methyl cinnamate, % theo khối lượng của carbon là 74,1%.
d) Thủy phân hoàn toàn methyl cinnamate trong dung dịch NaOH đun nóng, thu được methanol và sodium cinnamate.
(Xem giải) Câu 14. Biến thiên enthalpy tạo thành chuẩn của các halogen halide được cho trong bảng sau:
| Chất | HF (g) | HCl (g) | HBr (g) | HI (g) |
| – 273,3 | -92,3 | – 36,3 | 26,5 |
a) Năng lượng liên kết HX giảm dần từ HF đến HI.
b) Phản ứng tổng hợp HCl: H2(g) + Cl2(g) → 2HCl (g) có  = -184,6kJ.
= -184,6kJ.
c) Trong phản ứng giữa halogen với hydrogen, nhiệt lượng tỏa ra tăng dần từ F2 đến I2.
d) Phản ứng phân hủy HI: 2HI(g) → H2(g) + I2(g) là phản ứng thu nhiệt.
(Xem giải) Câu 15. Để điều chế một lượng nhỏ khí chlorine trong phòng thí nghiệm, người ta cho dung dịch HCl đặc phản ứng với MnO2 rắn theo sơ đồ dưới đây:
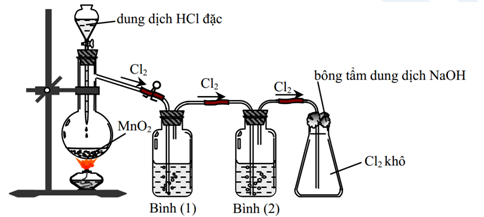
a) Bình (1) đựng dung dịch NaCl dùng để hòa tan 1 ít khí chlorine, bình (2) đượng H2SO4 đặc dùng để hút ẩm, làm khô khí, đảm bảo chất lượng chlorine.
b) Bông tẩm dung dịch NaOH giúp ngăn khí chlorine rò rỉ ra ngoài.
c) Nếu hoán đổi vị trí bình (1) và (2) thì chất lượng khí chlorine thu được sẽ không đổi.
d) Khi thay MnO2 ở thí nghiệm trên bằng KMnO4 cùng khối lượng thì lượng chlorine thu được sẽ nhiều hơn, biết HCl dùng dư, các phản ứng đều xảy ra hoàn toàn.
(Xem giải) Câu 16. Theo Tiêu chuẩn Việt Nam TCVN 7624 : 2007, khi chế tạo gương, chiều dày lớp bạc phủ trên bề mặt tấm kính (quy ra tổng lượng bạc trên một đơn vị m² kính) phải đạt tối thiểu 0,7 g/m². Một công ty cần sản xuất 30 000 m² gương có độ dày lớp bạc phủ ở mức 0,72 g/m². Để tạo ra bạc, người ta tiến hành theo sơ đồ phản ứng như sau:
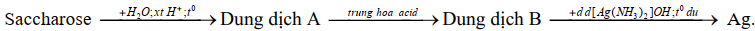
Biết hiệu suất cả quá trình là 80%.
a. Lượng bạc được tráng lên 30 000 m² gương với độ dày lớp bạc phủ ở mức 0,72 g/m² là 21,6 kg.
b. Trong dung dịch A gồm có hai monosaccharide.
c. Trong quá trình thủy phân sacchrose có thể thay xúc tác acid bằng xúc tác base.
d. Để sản xuất lượng gương với độ phủ bạc như trên, công ty đó cần sử dụng lượng saccharose ít nhất là 21,375 kg.
Phần 3: Câu hỏi trắc nghiệm dạng trả lời ngắn (1,0 điểm).
(Xem giải) Câu 1. Tiến hành lên men rượu từ 15 kg gạo (chứa 75% tinh bột) với H% cả quá trình là 60%. Sau khi lên men, thu được V (L) dung dịch ethyl alcohol 35°. Tính giá trị của V? (cho biết biết khối lượng riêng của C2H5OH nguyên chất là 0,8 g/mL, kết quả làm tròn đến hàng phần mười).
(Xem giải) Câu 2. Để xác định hàm lượng khí độc CO trong không khí người ta làm như sau: Lấy 23,0 Lít không khí (có khối lượng riêng d = 1,2 g/L). Dẫn toàn bộ mẫu khí đó đi từ từ qua thiết bị có ống đựng với lượng dư I2O5 được đốt nóng để oxi hóa toàn bộ lượng CO có trong mẫu thành CO2 và I2, lượng I2 thành hơi và được hấp thụ hết vào bình đựng lượng dư KI tạo ra phức chất KI3. Sau đó chuẩn độ KI3 bằng Na2S2O3 thì cần vừa đủ 11,0 mL dung dịch Na2S2O3 0,002M. Theo các phương trình hóa học sau:
5CO + I2O5 → I2 + 5CO2
KI + I2 → KI3
I3- + 2S2O32- → 3I- + S4O62-
Biết rằng ppm là số microgam (10-6 gam) chất trong 1 gam mẫu. Hàm lượng CO trong mẫu không khí trên theo số ppm CO là bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
B. TỰ LUẬN (12 điểm)
Câu 1 (3,0 điểm): Cơ sở hóa học.
(Xem giải) 1. Tiến hành phân hủy sulfuryl chloride theo phản ứng: SO2Cl2(g) → SO2(g) + Cl2(g)
Dữ liệu nồng độ theo thời gian được trình bày ở bảng sau:
| Thời gian (phút) | SO2Cl2 (mol/L) | SO2 (mol/L) | Cl2 (mol/L) |
| 0,0 | 1,00 | 0,0 | 0,0 |
| 30 | x | 0,39 | 0,39 |
| 50 | 0,35 | y | y |
a) Xác định giá trị x, y.
b) Tính tốc độ trung bình (M/phút) của phản ứng theo SO2Cl2 trong thời gian 20 phút (từ phút thứ 30 đến phút thứ 50)
(Xem giải) 2. Năm 2007, tại một phân xưởng sản xuất bột mì ở tỉnh Bình Dương đã xảy ra vụ nổ lớn khiến cho nhiều công nhân bị bỏng nặng, nguyên nhân vụ nổ do các công nhân hàn để bảo trì lại bể chứa bột mì. Em hãy cho biết hiện tượng này có phải nổ bụi không? giải thích?
(Xem giải) 3. Em hãy giải thích vì sao khi bảo quản dung dịch các muối chứa Al3+, Fe3+ trong phòng thí nghiệm người ta thường nhỏ vài giọt dung dịch acid vào trong lọ đựng dung dịch muối.
Câu 2 (3,0 điểm): Hóa học vô cơ.
(Xem giải) 1. Ammophos là một loại phân bón hóa học đang được sử dụng rộng rãi trong nông nghiệp. Ammophos được sản xuất trong công nghiệp từ quặng phosphorite (chứa 85,25% Ca3(PO4)2 còn lại là tạp chất trơ), H2SO4 đặc và NH3. Phương pháp sản xuất này gồm 2 giai đoạn: Tạo phosphoric acid và tạo monoammonium phosphate (MAP), diammoniphosphate (DAP) thu được phân ammophos có công thức dạng xNH4H2PO4.y(NH4)2HPO4.
Để sản xuất một mẻ phân ammophos, người ta cho vào lò 1 tấn quặng phosphorite ở trên, một lượng H2SO4 đặc cần thiết sau đó dùng một lượng vừa đủ NH3 là 149,6 kg. Biết các phản ứng đều đạt hiệu suất 100%.
a) Viết các phương trình hóa học xảy ra và tính khối lượng phân bón ammophos thu được
b) Xác định công thức và tính hàm lượng đạm, lân của loại phân ammophos nói trên.
(Xem giải) 2. Để xác định hàm lượng magnesium oxide trong một phụ gia có trong dược phẩm người ta tiến hành như sau: Lấy 2,1606 gam mẫu hòa tan hết trong dung dịch HCl. Thêm dần dung dịch NH3 vào cho đến khi có môi trường base yếu, thêm tiếp lượng dư (NH4)2HPO4 để kết tủa hết Mg2+ dưới dạng kết tủa MgNH4PO4. Lọc kết tủa rửa sạch bằng dung dịch NH3. Nung kết tủa ở nhiệt độ cao để thực hiện phản ứng:
2MgNH4PO4(s) → Mg2P2O7(s)+ 2NH3(g) + H2O(g)
Sau khi phản ứng phân hủy trên xảy ra hoàn toàn thu được 0,1838 gam chất rắn. Tính % về khối lượng của MgO trong mẫu.
(Xem giải) 3. Cho bảng nhiệt độ sôi của các hydrogen halide như sau:
| Hydrogen halide | HF | HCl | HBr | HI |
| ts (°C) | +19,5 | -84,9 | -66,7 | -35,8 |
a) Em hãy nêu xu hướng biến đổi nhiệt độ sôi của các hydrogen halide trên?
b) Giải thích tại sao HF lại có nhiệt độ sôi cao bất thường?
Câu 3 (3,5 điểm): Hóa học hữu cơ.
(Xem giải) 1. Methyl butanoate có mùi thơm của trái cây nên thường được sử dụng trong công nghiệm sản xuất bánh kẹo, nước giải khát…. Trong phòng thí nghiệm, methyl butanoate được tổng hợp bằng cách đun nóng hỗn hợp gồm methanol, butanoic acid và sulfuric acid đặc trong bình cầu chịu nhiệt ở điều kiện thích hợp. Sau một thời gian thu được hỗn hợp E gồm alcohol, acid, ester và nước. Biết một số tính chất vật lí của các chất trong hỗn hợp E như sau:
| Chất | Khối lượng riêng ở 25°C (g.mL-1) | Độ tan ở 25°C (g/100g nước) | Nhiệt độ sôi (°C) |
| H2O | 1,00 | 100 | |
| CH3OH | 0,79 | ∞ | 78 |
| CH3CH2CH2COOH | 0,96 | ∞ | 163,5 |
| CH3CH2CH2COOCH3 | 0,89 | 1,4 | 102 |
a) Viết phương trình hóa học xảy ra.
b) Để yên bình cầu một thời gian, hỗn hợp bị phân thành 2 lớp. Hãy cho biết thành phần các chất trong mỗi lớp?
c) Để tách methyl butanoate ra khỏi hỗn hợp E, sử dụng phương pháp chiết hay phương pháp chưng cất sẽ phù hợp hơn? Vì sao?
d) Trong thực tế, người ta thường thêm vào hỗn hợp E dung dịch NaCl bão hòa. Hãy cho biết mục đích của việc làm này và nêu rõ vai trò của NaCl?
(Xem giải) 2. Stilbene là hydrocarbon thơm có công thức phân tử C14H12, phân tử có 2 vòng benzene không có chung các nguyên tử carbon. Stilbene tác dụng được với bromine trong nước tạo ra dẫn xuất dibromo, tác dụng với HCl trong điều kiện thích hợp tạo thành dẫn xuất monochloro duy nhất.
a) Viết công thức cấu tạo của và cho biết stilbene có đồng phân hình học không? Nếu có, hãy viết công thức các đồng phân đó.
b) Viết các phương trình hóa học xảy ra khi cho stilbene lần lượt tác dụng với: Br2 (trong nước), HCl, dung dịch KMnO4 loãng (ở nhiệt độ thường).
(Xem giải) 3. Acetylsalicylic acid được dùng làm thuốc cảm aspirin. Acetylsalicylic acid được điều chế theo phản ứng sau: o-HO-C6H4-COOH + (CH3CO)2O → o-CH3COO-C6H4-COOH + CH3COOH. Biết mỗi vỉ thuốc aspirin có 10 viên (mỗi viên chứa 500 mg acetylsalicylic acid) và hiệu suất phản ứng tính theo salicylic acid là 92%. Để sản xuất 3 triệu vỉ thuốc cảm aspirin cần tối thiểu bao nhiêu tấn salicylic acid?
(Xem giải) Câu 4 (1,0 điểm): Tổng hợp vô cơ.
Quy trình sản xuất sulfuric acid theo phương pháp tiếp xúc gồm 3 giai đoạn. Em hãy viết các phương trình hóa học xảy ra trong 3 giai đoạn đó?
(Xem giải) Câu 5 (1,5 điểm): Tổng hợp hữu cơ.
Mẫu hóa chất A là hỗn hợp benzoic acid và phenol. Để xác định hàm lượng benzoic acid trong mẫu trên người ta cân chính xác 10,00 gam A cho vào dung dịch NaHCO3 dư, lắc kỹ một thời gian, sau đó để yên rồi tách riêng phần dung dịch và phần hữu cơ không tan. Cho phần dung dịch vào phễu chiết, thêm dung dịch HCl dư, làm lạnh hỗn hợp và thêm tiếp 10 mL hexane (D = 0,66 g/mL) vào và lắc đều. Để yên phễu chiết để hỗn hợp phân thành 2 lớp, loại bỏ lớp dung dịch phía dưới chỉ chứa các chất vô cơ, lớp chất hữu cơ phía trên đem cân lại nặng 9,18 gam.
a) Viết các phương trình hóa học xảy ra.
b) Trong phép phân tích trên, có thể thay NaHCO3 bằng Na2CO3 được không? Vì sao?
c) Tính thành phần % theo khối lượng của benzoic acid trong hỗn hợp A.


Bình luận