[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Lạng Sơn
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 046-H12C năm 2024-2025
⇒ Thời gian làm bài: 180 phút
Câu 1. (3,0 điểm)
(Xem giải) 1. R là một nguyên tố phổ biến và có nhiều ứng dụng trong cuộc sống. R siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật vô tuyến và điện tử. Ngoài ra, nguyên tố này còn được sử dụng để chế tạo pin mặt trời nhằm mục đích chuyển đổi năng lượng ánh sáng thành năng lượng điện để cung cấp cho các thiết bị trên tàu vũ trụ. Nguyên tố R có 3 đồng vị X, Y, Z. Tổng số hạt cơ bản trong nguyên tử của 3 đồng vị bằng 129. Trong đồng vị X, số neutron bằng số proton, đồng vị Z hơn đồng vị Y 1 hạt neutron.
a) Xác định số khối của 3 đồng vị X, Y, Z.
b) Cho biết tỷ lệ số nguyên tử của các đồng vị như sau: X : Y = 923 : 47 và Y : Z = 282 : 180. Xác định nguyên tử khối trung bình của R.
(Xem giải) 2. Hãy giải thích vì sao H2O và HF có phân tử khối, độ dài liên kết gần tương đương nhau nhưng thiệt độ sôi của H2O cao hơn nhiều so với HF?
| Phân tử | Độ dài liên kết | M | Nhiệt độ sôi |
| H2O | H-O: 0,96Å | 18 | 100°C |
| HF | H-F: 0,92Å | 20 | 19,5°C |
(Xem giải) 3. a) Viết công thức Lewis, công thức theo mô hình VSEPR, dự đoán trạng thái lai hóa của nguyên tử trung tâm, cho biết dạng hình học của các phân tử H2O và OF2.
(Xem giải) b) So sánh độ lớn góc liên kết trong hai phân tử H2O và OF2. Giải thích.
(Biết: Số hiệu nguyên tử các nguyên tố: H = 1; O = 8; F = 9, độ âm điện: H = 2,20; O = 3,44; F = 3,98)
Câu 2. (2,5 điểm)
(Xem giải) 1. Tính pH của dung dịch CH3COOH 0,1M (Ka của CH3COOH bằng 10^-4,76). Nêu hiện tượng khi cho methyl đỏ vào dung dịch CH3COOH trên. Biết methyl đỏ là một chất chỉ thị acid-base, có màu sắc thay đổi phụ thuộc vào pH của dung dịch (pH < 4,4: đỏ; 4,4 < pH < 6,2: da cam; pH > 6,2: vàng).
(Xem giải) 2. Peroxyacetyl nitrate (PAN), CH3COOONO2 là chất gây mù quang hoá làm giảm chức năng phổi và gây kích ứng mắt, nó được tạo ra do quá trình oxi hoá nhiên liệu hoá thạch, khói thuốc lá. Nó không bền về nhiệt và phân hủy thành các gốc peroxyethanoyl và khí nitrogen oxide. Biết phản ứng này là phản ứng bậc một với thời gian khi lượng PAN giảm một nửa là 32 phút.
– Tính hằng số tốc độ phản ứng phân huỷ PAN.
– Sau 160 phút từ khi bắt đầu phân huỷ PAN thì nồng độ PAN còn lại trong không khí là 6,2.10^13 phân tử/L. Tính nồng độ ban đầu của PAN.
(Xem giải) 3. Phản ứng phân hủy một loại hoạt chất kháng sinh X có hệ số nhiệt độ là 2,5. Ở 27°C, sau 10 giờ thì lượng hoạt chất X giảm đi một nửa.
a) Khi đưa vào cơ thể người (37°C) thì lượng hoạt chất giảm đi một nửa sau bao lâu?
b) Sau bao lâu thì hoạt chất kháng sinh này trong cơ thể người còn lại là 25% so với ban đầu.
Câu 3. (3,0 điểm)
(Xem giải) 1. Ở nước ta hiện nay, nhiệt điện vẫn chiếm vai trò nòng cốt, cung cấp hơn 60% tổng năng lượng điện cho đời sống và sản xuất. Có hai công nghệ sản xuất nhiệt điện là nhiệt điện khí và nhiệt điện than.
a) Một nhà máy nhiệt điện khí có sản lượng điện 10^6 kWh/ngày (1 kWh = 3600 kJ), sử dụng khí thiên nhiên hóa lỏng LNG (chứa 94% CH4, 6% C2H6 về thể tích) làm nhiên liệu. Tính khối lượng LNG (tấn) cần cung cấp cho nhà máy trong một ngày biết năng lượng tỏa ra khi đốt cháy 1 mol CH4 là 890 kJ; 1 mol C2H6 là 1560 kJ, 64% nhiệt lượng tỏa ra của quá trình đốt cháy được chuyển hóa thành điện năng.
b) So với nhà máy nhiệt điện than (sử dụng than đá làm nhiên liệu) có cùng sản lượng thì điện khí LNG sẽ giảm được bao nhiêu % khí thải CO2? Biết rằng với nhiệt điện than chỉ 40% nhiệt lượng tỏa ra của quá trình đốt cháy được chuyển hóa thành điện năng, năng lượng tỏa ra khi đốt cháy 1 tấn than đá là 3.10^7 kJ. Viết các phương trình phản ứng xảy ra khi đốt cháy các nhiên liệu trên.
(Xem giải) 2. Tính năng lượng tự do Gibbs của phản ứng sau ở 298K: CO(g) + 3H2(g) ⇋ CH4(g) + H2O(g). Cho biết:
| Chất | CH4(g) | H2O(g) | CO(g) | H2(g) |
| -74,9 | -241,8 | -110,5 | ||
| 186,2 | 188,7 | 197,5 | 130,6 |
Từ giá trị ![]() hãy nhận xét khả năng xảy ra của phản ứng trên ở 298K.
hãy nhận xét khả năng xảy ra của phản ứng trên ở 298K.
Câu 4. (3,0 điểm)
(Xem giải) 1. Quan sát hình vẽ mô tả bộ dụng cụ và hóa chất dùng để điều chế và thu khí NH3 trong phòng thí nghiệm.

a) Viết phương trình hóa học xảy ra.
b) Giải thích:
– Vì sao cần úp ngược ống nghiệm thu khí trên ống dẫn khí
– Vì sao ống nghiệm chứa hỗn hợp hóa chất được lắp nghiêng cho miệng ống hơi chúc xuống.
c) Nêu vai trò của mảnh giấy quỳ tím ẩm ở bên ngoài miệng ống nghiệm thu khí.
d) Đề xuất phương án xử lí khí NH3 dư sau khi thu khí xong.
(Xem giải) 2. Sự có mặt của khí sulfur dioxide (SO2) trong không khí là một trong những nguyên nhân gây ra hiện tượng mưa acid. SO2 được tạo ra chủ yếu từ các quá trình đốt cháy nhiên liệu như than đá, xăng, dầu,… Theo chuẩn kỹ thuật quốc gia về chất lượng không khí (QCVN 05:2023/BTNMT) thì nồng độ tối đa cho phép của SO2 ở điều kiện chuẩn là 350 μg/m³ (1 μg = 10^-6 gam). Nồng độ của SO2 có thể xác định bằng cách cho tác dụng với dung dịch potassium permanganate theo phản ứng sau:
SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4
a) Cân bằng phản ứng oxi hoá – khử trên theo phương pháp thăng bằng electron, xác định rõ chất khử, chất oxi hoá, quá trình khử và quá trình oxi hoá.
b) Khi phân tích 2,5 m³ một mẫu không khí, thấy lượng SO2 trong mẫu phản ứng vừa đủ với 5 mL dung dịch KMnO4 0,001M (coi các thành phần khí khác trong mẫu không có phản ứng với KMnO4).
– Tính nồng độ SO2 trong mẫu không khí trên (μg/m³).
– Mẫu không khí trên có bị ô nhiễm bởi SO2 hay không?
c) Hãy đề xuất một số biện pháp làm giảm tác hại của mưa acid đối với đời sống của thực vật, vật nuôi và con người.
Câu 5. (2,5 điểm)
(Xem giải) 1. Khi phân tích thành phần nguyên tố của hai hydrocarbon mạch hở A và B (đều là chất khí ở điều kiện thường, MA < MB) đều có 92,308% khối lượng carbon. Chất A và B đều có phản ứng với dung dịch AgNO3/NH3 lấy dư. Từ chất A có thể điều chế ra chất B khi có chất xúc tác thích hợp và đun nóng.
a) Xác định công thức phân tử và công thức cấu tạo của A và B.
b) Viết các phương trình hóa học minh họa.
(Xem giải) 2. Khí X là đồng đẳng kế tiếp của methane. Trong điều kiện được chiếu sáng, X có thể phản ứng với chlorine (tỉ lệ mol 1 : 1) tạo dẫn xuất monochloro đồng thời thu được một lượng nhỏ sản phẩm phụ là butane.
a) Viết phương trình hóa học của phản ứng xảy ra.
b) Viết cơ chế của phản ứng để giải thích sự tạo thành butane trong sản phẩm.
(Xem giải) 3. Cho phổ IR của ba chất hữu cơ như hình dưới đây. Hãy cho biết mỗi hình ứng với chất nào trong các chất sau: HOCH2CH2OH (1); CH3CH2CHO (2); CH3COOCH3 (3). Giải thích.
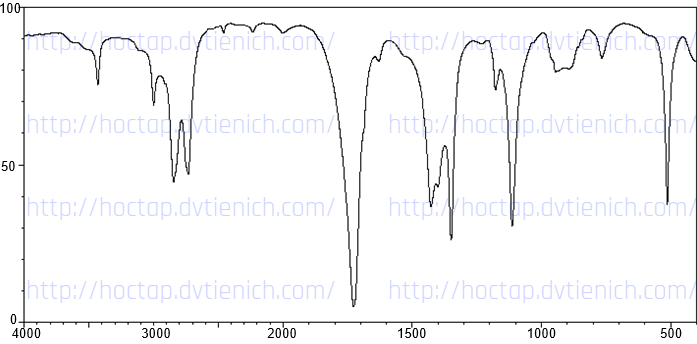
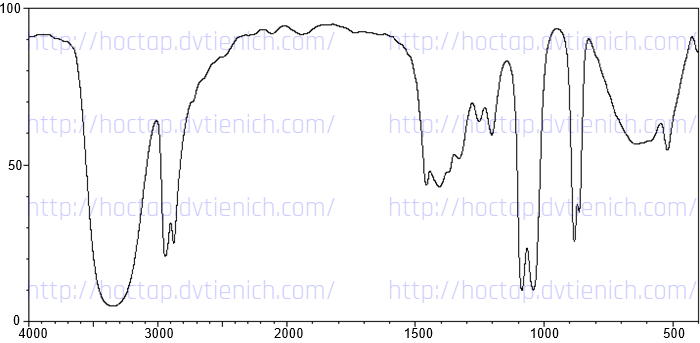
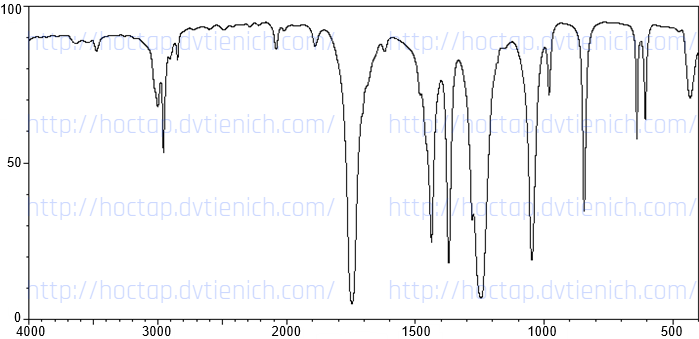
Bảng đối chiếu tín hiệu phổ hồng ngoại của các nhóm chức:
| Loại hợp chất | Liên kết | Số sóng | Loại hợp chất | Liên kết | Số sóng |
| Alcohol | O-H | 3500 – 3200 | Carboxylic acid | C=O | 1760 – 1690 |
| Aldehyde | C=O | 1740 – 1685 | O-H | 3300 – 2500 | |
| C-H | 2830 – 2695 | Ester | C=O | 1750 – 1735 | |
| Ketone | C=O | 1715 – 1666 | C-O | 1300 – 1000 |
Câu 6. (2 điểm)
(Xem giải) a) Glucose có thể tồn tại dạng mạch hở và hai dạng mạch vòng (α và β), các dạng mạch này có thể chuyển hóa qua lại lẫn nhau. Vẽ các dạng công thức cấu tạo của glucose. Viết phương trình hóa học khi cho glucose lần lượt phản ứng với thuốc thử Tollens và CH3OH/khí HCl.
(Xem giải) b) Ethanol dùng để sản xuất xăng E5 (xăng chứa 5% ethanol về thể tích) được tạo ra từ cellulose theo sơ đồ: Cellulose → Glucose → Ethanol (Hiệu suất lần lượt là 81% và 80%). Để tạo ra lượng ethanol đủ sản xuất được 460 lít xăng E5 thì cần x kg mùn cưa (chứa 50% cellulose, còn lại là các chất không tạo ra được ethanol). Biết khối lượng riêng của ethanol là 0,8 g/mL. Viết phương trình hóa học của phản ứng theo sơ đồ trên và tính giá trị x.
Câu 7 (2,0 điểm)
(Xem giải) 1. Một học sinh thực hiện thí nghiệm thuỷ phân 1-bromopropane trong dung dịch NaOH theo các bước như sau:
Bước 1: Thêm lượng dư dung dịch NaOH đặc vào bình sầu chứa 1-bromopropane.
Bước 2: Đun hồi lưu hỗn hợp trong bình cầu ở bước 1 một thời gian.
Bước 3: Lấy một lượng nhỏ hỗn hợp ở bước 2 vào ống nghiệm, acid hoá với lượng dư dung dịch HNO3, rồi thêm vài giọt dung dịch AgNO3.
Nêu hiện tượng trong các bước thí nghiệm, giải thích và viết các phương trình hoá học xảy ra.
(Xem giải) 2. Paracetamol (còn có tên gọi khác là acetaminophen) là hoạt chất giúp giảm đau và hạ sốt… được sử dụng nhiều trong y học. Thuốc paracetamol được tổng hợp từ phenol qua nhiều giai đoạn, trong đó giai đoạn tạo ra paracetamol từ p-amino phenol và acetic anhydride xảy ra theo phương trình hóa học sau:

Để sản xuất 450 hộp thuốc paracetamol 500 mg (mỗi hộp gồm 10 vỉ, mỗi vỉ gồm 10 viên, mỗi viên chứa 500 mg paracetamol) cần dùng tối thiểu m kg p-amino phenol. Biếu hiệu suất phản ứng tính theo p-amino phenol là 80%. Tính giá trị của m.
Câu 8. (2,0 điểm)
(Xem giải) 1. Thủy phân hoàn toàn một hexapeptide M thu được Ala, Arg, Glu, Ile, Phe và Tyr. Các peptide E (chứa Tyr, Arg) và G (chứa Arg, Glu, Tyr) được tạo thành trong số các sản phẩm thủy phân không hoàn toàn M. Dùng 2,4-dinitrofluorobenzene xác định được amino acid đầu N là Ala. Thủy phân M nhờ tripsin thu được tripeptide A (chứa Phe, Ala, Arg) và một chất B.
a) Xác định thứ tự liên kết của các amino acid trong E, G, A và M. Biết tripsin là enzyme đặc hiệu xúc tác cho phản ứng thủy phân liên kết peptide bằng cách tác động lên đầu các nhóm carboxyl của các amino acid cơ bản như Lys và Arg.
b) Giá trị pH mà khi đó amino acid có nồng độ ion lưỡng cực là cực đại được gọi là điểm đẳng điện (kí hiệu là pI). Khi pH < pI thì amino acid đó tồn tại chủ yếu ở dạng cation, còn khi pH > pI thì amino acid đó tồn tại chủ yếu ở dạng anion. Cho các giá trị p của các chất sau:
| Chất | Glycine | Glutamic acid | Lysine |
| pI | 6,0 | 3,2 | 9,7 |
Đặt hỗn hợp amino acid gồm glycine, lysin và glutamic acid ở pH = 6,0 vào trong một điện trường. Hãy nêu và giải thích sự dịch chuyển của các amino acid về các điện cực.
(Xem giải) 2. Thành phần chính của cao su thiên nhiên là polyisoprene ở dạng đồng phân cis.
a) Viết công thức (dạng cis) của một đoạn mạch cao su thiên nhiên chứa 3 mắt xích.
b) Cao su thiên nhiên có khả năng phản ứng với lưu huỳnh tạo cao su lưu hóa có tính đàn hồi, chịu nhiệt, lâu mòn, khó tan. Một loại cao su lưu hóa có 2% sulfur (S) về khối lượng. Trung bình bao nhiêu mắt xích isoprene có một cầu disulfide (-S-S-)? Giả thiết rằng nguyên tử S đã thay thế cho các nguyên tử H ở cầu methylene (-CH2-) trong mạch cao su.


Bình luận