[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Thái Bình
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 045-H12A năm 2024-2025
⇒ Thời gian làm bài: 90 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1D | 2D | 3A | 4B | 5B | 6A | 7D | 8A | 9B | 10A |
| 11C | 12C | 13C | 14D | 15D | 16B | 17C | 18C | 19D | 20B |
| Câu 21 | Câu 22 | Câu 23 | Câu 24 | Câu 25 | Câu 26 | |
| (a) | Đ | Đ | S | S | Đ | Đ |
| (b) | Đ | Đ | S | Đ | S | Đ |
| (c) | Đ | Đ | Đ | Đ | S | S |
| (d) | S | Đ | S | S | Đ | Đ |
| Câu 27 | Câu 28 | Câu 29 | Câu 30 | Câu 31 | Câu 32 |
| 24 | 17 | 0,03 | 1 | 0,18 | 123 |
PHẦN I (8,0 điểm). Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 20. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1: Kevlar là một polyamide có độ bền kéo rất cao. Loại vật liệu này được dùng để sản xuất áo chống đạn và mũ bảo hiểm cho quân đội. Kevlar được điều chế bằng phản ứng của hai chất sau:
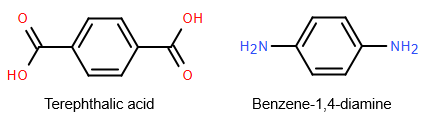
Nhận xét nào sau đây sai?
A. Benzene-1,4-diamine thuộc loại arylamine.
B. Các monomer tạo nên vật liệu Kevlar đều là hợp chất hữu cơ đa chức.
C. Công thức cấu tạo của Kevlar là:
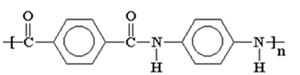
D. Kevlar được điều chế bằng phản ứng trùng hợp.
(Xem giải) Câu 2: Ở điều kiện chuẩn, thực hiện các phản ứng theo 3 bước sau:
• Bước 1: Cho bột Cu vào dung dịch Fe(NO3)3 thu được chất rắn X và dung dịch Y.
• Bước 2: Cho tiếp AgNO3 dư vào dung dịch Y thu được dung dịch Z.
• Bước 3: Cho X vào dung dịch Z.
Cho biết: các phản ứng xảy ra hoàn toàn và giá trị thế điện cực chuẩn theo bảng sau:
| Cặp oxi hoá – khử | Fe2+/Fe | Cu2+/Cu | Fe3+/Fe2+ | Ag+/Ag |
| Thế điện cực chuẩn (V) | -0,440 | +0,340 | +0,771 | +0,799 |
Cho các phát biểu sau:
(1) Ion Ag+ có tính oxi hóa yếu nhất trong các ion: Fe2+, Cu2+, Fe3+, Ag+.
(2) Cu có tính khử mạnh hơn Fe2+ ở điều kiện chuẩn.
(3) Dung dịch Z chứa 2 chất tan.
(4) Ở bước 3 không xảy ra phản ứng oxi hóa khử.
Số phát biểu đúng là:
A. 4. B. 2. C. 3. D. 1.
(Xem giải) Câu 3: Điện phân 100 mL dung dịch chứa hai muối Cu(NO3)2 x(M) và AgNO3 y(M) với cường độ dòng điện 0,965A đến khi cathode bắt đầu có khí thoát ra thì mất 1 giờ 5 phút, khi đó khối lượng cathode tăng thêm 2,388 gam và thu được dung dịch X. Cho các phát biểu sau:
(1) Thứ tự điện phân trong thời gian trên ở cathode là Ag+, Cu2+.
(2) Giá trị của x và y lần lượt là 0,012 và 0,015.
(3) Dung dịch X có 1 chất tan.
(4) Số mol khí thoát ra ở anode trong thời gian trên là 9,75.10^-3.
Số phát biểu sai là:
A. 1. B. 3. C. 4. D. 2
(Xem giải) Câu 4: Cho các chất sau: glucose, fructose, glycerol, amylose, saccharose, tripalmitin. Số chất phản ứng với Cu(OH)2 trong môi trường kiềm tạo phức màu xanh lam?
A. 2. B. 4. C. 3. D. 5.
(Xem giải) Câu 5: Ở pH = 9,8 amino acid X hầu như không di chuyển trong điện trường, khi pH = 12 thì X tồn tại ở dạng anion và di chuyển về phía cực dương của điện trường. Amino acid nào sau đây có thể thỏa mãn tính chất trên?
A. Glycine. B. Lysine. C. Valine. D. Glutamic acid.
(Xem giải) Câu 6: Alkylamine (X) bậc 2 có chứa 23,73% nguyên tố N về khối lượng. Danh pháp gốc – chức của X là
A. ethylmethylamine. B. methylethylamine.
C. N-methylethanamine. D. N-ethylmethanamine.
(Xem giải) Câu 7: Polymer A thuộc loại poly(ester amide) được sử dụng trong dược phẩm để giải phóng thuốc có kiểm soát. Sau khi uống, các enzyme của cơ thể nhận biết các amino acid tự nhiên trong mạch polymer và phân cắt tại các vị trí này làm thuốc được giải phóng một cách từ từ. Polymer A được tổng hợp từ bốn monomer gồm hai monomer đa chức X, Y (MX < MY), hai monomer là amino acid Z và dẫn xuất của amino acid T. Polymer A có công thức cấu tạo như hình sau đây:

Cho các nhận xét sau:
(1) Trong một mắt xích của polymer A, có 3 liên kết peptide.
(2) Phân tử khối của T là 236.
(3) Thủy phân hoàn toàn polymer A trong dung dịch NaOH dư thu được 4 sản phẩm hữu cơ.
(4) Y là đồng đẳng của ethanedioic acid.
Số nhận xét đúng là
A. 3. B. 4. C. 2. D. 1.
(Xem giải) Câu 8: Cho carbohydrate X có công thức cấu tạo dưới đây:

Phát biểu nào sau đây đúng?
A. Liên kết (b) là liên kết α-1,4-glycoside.
B. X có nhiều trong mầm lúa, được cấu tạo từ một đơn vị α-glucose và một đơn vị β-fructose.
C. X không là sản phẩm trung gian khi thủy phân tinh bột.
D. X có nhóm -OH hemiacetal và có thể mở vòng tạo nhóm chức ketone.
(Xem giải) Câu 9: Vào mùa mưa khí hậu ẩm ướt, đặc biệt ở các vùng mưa lũ dễ phát sinh một số bệnh như ghẻ lở. Người bị bệnh khi đó được khuyên nên bôi vào các vị trí ghẻ lở một loại thuốc thông dụng là DEP. Thuốc DEP có thành phần hoá học quan trọng là diethyl phthalate.
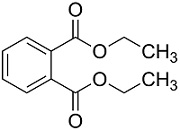
Phản ứng của cặp chất nào sau đây thu được diethyl phthalate?
A. o-C6H4(COOH)2 và CH3OH. B. o-C6H4(COOH)2 và C2H5OH.
C. o-C6H4(OH)2 và CH3COOH. D. o-C6H4(OH)2 và C2H5COOH.
(Xem giải) Câu 10: Linoleic acid (có cấu tạo như hình dưới) là một trong những acid béo có lợi cho sức khỏe tim mạch, ngăn ngừa các bệnh về tim, động mạch vành.
![]()
Nhận xét nào sau đây đúng về linoleic acid?
A. Trong phân tử linoleic acid có 3 liên kết π.
B. Linoleic acid thuộc loại omega – 9.
C. Tên thay thế của linoleic acid là trans,trans-9,12-octadecadienoic acid.
D. Linoleic acid có 17 nguyên tử carbon trong phân tử.
(Xem giải) Câu 11: Cho các chất có công thức cấu tạo thu gọn sau: (1) CH3COONa, (2) CH3(CH2)11OSO3Na, (3) CH3(CH2)14COONa, (4) CH3(CH2)11C6H4SO3Na, (5) CH3(CH2)16COOH. Số chất có thể là thành phần chính của xà phòng?
A. 4. B. 3. C. 1. D. 2.
(Xem giải) Câu 12: Trong pin nhiên liệu hydrogen, H2 có vai trò tương tự như kim loại mạnh hơn trong pin Galvani. Phản ứng nào sau đây diễn ra ở điện cực âm khi pin nhiên liệu hydrogen hoạt động?
A. 2H+ + 2e → H2. B. O2 + 4H + 4e → 2H2O.
C. H2 → 2H+ + 2e. D. 2H2 + O2 → 2H2O.
(Xem giải) Câu 13: Cho sơ đồ chuyển hóa sau:
![]()
Các chất X, Y, Z, T lần lượt là (C6H5- là gốc phenyl)
A. C6H5NO2, C6H5NH3Cl, C6H5NH2, C6H5N2+.
B. C6H5NO2, C6H5NH2, C6H5N2+, C6H5NH3Cl.
C. C6H5NO2, C6H5NH3Cl, C6H5NH2, C6H5N2+.
D. C6H5NO2, C6H5NH3Cl, C6H5N2+, C6H5NH2.
(Xem giải) Câu 14: Hydrocarbon no, mạch dài không phân nhánh có trong dầu mỏ là nguồn nguyên liệu trong tổng hợp hữu cơ. Một trong các chuyển hóa hydrocarbon được biết đến là quá trình sản xuất xà phòng từ hydrocarbon X (R-CH2-CH2-R), quá trình đó được mô tả theo sơ đồ sau:
![]()
Cho các phát biểu sau:
(1) Sodium stearate thân thiện với môi trường hơn chất giặt rửa tổng hợp.
(2) Trong phản ứng (1), X bị oxi hóa cắt mạch carbon bởi oxygen tạo thành carboxylic acid.
(3) Tổng số liên kết sigma (σ) trong một phân tử X là 110.
(4) Muối sodium stearate có khả năng giặt rửa là do nhóm -COONa dễ xâm nhập vào các vết bẩn.
(5) Sodium stearate còn được sản xuất bằng cách đun nóng tristearin với dung dịch KOH đặc.
Số phát biểu đúng là
A. 3. B. 4. C. 1. D. 2.
(Xem giải) Câu 15: Insulin, một loại hormone protein được sản sinh bởi tuyến tụy, có chức năng điều hòa quá trình chuyển hóa glucose trong cơ thể. Với phân tử khối khoảng 5800 Dalton, insulin thúc đẩy sự hấp thu glucose của các tế bào và dự trữ glucose dư thừa trong gan và cơ, giúp duy trì cân bằng đường huyết.

Phát biểu nào sau đây đúng?
A. Mỗi chuỗi polypeptide của insulin gồm các đơn vị α-amino acid liên kết với nhau qua liên kết peptide không theo một trật tự nhất định.
B. Insulin không bị thủy phân trong môi trường acid và base.
C. Insulin là protein đặc biệt, nhờ cấu trúc đơn giản nên không bị đông tụ hay biến tính dưới tác dụng của nhiệt độ cao hoặc các tác nhân acid, base mạnh.
D. Insulin là loại protein gồm 2 chuỗi A và B được liên kết với nhau bằng liên kết disulfide.
(Xem giải) Câu 16: Nhận xét nào sau đây sai?
A. Glucose và fructose là đồng phân của nhau.
B. Trong công nghiệp, saccharose được dùng để tráng gương và ruột phích vì saccharose có phản ứng tráng bạc.
C. Cellulose không thể tiêu hóa bởi enzyme trong hệ tiêu hóa của người vì con người thiếu enzyme cellulase cần thiết để phân giải liên kết β-1,4-glycoside trong cellulose.
D. Bột mì có thể dùng làm chất kết dính khi nấu ăn vì bột mì chứa tinh bột, khi được nấu chín, tinh bột nở ra và trở nên dính.
(Xem giải) Câu 17: Đặc tính nào sau đây không phải là của enzyme?
A. Enzyme có hoạt tính xúc tác cao hơn xúc tác hóa học của cùng quá trình.
B. Enzyme có tính chọn lọc cao, mỗi enzyme chỉ xúc tác cho một hoặc một số phản ứng nhất định.
C. Cấu trúc enzyme bị biến đổi sau phản ứng sinh hoá và hoá học.
D. Enzyme α-amylase có trong nước bọt thúc đẩy quá trình thuỷ phân tinh bột nên khi nhai cơm kĩ ta thấy vị ngọt.
(Xem giải) Câu 18: Một loại chất béo chứa 80% tristearin về khối lượng được dùng để sản xuất xà phòng và glycerol (glycerol là chất dưỡng ẩm cho nước rửa tay). Từ lượng glycerol thu được khi thủy phân hoàn toàn 667,5 tấn loại chất béo trên trong dung dịch NaOH đặc, đun nóng sẽ pha chế được x triệu chai nước rửa tay. Biết rằng trong mỗi chai nước rửa tay có chứa 6 gam glycerol. Giá trị của x là bao nhiêu?
A. 11,5. B. 14,375. C. 9,2. D. 3,067.
(Xem giải) Câu 19: Whey protein là một nguồn protein chất lượng, chứa rất nhiều amino acid thiết yếu và dễ hấp thụ nhanh chóng hơn so với các thực phẩm chứa protein mà chúng ta ăn hằng ngày. Nhiều nghiên cứu cho thấy bột whey protein có thể giúp bạn tăng sức mạnh, hỗ trợ phục hồi cơ bắp sau khi tập luyện giúp tăng cơ và giảm lượng mỡ thừa đáng kể. Nhìn chung whey protein là sản phẩm an toàn với liều lượng khoảng 1 – 2 muỗng tức khoảng 25 – 50 gam protein (hoặc cao hơn một chút) mỗi ngày, thường dùng sau khi tập luyện. Cho bảng sau về một số nguồn cung cấp protein trong các thực phẩm:
| Tên thực phẩm | Số gam protein cung cấp |
| Whey protein | 27g protein/1 muỗng 32 gam |
| Ức gà (đã nấu chín) | 31g protein/100g ức gà |
| Thịt cá ngừ (chưa chế biến) | 29g protein/100g thịt cá ngừ |
| Trứng cỡ vừa (đã luộc chín) | 6,3g protein/1 quả trứng |
Hằng ngày, một vận động viên thể hình khoảng 80 kg, sử dụng 2,5 gam protein/kg trọng lượng cơ thể/ngày cần bổ sung khoảng x gam ức gà, 40 gam thịt cá ngừ, 12 quả trứng cỡ vừa, kèm theo 2 muỗng whey protein. Giá trị của x là
A. 276,8. B. 200. C. 191,7. D. 189,7.
(Xem giải) Câu 20: Pin Zn – Cu được thiết lập ở điều kiện chuẩn với cầu muối chứa dung dịch bão hoà KNO3 theo sơ đồ sau:

Phát biểu nào sau đây đúng?
A. Trong cầu muối, K+ di chuyển về dung dịch bên anode, NO3- di chuyển về dung dịch bên cathode.
B. Sức điện động của pin là 1,102V.
C. Khi pin hoạt động nồng độ Zn2+ giảm.
D. Tại anode xảy ra quá trình khử: Zn → Zn2+ + 2e.
PHẦN II (8,4 điểm). Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 21 đến câu 26. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 21: Năm 1965, trong quá trình tổng hợp thuốc chống loét dạ dày, nhà hóa học James M. Schlatter (Mỹ) đã vô tình phát hiện hợp chất X (một chất ngọt nhân tạo với tên thường gọi là “Aspartame”) có cấu tạo như hình sau:
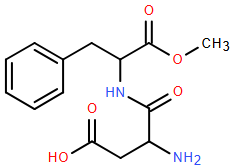
Aspartame ngọt hơn khoảng 200 lần so với đường ăn thông thường. Aspartame thường được sử dụng trong đồ uống và thực phẩm dành cho người ăn kiêng vì có ít calo hơn đường thông thường. Tổ chức Y tế thế giới (WHO) thông báo xếp chất làm ngọt nhân tạo aspartame vào danh sách các chất “có thể gây ung thư cho con người” nhưng lưu ý chất này vẫn an toàn nếu được tiêu thụ trong giới hạn khuyến nghị hằng ngày.
a) Aspartame là ester của methanol với dipeptide (tạo bởi các amino acid HOOCCH(NH2)CH2COOH và C6H5CH2CH(NH2)COOH).
b) Công thức phân tử của aspartame C14H18N2O5.
c) Không nên sử dụng quá nhiều đồ uống có chất tạo ngọt liên tục trong thời gian dài.
d) Tổng số electron hóa trị chưa tham gia liên kết của các nguyên tử N trong một phân tử X là 2.
(Xem giải) Câu 22: Tiến hành thí nghiệm điện phân dung dịch CuSO4 theo các bước sau:
Bước 1: Lắp thiết bị thí nghiệm điện phân dung dịch CuSO4 như hình bên dưới:
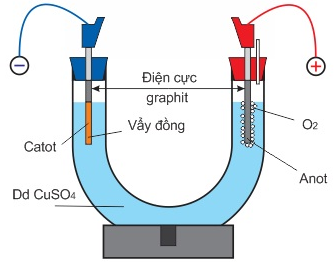
Bước 2: Rót 40 ml dung dịch CuSO4 0,5 M vào ống thuỷ tinh hình chữ U rồi nhúng hai điện cực than chì vào dung dịch.
Bước 3: Nối hai điện cực than chì với hai cực của nguồn điện có cường độ dòng điện là 9,65A và tiến hành điện phân.
+ Sau thời gian t (s) thu được 0,0075 mol khí ở anode và dung dịch X.
+ Thực hiện thí nghiệm với bộ dụng cụ và lượng hóa chất như trên trong thời gian điện phân là 3t (s) thì thu được 0,0475 mol khí thoát ra ở cả hai điện cực và dung dịch Y.
a) Khối lượng dung dịch Y giảm 2,05 gam so với dung dịch CuSO4 ban đầu.
b) Để mạ Cu lên chiếc chìa khóa bằng Fe theo phương pháp điện phân thì trong sơ đồ thí nghiệm trên phải sử dụng anode là thanh Cu nguyên chất, cathode là chìa khóa và dung dịch điện phân là dung dịch CuSO4.
c) Tại thời điểm 1,2t (s), ion Cu2+ chưa bị điện phân hết.
d) Nếu nhúng thanh Mg vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn, nhấc thanh Mg ra, sấy khô thì thấy khối lượng thanh Mg giảm 0,16 gam.
(Xem giải) Câu 23: Saccharose monolaurate là một trong những chất phụ gia có chức năng kép do có khả năng nhũ hóa và hoạt tính kháng khuẩn của nó. Công thức cấu tạo của saccharose monolaurate là
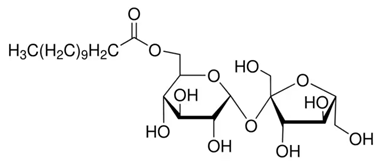
a) Thủy phân hoàn toàn saccharose monolaurate trong dung dịch NaOH đun nóng thu được: sodium laurate, glucose và fructose.
b) Saccharose monolaurate phản ứng được với: thuốc thử Tollens và CH3OH khi có mặt HCl khan.
c) Saccharose monolaurate được sử dụng làm chất nhũ hoá do phân tử có một đầu ưa nước gắn với một đuôi dài kị nước.
d) Từ 300 gam lauric acid và 547,2 gam saccharose có thể điều chế được tối đa 402,432 gam saccharose monolaurate. Cho biết hiệu suất phản ứng đạt 48%.
(Xem giải) Câu 24: Aspirin (acetylsalicylic acid) và paracetamol là các loại thuốc hạ sốt, giảm đau phổ biến.
– Aspirin được điều chế theo phương trình phản ứng như sau:
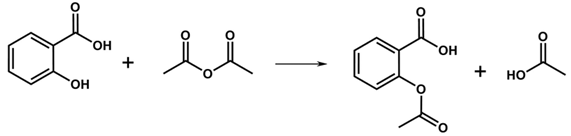
– Paracetamol được điều chế theo sơ đồ phản ứng như sau:

a) Để sản xuất một lô gồm 20 triệu viên thuốc Paracetamol (mỗi viên thuốc chứa 500 mg Paracetamol) với hiệu suất tính theo p-aminophenol là 85% thì khối lượng p-aminophenol cần dùng là 8492,4 gam.
b) Sau khi uống, aspirin bị thủy phân trong cơ thể tạo thành salicylic acid.
c) Trong phòng thí nghiệm thực hiện điều chế aspirin thô từ hỗn hợp gồm: salicylic acid khan, anhydride acetic và sulfuric acid đặc. Aspirin thô được tinh chế theo phương pháp sau: hòa tan aspirin thô trong ethanol 90° (cần đun nóng để tan hoàn toàn), sau đó cho dung dịch này từ từ vào nước nóng khoảng 50°C, nếu aspirin kết tủa lại thì cần đun nóng cho tan hết, để nguội dung dịch thu được đến nhiệt độ phòng, aspirin sẽ kết tinh dưới dạng tinh thể, lọc rồi sấy khô ở 50°C.
Phương pháp tinh chế được sử dụng ở trên là phương pháp kết tinh lại.
d) 1 mol aspirin hoặc 1 mol paracetamol đều phản ứng tối đa với 2 mol NaOH.
(Xem giải) Câu 25: Hợp chất hữu cơ X (mạch carbon không phân nhánh) chứa 3 nguyên tố C, H, O. Kết quả phân tích nguyên tố của hợp chất hữu cơ X có %mC = 64,61%; %mH = 10,77% còn lại là O. Cho biết phổ khối lượng, phổ hồng ngoại của X và số sóng hấp thụ đặc trưng trên phổ hồng ngoại của một số nhóm chức cơ bản như sau:
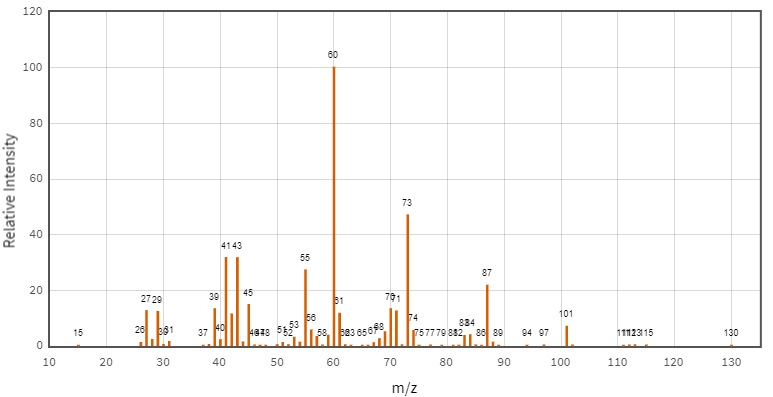

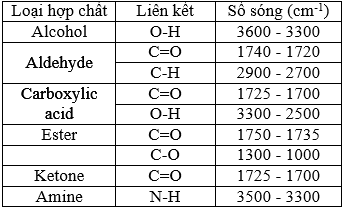
a) Phân tử X có nhóm -OH.
b) X thuộc loại hợp chất ester.
c) X hòa tan trong nước tốt hơn acetic acid.
d) X có phân tử khối là 130.
(Xem giải) Câu 26: Cellulose là thành phần chính tạo nên màng tế bào thực vật, làm nên bộ khung của cây. Thân cây, cành cây được dùng làm nguyên liệu để sản xuất đồ gỗ, sản xuất giấy,…
a) Cellulose có công thức (C6H10O5)n, phân tử cellulose cấu tạo từ nhiều đơn vị β-glucose qua liên kết β-1,4-glycoside và hình thành chuỗi không nhánh.
b) Hiện nay, xăng sinh học E5 (xăng chứa 5% ethanol về thể tích) đang được sử dụng ở nước ta để thay thế một phần xăng truyền thống. Trong một nhà máy, ethanol được sản xuất từ cellulose theo sơ đồ sau: Cellulose → Glucose → Ethanol. Toàn bộ lượng ethanol thu được từ 3,24 tấn mùn cưa (chứa 52% cellulose) pha chế được 15548 L xăng E5. Biết ethanol có khối lượng riêng là 0,8 g/mL, hiệu suất của cả quá trình sản xuất ethanol là 65%.
c) Cho 10 mL dung dịch H2SO4 70% vào cốc thủy tinh (dung tích 250mL), thêm một lượng nhỏ cellulose (bông) vào cốc và dùng đũa thủy tinh khuấy đều trong khoảng 1 phút thì thấy cellulose tan hết và thu được dung dịch đồng nhất.
d) Cellulose là chất rắn, dạng sợi, màu trắng, không tan trong nước ngay cả khi đun nóng nhưng tan trong nước Schweizer.
PHẦN III (3,6 điểm). Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 27 đến câu 32.
(Xem giải) Câu 27: Cho các phát biểu sau:
(1) Phản ứng cháy phosphine: 2PH3(g) + 4O2g) → P2O5(s) + 3H2O(l). Biết nhiệt tạo thành chuẩn của các chất cho trong bảng sau:
| Chất | PH3(g) | P2O5(s) | H2O(l) |
| 5,4 | -365,8 | -285,8 |
Biến thiên enthalpy chuẩn của phản ứng trên là -1234 kJ.
(2) Glucose là sản phẩm duy nhất của quá trình quang hợp.
(3) Nếu cho 0,3 mol khí hydrogen và 0,1 mol khí nitrogen vào một bình kín dung tích 0,5 L có bột Fe làm xúc tác, giữ bình ở nhiệt độ thích hợp để phản ứng tổng hợp ammonia xảy ra, khi phản ứng đạt tới trạng thái cân bằng có 20% lượng nitrogen chuyển hóa thành sản phẩm. Giá trị hằng số cân bằng của phản ứng Kc = 0,3617.
(4) Theo thuyết acid – base của Bronsted – Lowry, khi tan vào nước ammonia thể hiện tính base vì ammonia nhường proton cho nước.
(5) Ethanal và propanone đều phản ứng được với I2 trong môi trường kiềm tạo kết tủa iodoform.
Những nhận định sai là (theo thứ tự tăng dần)
(Xem giải) Câu 28: Trong công nghiệp người ta điều chế Al bằng phương pháp điện phân nóng chảy quặng bauxite (thành phần chính là Al2O3.2H2O) như mô hình sau:
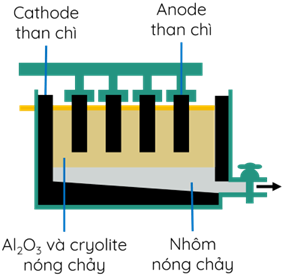
Để sản suất 54 tấn nhôm thì khối lượng anode bị tiêu hao m tấn. Biết rằng hỗn hợp khí thu được ở anode có 10% O2; 10% CO và 80% CO2 về thể tích. Giả sử hiệu suất của quá trình điện phân là 100%. Giá trị của m là (Kết quả làm tròn đến hàng đơn vị)
(Xem giải) Câu 29: Một nhóm học sinh muốn thử nghiệm phản ứng tráng bạc lên kính bằng nguyên liệu đầu là glucose. Giả sử lớp bạc có diện tích 100 cm² với độ dày 0,3 μm. Biết khối lượng riêng của bạc là 10,49 g/cm³, giả sử hiệu suất phản ứng tráng bạc là 87% (tính theo glucose). Khối lượng glucose (gam) cần dùng là (Kết quả làm tròn đến hàng phần trăm)
(Xem giải) Câu 30: Ephedrine được sử dụng với hàm lượng nhất định trong các loại thuốc điều trị cảm và dị ứng có công thức cấu tạo dưới đây:
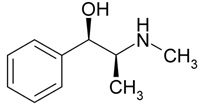
Ephedrine phản ứng được với bao nhiêu chất trong các chất sau đây: NaOH, HCl, Br2/H2O, BaCl2?
(Xem giải) Câu 31: Với người bình thường, trong dịch vị dạ dày, HCl có nồng độ 0,0001 – 0,001 mol/L và độ pH duy trì với giá trị từ 3 đến 4. Khi nồng độ acid HCl trong dịch vị dạ dày tăng có thể gây ra viêm loét dạ dày, tá tràng. Để giảm bớt nồng độ acid HCl trong dịch vị dạ dày người ta thường dùng thuốc chữa đau dạ dày có phần chính là NaHCO3.
Giả sử dịch vị dạ dày người bệnh chứa 1,6 L dung dịch hỗn hợp thức ăn lỏng, trong đó chứa 0,1095 gam HCl. Nếu khả năng tiêu thụ NaHCO3 của cơ thể người bệnh là 65% thì khối lượng NaHCO3 người đó cần đưa vào cơ thể để duy trì giá trị pH trong dạ dày bằng 3 là bao nhiêu gam? (Kết quả làm tròn đến hàng phần trăm).
(Xem giải) Câu 32: Cho các vật liệu polymer thuộc loại chất dẻo mô tả như hình dưới đây. Các polymer này có thể tái chế được, các kí hiệu này thường được in trên bao bì, vỏ hộp, đồ dùng,… để giúp nhận biết vật liệu polymer cũng như thuận lợi trong việc thu gom và tái chế.

(1) Sáu polymer trên đều là polymer nhiệt dẻo.
(2) Trong 6 polymer trên, có 2 polymer chứa 3 nguyên tố hóa học trong phân tử.
(3) Để hạn chế tình trạng ô nhiễm môi trường khi sử dụng đồ nhựa, cần thực hiện một số biện pháp sau: tái chế và tái sử dụng đồ nhựa đã dùng; hạn chế các loại bao bì nhựa túi nylon; mang theo túi đựng khi đi mua sắm; sử dụng vật liệu phân hủy sinh học; phân loại rác thải tại nguồn.
(4) Monomer dùng để tổng hợp HDPE, PP lần lượt là CH2=CH-CH3, CH2=CH2.
Những nhận định đúng là (theo thứ tự tăng dần)

