[2024 – 2025] Thi học sinh giỏi lớp 12 TP Hải Phòng (Đề minh họa)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 004-H12A năm 2024-2025
⇒ Thời gian làm bài: 90 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1B | 2C | 3B | 4B | 5D | 6B | 7B | 8B | 9C | 10C |
| 11B | 12C | 13A | 14A | 15C | 16A | 17B | 18D | 19B | 20A |
| Câu 21 | Câu 22 | Câu 23 | Câu 24 | Câu 25 | |
| (a) | Đ | Đ | Đ | S | Đ |
| (b) | Đ | S | S | Đ | S |
| (c) | Đ | S | Đ | S | Đ |
| (d) | S | Đ | S | Đ | S |
| 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 |
| 33,7 | 40% | 104,2 | 43,1 | 70,4 | 16,3 | 13,6 | 8,36 | 52,7 | 1017,6 |
PHẦN 1: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 20. Mỗi câu hỏi thí sinh chỉ lựa chọn một phương án.
(Xem giải) Câu 1. Nguyên tố R thuộc chu kì 3 và oxide cao nhất của một nguyên tố R thuộc nhóm A có dạng RO3. Số electron trong nguyên tử R là
A. 8. B. 16. C. 15. D. 14
(Xem giải) Câu 2. Đồ thị biểu diễn đường cong động học của phản ứng giữa oxygen và hydrogen tạo thành nước: O2(g) + 2H2(g) → 2H2O(g).
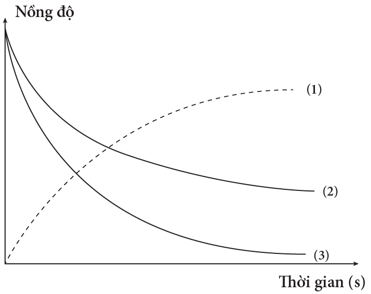
Đường cong nào của hydrogen?
A. Đường cong số (1). B. Đường cong số (2).
C. Đường cong số (3). D. Đường cong số (2) hoặc (3) đều đúng.
(Xem giải) Câu 3. Trong một bình kín tồn tại cân bằng hóa học sau:
2NO2(g) (màu nâu đỏ) ⇋ N2O4(g) (không màu)
Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có
A. ΔH > 0, phản ứng tỏa nhiệt. B. ΔH < 0, phản ứng tỏa nhiệt.
C. ΔH > 0, phản ứng thu nhiệt. D. ΔH < 0, phản ứng thu nhiệt.
(Xem giải) Câu 4. Cho phản ứng hydrogen hoá ethylene sau: H2C=CH2(g) + H2(g) → H3C-CH3(g) Biết năng lượng liên kết trong các chất cho trong bảng sau:
| Liên kết | Phân tử | Eb (kJ/mol) | Liên kết | Phân tử | Eb (kJ/mol) |
| C=C | C2H4 | 612 | C-C | C2H6 | 346 |
| C-H | C2H4 | 418 | C-H | C2H6 | 418 |
| H-H | H2 | 436 |
Biến thiên enthalpy (kJ) của phản ứng có giá trị là
A. 134. B. -134. C. 478. D. 284.
(Xem giải) Câu 5. Thực hiện phản ứng tổng hợp ammonia: N2 + 3H2 ⇋ 2NH3.
Nồng độ mol ban đầu của các chất như sau: N2 (1 mol/l); H2 (1,2 mol/l). Khi phản ứng đạt cân bằng nồng độ mol của [NH3] = 0,2 mol/l. Hiệu suất của phản ứng tổng hợp ammonia là
A. 43%. B. 10%. C. 30%. D. 25%.
(Xem giải) Câu 6. Dẫn từ từ khí chlorine qua bình đựng KI dư có chứa sẵn hồ tinh bột. Hiện tượng quan sát được là
A. Dung dịch hiện màu vàng. B. Dung dịch hiện màu xanh tím.
C. Dung dịch có màu trắng. D. Có kết tủa màu vàng nhạt.
(Xem giải) Câu 7. Magnesium kim loại đóng vai trò rất quan trọng trong công nghiệp ô tô, máy bay và đặc biệt các con tàu vũ trụ. Một nguồn magnesium quan trọng được lấy từ nước biển bằng cách cho nước biển tác dụng với vôi sữa (Ca(OH)2), lọc kết tủa Mg(OH)2, hòa tan trong dung dịch HCl, lấy MgCl2 khan và điện phân nóng chảy. Cho biết trong 1 lít nước biển có 1350 mg Mg. Hỏi từ 1000 m³ nước biển có thể điều chế được bao nhiêu tấn Mg? Biết hiệu suất của cả quá trình điều chế là 70%
A. 0,752 tấn. B. 0,945 tấn. C. 0,480 tấn. D. 1,350 tấn
(Xem giải) Câu 8. Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphthalein.
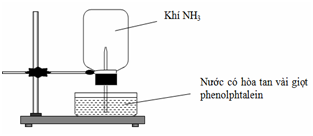
Hiện tượng xảy ra trong thí nghiệm là
A. Nước phun vào bình và chuyển thành màu xanh
B. Nước phun vào bình và chuyển thành màu hồng
C. Nước phun vào bình và không có màu
D. Nước phun vào bình và chuyển thành màu tím
(Xem giải) Câu 9. Một mẫu nước thải của nhà máy sản xuất có pH = 4. Để thải ra ngoài môi trường thì cần phải tăng pH lên từ 5,8 đến 8,6 (theo đúng quy định). Nhà máy phải dùng vôi sống thả vào nước thải, khối lượng vôi sống cần dùng cho 1 m³ nước để tăng pH từ 4 lên 7 là (Bỏ qua sự thủy phân của các muối nếu có)
A. 0,56 gam. B. 56 gam. C. 2,8 gam. D. 560 gam.
(Xem giải) Câu 10. Hòa tan hết 15 gam hỗn hợp X gồm C và S trong dung dịch H2SO4 đặc, nóng, dư thu được 42 lít hỗn hợp khí Y gồm CO2 và SO2 (ở đktc). Cho lượng Y trên hấp thụ hết vào dung dịch Z chứa 1,25 mol KOH và 0,75 mol NaOH, thu được dung dịch chứa m gam chất tan. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 198,48 gam. B. 179,47 gam. C. 212,75 gam. D. 234,06 gam.
(Xem giải) Câu 11: Ethyl propionate là ester có mùi thơm của quả dứa. Công thức của ethyl propionate là
A. HCOOC2H5. B. C2H5COOC2H5. C. C2H5COOCH3. D. CH3COOCH3.
(Xem giải) Câu 12: Bộ dụng cụ chiết (được mô tả như hình vẽ) dùng để
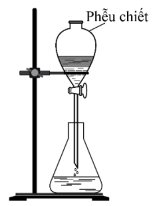
A. tách hai chất rắn tan trong dung dịch.
B. tách hai chất lỏng tan tốt vào nhau.
C. tách hai chất lỏng không tan vào nhau.
D. tách chất lỏng và chất rắn.
(Xem giải) Câu 13: Alcohol chứa liên kết O-H có số sóng hấp phụ trong khoảng 3500- 3200 cm-1. Cho phổ IR của benzyl alcohol:
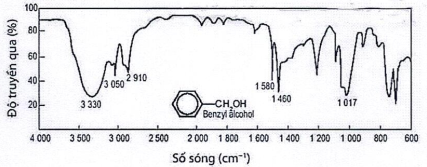
Peak đặc trưng với số sóng tương ứng của nhóm O-H trên phổ IR của benzyl alcohol là
A. 3330. B. 3050. C. 1580. D. 1460.
(Xem giải) Câu 14: Hợp chất 2,4,6-trinitrotoluene (thường gọi là TNT) là chất nổ đã từng được sử dụng phổ biến nhất trong quân sự, khai thác mỏ. Khi nổ 1 kg TNT có thể tạo ra năng lượng vào khoảng 4,18kJ. Tại các mỏ đá, để khai thác được 1 m³ đá trung bình cần năng lượng khoảng 5kJ. Khối lượng TNT cần để khai thác được 50m³ đá là
A. 59,8 kg. B. 41,8 kg. C. 56,3 kg. D. 47,9 kg.
(Xem giải) Câu 15: Ester nào sau đây tác dụng với dung dịch NaOH thu được hai sản phẩm đều có phản ứng tráng gương?
A. HCOOCH3. B. HCOOC(CH3)=CH2. C. HCOOCH=CH2. D. HCOOC2H5.
(Xem giải) Câu 16: Cho sơ đồ chuyển hóa:
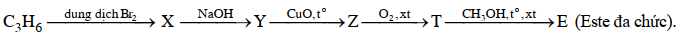
Tên gọi của Y là
A. Propane-1,3-diol. B. Propane-1,2-diol. C. Propane-2-ol. D. Glycerol.
(Xem giải) Câu 17: Từ m gam tinh bột điều chế được 575 ml dung dịch ethanol 10° (khối lượng riêng của ethanol là 0,789 gam/mL) với hiệu suất cả quá trình là 75%, giá trị của m là
A. 60,750 gam. B. 106,515 gam. C. 75,938 gam. D. 59,915 gam.
(Xem giải) Câu 18: Trong thực tế hiện nay, nước tương (xì dầu) được sản xuất từ một số nguồn nguyên liệu như xương động vật (trâu, bò, heo), bánh dầu đậu nành, đậu phộng (lạc). Đặc biệt có nơi còn làm nước tương từ lông gà, lông vịt để được giá thành rẻ. Độc chất 3-MCPD ( 3-monochloropropane-1,2-diol) có mặt trong nước tương với hàm lượng vượt quá 1 mg/kg có thể gây bệnh ung thư cho người tiêu dùng. Phương pháp sản xuất nước tương nào sau đây là không an toàn vì chứa chất 3-MCPD vượt quá hàm lượng cho phép?
A. Thủy phân bánh đậu phộng, đậu nành bằng acid photphoric.
B. Sản xuất theo phương pháp lên men đậu xanh, đậu nành.
C. Cho acid clohidric nồng độ thấp phản ứng với chất béo trong nguồn nguyên liệu (xương động vật, đậu nành, đậu phộng,…) để thủy phân ra acid đạm.
D. Cho acid clohidric nồng độ cao phản ứng với chất béo trong nguồn nguyên liệu (xương động vật, đậu nành, đậu phộng,…) để thủy phân ra acid đạm.
(Xem giải) Câu 19: Cho phương trình hoá học: aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O. Hệ số tỉ lượng a, b, c, d, e là những số nguyên dương có tỉ lệ tối giản. Tổng (a + b) bằng
A. 3. B. 5. C. 4. D. 6.
(Xem giải) Câu 20. Trộn 20 mL ethanol với 20 mL acetic acid, thêm 10 mL H2SO4 đặc rồi tiến hành phản ứng ester hoá. Sau một thời gian, thu được 17,6 gam ester. Tính hiệu suất phản ứng ester, biết khối lượng riêng của ethanol và acetic acid lần lượt là 0,789 g/mL và 1,05 g/mL.
A. 58,31%. B. 50,38%. C. 57,14% D. 51,47%
PHẦN 2: Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 21 đến câu 25. Mỗi mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 21. Các nguyên tố phổ biến thuộc nhóm halogen (VIIIA) trong bảng tuần hoàn các nguyên tố hóa học gồm: F (Z = 9), Cl (Z = 17), Br (Z = 35) và I (Z = 53). Đơn chất halogen tồn tại dạng phân tử X2, giữa các phân tử X2 thường có tương tác với nhau. Cho giá trị năng lượng liên kết X − X ở bảng sau:
| Liên kết | F-F | Cl-Cl | Br-Br | I-I |
| Năng lượng liên kết (kJ/mol) ở 25°C và 1 bar | 159 | 243 | 193 | 151 |
a. Cấu hình electron lớp ngoài cùng của nguyên tử X có dạng ns2 np5.
b. Liên kết giữa các nguyên tử trong X2 là liên kết cộng hoá trị không phân cực.
c. Tương tác giữa các phân tử X2 là tương tác van der Waals.
d. Năng lượng liên kết Cl – Cl lớn nhất trong dãy trên vì Cl có bán kính nguyên tử nhỏ nhất.
(Xem giải) Câu 22. Sulfur dioxide (SO2) là chất gây ô nhiễm chính do các nhà máy nhiệt điện sử dụng nhiên liệu than thải ra. Khí SO2 được giải phóng bởi một nhà máy nhiệt điện, nó có thể bị giữ lại do phản ứng với MgO và O2 trong ống khói để tạo thành MgSO4. Nếu một nhà máy nhiệt điện thải ra 140 tấn SO2 mỗi ngày thì khối lượng MgO cần phải cung cấp để loại bỏ hết lượng SO2 là m tấn.
a. Khí SO2 không màu, rất độc, mùi hắc.
b. Thành phần chủ yếu của nhiên liệu than đá là sulfur.
c. Phản ứng hóa học xảy ra ở trên không thuộc loại phản ứng oxi hóa khử.
d. Giá trị của m bằng 87,5 tấn.
(Xem giải) Câu 23: Ester X có công thức C12H2O4. Từ X thực hiện các phản ứng (theo đúng tỉ lệ mol):
(1) X + 3NaOH → X1 + X2 + X3 + H2O
(2) 2X1 + H2SO4 → 2X4 + Na2SO4
(3) X3 + X4 ⇋ X6 + H2O (xúc tác H2SO4 đặc)
(4) nX6 (t°, xt, P) → thủy tinh hữu cơ
(5) X2 + 2HCl → X5 + 2NaCl
a. Phân tử khối của X5 bằng 138.
b. 1 mol X3 tác dụng hết với Na thu được 1 mol H2.
c. Khi đốt cháy hoàn toàn 1 mol X2 cho 6 mol CO2.
d. Các chất X5 và X4 đều là hợp chất đa chức.
(Xem giải) Câu 24. Dựa vào sơ đồ biểu diễn biến thiên enthalpy:
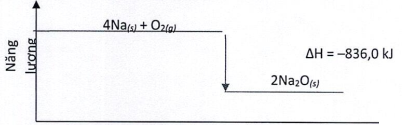
a. Phản ứng trên không thuận lợi về mặt năng lượng.
b. Biến thiên enthalpy chuẩn của phản ứng là –836 kJ.
c. Nhiệt tạo thành chuẩn của Na2O(s) là +418 kJ/mol.
d. Nếu cho 23 gam Na phản ứng thì nhiệt lượng phản ứng toả ra là 209 kJ.
(Xem giải) Câu 25. Bình gas loại 12 kg chứa chủ yếu thành phần chính là propane, butane (tỉ lệ thể tích tương ứng là 30 : 70). Để tạo mùi cho khí gas, nhà sản xuất đã pha trộn thêm chất tạo mùi đặc trưng như CH3SH (mùi tỏi, hành tây). Lượng nhiệt tỏa ra khi đốt cháy hoàn toàn 1 mol propane và 1 mol butane lần lượt là 2220 kJ và 2874 kJ; giả sử một hộ gia đình cần 6000 kJ nhiệt mỗi ngày (hiệu suất hấp thụ nhiệt 60%). Cho phát biểu sau:
a. Mục đích của việc thêm CH3SH để giúp phát hiện khí gas khi bị rò rỉ.
b. Tỉ lệ khối lượng propane : butane trong bình gas là 50 : 50.
c. Nhiệt lượng hộ gia đình trên thực tế tiêu tốn mỗi ngày là 10000 kJ.
d. Hộ gia đình trên sử dụng hết một bình gas trong 99,5 ngày.
PHẦN 3. Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 26 đến câu 35.
(Xem giải) Câu 26. Trong công nghiệp người ta sản xuất nitric acid theo sơ đồ chuyển hóa sau: NH3 → NO → NO2 → HNO3. Để điều chế 200 tấn nitric acid có nồng độ 60% cần dùng bao nhiêu tấn ammonia? Biết rằng hiệu suất của phản ứng sản xuất nitric acid theo sơ đồ trên là 96,2%. (làm tròn kết quả đến hàng phần mười)
(Xem giải) Câu 27. Hỗn hợp X gồm SO2 và O2 có tỉ khối so với H2 bằng 28. Cho 4,48 lít X (đktc) đi qua bình đựng V2O5 nung nóng. Hỗn hợp thu được cho lội qua dung dịch Ba(OH)2 dư thấy có 33,19 gam kết tủa. Hiệu suất phản ứng oxi hóa SO2 thành SO3 là bao nhiêu?
(Xem giải) Câu 28. Để tạo ra các tấm gương soi, người ta tiến hành tráng bạc lên các tấm kính. Trung bình mỗi tấm kính cần tráng khoảng 0,05 gam Ag. Giả sử dùng glucose để thực hiện phản ứng tráng bạc. Muốn làm được 1500 tấm gương trên cần dùng hết bao nhiêu gam glucose? Biết rằng hiệu suất phản ứng tráng bạc là 60%. (Làm tròn kết quả đến hàng phần mười)
(Xem giải) Câu 29. Trong thực tế hiện nay, túi nilon làm từ polyethylene được sử dụng rất nhiều với các kích cỡ khác nhau. Tuy nhiên, nếu không phân loại rác tốt thì túi nilon sẽ gây ô nhiễm môi trường do chúng rất bền và khó bị phân hủy ở điều kiện thường. Cứ 2,8 gam polyethylene có thể sản xuất được 20 chiếc túi nilon loại 5 cân. Để sản xuất được 200000 chiếc túi nilon loại này cần bao nhiêu kg ethylene đem trùng hợp tạo polyethylene với hiệu suất của phản ứng trùng hợp là 65%? (làm tròn kết quả đển hàng phần mười)
(Xem giải) Câu 30. Hiện nay một số bạn trẻ, chỉ vì thích thể hiện bản thân mà đã đua đòi tập hút thuốc lá và thuốc lá điện tử. Các công trình nghiên cứu khoa học đã chỉ ra rằng trong khói thuốc lá có tới hơn 4 nghìn loại hóa chất khác nhau trong đó có hơn 200 loại chất rất có hại cho sức khỏe của con người, tiêu biểu là chất nicotine, methanol, khí carbon monoxide và một số chất có thể gây ung thư. Trong đó, trung bình trong một điếu thuốc lá chứa khoảng 82,8 mg methanol. Khối lượng methanol (mg) trong một điếu thuốc lá được cơ thể hấp thụ là bao nhiêu? Giả sử hiệu suất hấp thụ của cơ thể là 85%. (làm tròn kết quả đến hàng phần mười)
(Xem giải) Câu 31. Hỗn hợp X gồm ba ester mạch hở đều được tạo bởi carboxylic acid với alcohol no, mạch hở trong đó có hai ester đơn chức và một ester hai chức. Đốt cháy hoàn toàn 4,54 gam X trong O2, thu được H2O và 0,19 mol CO2. Mặt khác, cho 4,54 gam X phản ứng vừa đủ với dung dịch NaOH, thu được hỗn hợp Y gồm hai alcohol đồng đẳng kế tiếp và dung dịch chứa 4,04 gam hỗn hợp muối. Đun nóng toàn bộ Y với H2SO4 đặc, thu được tối đa 2,36 gam hỗn hợp ba ether. Phần trăm khối lượng của ester có phân tử khối nhỏ nhất trong X là bao nhiêu? (làm tròn kết quả đến hàng phần mười)
(Xem giải) Câu 32. Theo quy định nồng độ cho phép của bromine trong không khí là 2.10^-5 g/L. Trong một phân xưởng sản xuất bromine, người ta đo được nồng độ của bromine là 1.10^-4 g/L. Khối lượng dung dịch (theo kg) ammonia 20% phun khắp xưởng đó (có kích thước 100m × 200m × 6m) để khử độc hoàn toàn lượng bromine trong không khí là bao nhiêu? Biết rằng 8NH3 + 3Br2 → N2 + 6NH4Br. Các chất khí đo ở điều kiện chuẩn.
(Xem giải) Câu 33. Người ta pha loãng m gam oleum H2SO4.4SO3 vào nước thành 1,0 lít dung dịch sulfuric acid, sau đó tiến hành chuẩn độ mỗi 10,0 ml dung dịch acid này bằng dung dịch NaOH 0,10 M. Thể tích dung dịch NaOH trung bình cần sử dụng để chuẩn độ là 20,01 ml. Giá trị của m là bao nhiêu?
(Xem giải) Câu 34. Cho 11 gam hỗn hợp X gồm hai ester đơn chức, mạch hở A và B tác dụng hết với 200 gam dung dịch KOH 5,6% đun nóng, thoát ra hỗn hợp alcohol Y đồng đẳng kế tiếp, cô cạn dung dịch thì thu được m gam chất rắn khan. Cho Y đi qua bình Na dư thì khối lượng bình tăng 5,35 gam và có 1,85925 lít khí thoát ra ở đkc. Mặt khác, 16,5 gam X làm mất màu tối đa a gam bromine. Giá trị (m + a) là bao nhiêu?
(Xem giải) Câu 35. Acetic acid được sử dụng rộng rãi để điều chế polymer, tổng hợp hương liệu,… Acetic acid được tổng hợp từ nguồn khí than đá (giá thành rẻ) theo các phản ứng sau:
CO + 2H2 → CH3OH (1)
CH3OH + CO → CH3COOH (2)
Giả sử hiệu suất của các phản ứng (1) và (2) đều đạt 90%. Để sản xuất 1000 lít acetic acid (D = 1,05 g/ml) cần thể tích CO (đo ở điều kiện chuẩn) là bao nhiêu m³? (làm tròn kết quả đến hàng phần mười)


Bình luận