[2025 – 2026] Thi học sinh giỏi lớp 12 – Tỉnh Quảng Ninh
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề 014-H12B năm 2025-2026
⇒ Thời gian làm bài: 180 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1D | 2D | 3B | 4C | 5C | 6A | 7A | 8B | 9B |
| 10C | 11C | 12C | 13D | 14C | 15B | 16C | 17A | 18A |
| 19 | 20 | 21 | 22 | 23 | 24 | |||
| ĐSĐĐ | ĐSSS | ĐĐĐS | ĐSSS | 2,5 | 0,09 | |||
PHẦN I. TRẮC NGHIỆM (6,0 điểm)
Trắc nghiệm nhiều lựa chọn (2,7 điểm). Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Deuterium (D) là một đồng vị của hydrogen, được ứng dụng trong các lĩnh vực hạt nhân. Ion nào sau đây có số electron nhiều hơn số proton và số proton nhiều hơn số neutron (Biết H = 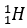 ; D =
; D = 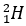 ; O =
; O = 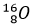 )?
)?
A. D-. B. H3O+. C. OD-. D. OH-.
(Xem giải) Câu 2. X, Y, Z, T là các nguyên tố khác nhau trong số bốn nguyên tố: ₁₁Na, ₁₂Mg, ₁₃Al, ₁₉K. Cho bảng bán kính nguyên tử (nm) của chúng như sau:
| Nguyên tố | X | Y | Z | T |
| Bán kính nguyên tử (nm) | 0,125 | 0,203 | 0,136 | 0,157 |
Nhận xét nào sau đây đúng?
A. X là Na, Z là Al. B. Z là Al, T là Mg. C. X là Na, Y là K. D. Y là K, T là Na.
(Xem giải) Câu 3. Ở điều kiện thường các hydrogen halide tồn tại ở thể khí, tan tốt trong nước tạo thành hydrohalic acid tương ứng. Cho bảng nhiệt độ sôi (t°s) của các hydrogen halide như sau:
| Hydrogen halide | X | Y | Z | T |
| ts (°C) | -84,9 | +19,5 | -35,8 | -66,7 |
Hãy cho biết T là chất nào dưới đây?
A. HF. B. HBr. C. HCl. D. HI.
(Xem giải) Câu 4. Nhiều tai nạn giao thông xảy ra do lạm dụng rượu bia. Hiện nay nhiều quốc gia, trong đó có Việt Nam nghiêm cấm sử dụng rượu, bia khi điều khiển các phương tiện giao thông và xử phạt nghiêm khắc đối với những người vi phạm. Một đơn vị cồn tương đương 10 mL ethanol nguyên chất. Theo khuyến cáo của ngành y tế, để đảm bảo sức khoẻ của người trưởng thành không nên uống quá 2 đơn vị cồn mỗi ngày. Vậy mỗi người trưởng thành không nên uống quá bao nhiêu mL rượu 40° mỗi ngày? (biết độ rượu bằng số mL ethanol nguyên chất trong 100 mL dung dịch ethanol)
A. 200 mL. B. 100 mL. C. 50 mL. D. 80 mL.
(Xem giải) Câu 5. Phản ứng hạt nhân là phản ứng có sự biến đổi ở hạt nhân nguyên tử (thành phần hạt nhân, năng lượng hạt nhân). Các tia bức xạ trong phản ứng hạt nhân gồm: Dòng hạt α (hạt nhân nguyên tử ⁴₂He) mang điện tích dương, dòng hạt β là hạt ⁰₋₁e mang điện tích âm, dòng hạt γ không mang điện. Tất cả các phản ứng hạt nhân đều tuân theo định luật bảo toàn số khối và điện tích. Cho phản ứng hạt nhân sau:
¹⁰₅B + ᴬₙX → ⁸₄Be + α
X là nguyên tử nào sau đây?
A. ⁴₂He. B. ¹₁H. C. ²₁H. D. ³₂He.
(Xem giải) Câu 6. Lactic acid hay acid sữa là hợp chất hoá học đóng vai trò quan trọng trong nhiều quá trình sinh hoá, lần đầu tiên được phân tách vào năm 1780 bởi nhà hoá học Thụy Điển Carl Wilhelm Scheele. Lactic acid có công thức phân tử C3H6O3, công thức cấu tạo CH3-CH(OH)-COOH. Khi vận động mạnh cơ thể không đủ cung cấp oxygen, thì cơ thể sẽ chuyển hoá glucose thành lactic acid từ các tế bào để cung cấp năng lượng cho cơ thể (lactic acid tạo thành từ quá trình này sẽ gây mỏi cơ) theo phương trình sau: C6H12O6(aq) → 2C3H6O3(aq)  = -150 kJ
= -150 kJ
Biết rằng cơ thể chỉ cung cấp 98% năng lượng nhờ oxygen, năng lượng còn lại nhờ vào sự chuyển hoá glucose thành lactic acid. Giả sử một người chạy bộ trong một thời gian tiêu tốn 300 kcal. Khối lượng lactic acid tạo ra từ quá trình chuyển hoá đó là bao nhiêu? (biết 1 cal = 4,184 J) (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến hàng phần mười.)
A. 30,1. B. 35,1. C. 31,5. D. 30,8.
(Xem giải) Câu 7. Cho sơ đồ phổ hồng ngoại IR của chất X như sau:
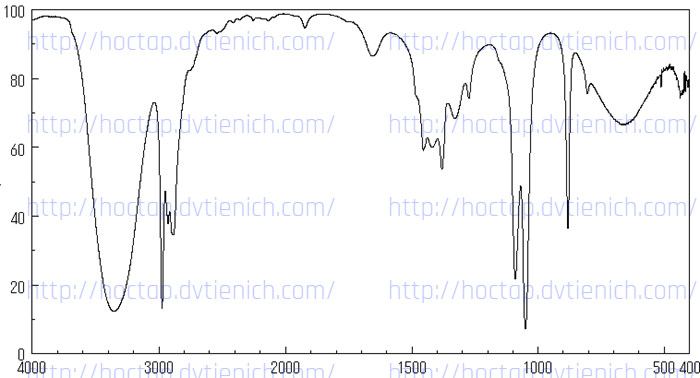
X là chất nào sau đây?
A. CH3CH2OH. B. CH3COOH. C. CH3CHO. D. CH3COOCH3.
(Xem giải) Câu 8. Trong các phản ứng hữu cơ thường có sự tạo thành các tiểu phân trung gian hoạt động như gốc tự do, carbanion, carbocation. Carbocation là ion mang điện tích dương trên nguyên tử carbon. Có bao nhiêu carbocation trong số các tiểu phân (CH3)3C⁺, (CH3)2C⁻H, •CH3 và (CH3)2C⁺H?
A. 3. B. 2. C. 1. D. 4.
(Xem giải) Câu 9. Cho các nhận định sau:
a) Alcohol là hợp chất hữu cơ có nhóm -OH liên kết trực tiếp với nguyên tử carbon.
b) C6H5OH là hợp chất không thuộc loại alcohol.
c) Phenol tham gia phản ứng thế (thế halogen, thế nitro,…) dễ hơn so với benzene.
d) Các alcohol tạo được liên kết hydrogen với nhau nên nhiệt độ sôi của alcohol tương đối cao.
Số nhận định đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 10. Formic acid có trong nọc kiến, nọc ong, sâu róm. Nếu không may bị ong đốt thì nên bôi vào vết ong đốt loại chất nào sau đây là tốt nhất?
A. Kem đánh răng. B. Xà phòng. C. Vôi. D. Giấm.
(Xem giải) Câu 11. Aspirin là một trong những loại thuốc giảm đau, hạ sốt được sử dụng rộng rãi trên toàn thế giới. Aspirin có công thức cấu tạo như sau:
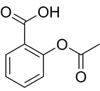
Trong điều kiện ẩm ướt, aspirin có thể bị thủy phân để tạo thành salicylic acid và acetic acid. Công thức cấu tạo nào sau đây là của salicylic acid?
A. C6H5COOH. B. o-HOOCC6H4COOH. C. o-HOC6H4COOH. D. m-HOC6H4COOH.
(Xem giải) Câu 12. Xà phòng được sản xuất bằng phản ứng thuỷ phân chất béo trong môi trường kiềm hoặc sản xuất từ dầu mỏ. Xà phòng được dùng để tắm, rửa tay… Có bao nhiêu chất có thể sử dụng làm thành phần chủ yếu của xà phòng: CH3[CH2]14COONa (1), CH3[CH2]10CH2OSO3Na (2), CH3[CH2]11C6H4SO3Na (3), CH3[CH2]16COOK (4), (C17H33COO)3C3H5 (5), CH3CH(CH3)CH2COONa (6)?
A. 3. B. 1. C. 2. D. 4.
(Xem giải) Câu 13. Hình bên mô tả bộ dụng cụ trong phòng thí nghiệm dùng để điều chế và thử tính chất hóa học của khí Y sinh ra từ phản ứng của hợp chất X với nước. Biết rằng, khi kết thúc thí nghiệm bình đựng dung dịch AgNO3 trong NH3 xuất hiện kết tủa màu vàng nhạt.
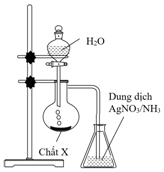
Khí Y là khí nào sau đây?
A. C2H4. B. C2H6. C. CH4. D. C2H2.
(Xem giải) Câu 14. Trong phương pháp nấu rượu gạo truyền thống, gạo được nấu chín, để nguội, rắc men rồi trộn đều, ủ kín 3 – 5 ngày. Khi ngửi thấy mùi thơm, thêm nước và ủ kín 1 – 2 tuần, thu được hỗn hợp chủ yếu gồm: ethanol, nước và bã rượu. Để tách rượu (hỗn hợp ethanol và nước) ra khỏi hỗn hợp trên, người ta sử dụng phương pháp nào sau đây là phù hợp nhất?
A. Kết tinh. B. Chiết. C. Chưng cất. D. Lọc.
(Xem giải) Câu 15. Sử dụng 1 tạ chất béo trung tính chứa 65% tristearin, còn lại là tripalmitin về khối lượng để sản xuất xà phòng. Loại xà phòng tạo ra này chứa 72% là muối potassium của acid béo, còn lại là các chất phụ gia như: tạo màu, tạo hương thơm, tạo bọt, tạo độ rắn… Biết mỗi bánh xà phòng theo tiêu chuẩn phải nặng 125 gam. Số bánh xà phòng thu được là (Kết quả các phép tính trung gian không được làm tròn.)
A. 1210 bánh. B. 1209 bánh. C. 626 bánh. D. 627 bánh.
(Xem giải) Câu 16. Một nonapeptide được sản sinh từ huyết thanh trong máu, có thể bị thuỷ phân hoàn toàn trong môi trường acid để tạo ra 3 phân tử Pro, 2 phân tử Arg, 2 phân tử Phe, 1 phân tử Ser và 1 phân tử Gly. Xử lí bằng enzyme chymotrypsin tạo ra pentapeptide Arg-Pro-Pro-Gly-Phe, tripeptide Ser-Pro-Phe và Arg. Phân tích nhóm đầu và nhóm cuối của peptide cho thấy các amino acid đều giống nhau. Amino acid thứ 4 tính từ amino acid đầu N là chất nào sau đây?
A. Arg. B. Pro. C. Gly. D. Ser.
(Xem giải) Câu 17. Polymer X được sử dụng để sản xuất túi nylon, bao gói, màng bọc thực phẩm, chai lọ, đồ chơi trẻ em… tuy nhiên khi thải ra môi trường thì cần rất nhiều thời gian để phân hủy. Cho biết 1 đoạn mạch của X có cấu tạo như sau: -CH2-CH2-CH2-CH2-CH2-CH2-
X có phân tử khối là 14840 (amu). Số mắt xích của X là
A. 530. B. 1060. C. 265. D. 353.
(Xem giải) Câu 18. Polycaproamide và polyacrylonitrile đều là các polymer có nhiều ứng dụng trong thực tế cuộc sống như dệt vải may mặc, dệt áo len… Cho các phát biểu sau về polycaproamide và polyacrylonitrile:
(a) Cả hai loại đều dùng để sản xuất tơ.
(b) Polyacrylonitrile được điều chế bằng phản ứng trùng ngưng.
(c) Polycaproamide dùng để sản xuất tơ capron thuộc loại polypeptide.
(d) Hai polymer đều có phản ứng phân hủy mạch trong môi trường kiềm.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Trắc nghiệm đúng/sai (2,4 điểm). Thi sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) của mỗi câu, thi sinh chi chọn đúng hoặc sai.
(Xem giải) Câu 19. Hình vẽ minh họa điều chế isoamyl acetate trong phòng thí nghiệm:
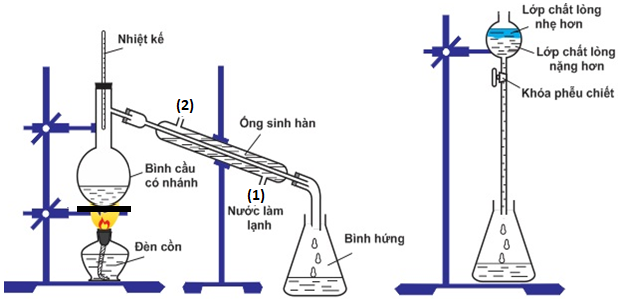
a) Hỗn hợp chất lỏng trong bình cầu gồm isoamyl alcohol, acetic acid và sulfuric acid đặc.
b) Trong phễu chiết lớp chất lỏng nặng hơn có thành phần chính là isoamyl acetate.
c) Nhiệt kế dùng để kiểm soát nhiệt độ trong bình cầu.
d) Để tách các chất lỏng không tan vào nhau ra khỏi nhau người ta sử dụng phương pháp chiết.
(Xem giải) Câu 20. Trong quy trình sản xuất sulfuric acid (H2SO4) có giai đoạn dùng dung dịch H2SO4 98% hấp thụ sulfur trioxide (SO3) thu được oleum (H2SO4.nSO3). Sulfur trioxide được tạo thành bằng cách oxi hóa sulfur dioxide bằng oxygen hoặc lượng dư không khí ở nhiệt độ 450 – 500 °C, chất xúc tác vanadium(V) oxide (V2O5) theo phương trình hóa học:
2SO2(g) + O2(g) ⇌ 2SO3(g) ![]() < 0 (điều kiện phản ứng: 450 – 500°C, V2O5)
< 0 (điều kiện phản ứng: 450 – 500°C, V2O5)
a) Ở phản ứng trên, sulfur dioxide đóng vai trò là chất khử.
b) Mục đích dùng lượng dư không khí để phản ứng xảy ra hoàn toàn.
c) Dùng dung dịch H2SO4 98% hấp thụ sulfur trioxide (SO3) thu được oleum (H2SO4.nSO3) và làm cho cân bằng chuyển dịch theo chiều thuận.
d) Phản ứng trên là phản ứng tỏa nhiệt. Vì vậy, để cân bằng chuyển dịch theo chiều thuận cần tăng nhiệt độ của hệ.
(Xem giải) Câu 21. Cho các phương trình hóa học sau:
(1) X + Y → Z + A↑ + B
(2) NaOH + Y → Z + B
(3) Ba(OH)2 + Z → C↓ + 2NaOH
(4) Ba(OH)2 + Y → C↓ + NaOH + B
Biết X, Y là hợp chất của sulfur, có cùng thành phần nguyên tố và MX + MY = 224. Các phản ứng xảy ra theo đúng tỉ lệ mol.
a) Khí A là nguyên nhân gây ra hiện tượng mưa acid.
b) Kết tủa C bền với nhiệt, không tan trong dung dịch HCl.
c) X tác dụng với dung dịch HCl tạo ra khí A có khả năng làm mất màu dung dịch nước bromine.
d) Dung dịch chứa Z hoặc X đều làm quỳ tím hóa đỏ.
(Xem giải) Câu 22. Nguyên tố X tích luỹ trong tế bào thực vật nên rau và trái cây tươi là nguồn cung cấp tốt nguyên tố X cho cơ thể. Các nghiên cứu chỉ ra khẩu phần ăn chứa nhiều X có thể giảm nguy cơ cao huyết áp và đột quỵ. Nguyên tố T được dùng để chế tạo dược phẩm, phẩm nhuộm và chất nhạy với ánh sáng. X thuộc loại nguyên tố s, nguyên tử X chỉ có 7 electron ở phân lớp s, nguyên tử T có 17 electron ở phân lớp p. X và T tạo được hợp chất A.
a) Nguyên tử X và T ở trạng thái cơ bản đều có 1 electron độc thân.
b) Công thức phân tử hợp chất A là XT2.
c) Hợp chất A ở trạng thái rắn có khả năng dẫn điện tốt.
d) Cho hợp chất A tác dụng với dung dịch AgNO3 cho kết tủa màu trắng.
Trắc nghiệm trả lời ngắn (0,9 điểm). Thí sinh trả lời từ câu 23 đến câu 24.
(Xem giải) Câu 23. Một nhà máy sản xuất túi nylon từ HDPE cần sản xuất túi đựng hình chữ nhật có kích thước là 30 cm x 50 cm, bề dày của lớp nylon là 0,005 cm. Biết hiệu suất phản ứng trùng hợp ethylene để điều chế HDPE là 60%, quá trình chuyển nhựa thành túi có hiệu suất là 95% và biết khối lượng riêng của nhựa HDPE là 0,95 g/cm³. Khối lượng nguyên liệu ethylene dùng để sản xuất đơn hàng 100.000 túi này là bao nhiêu tấn? (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến hàng phần mười.)
(Xem giải) Câu 24. Xét phản ứng của acetone với iodine: CH3COCH3 + I2 → CH3COCH2I + HI
Ở nhiệt độ 30°C phản ứng có tốc độ là 0,03 mol/(L.h); ở nhiệt độ 50°C phản ứng có tốc độ là 0,27 mol/(L.h). Cho biết tốc độ phản ứng trên ở nhiệt độ 40°C? Biết tốc độ phản ứng tuân theo hệ số nhiệt độ Van’t Hoff. (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến hàng phần trăm.)
PHẦN II. TỰ LUẬN (14,0 điểm)
Câu 1. (2,0 điểm)
(Xem giải) 1. Nhôm (Al) là kim loại màu trắng bạc, có nhiều ứng dụng trong thực tiễn như sản xuất dây dẫn điện, chế tạo hợp kim duralumin nhẹ, bền sử dụng làm vỏ máy bay, tên lửa… Ở 20°C, tinh thể Al có khối lượng riêng 2,72 gam/cm³. Al có nguyên tử khối là 27 amu. Biết rằng trong tinh thể, nguyên tử Al là các quả cầu chiếm 74% thể tích, còn lại là khe trống. Số Avogadro (NA) có giá trị là 6,02.10²³; π = 3,14. Hãy tính bán kính nguyên tử Al ở nhiệt độ trên theo đơn vị Å. (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến hàng phần trăm.)
(Xem giải) 2. Trong danh mục tiêu chuẩn chất lượng sản phẩm có chỉ tiêu về dư lượng chlorine không vượt quá 1 mg/L (chlorine sử dụng trong quá trình sơ chế nguyên liệu để diệt vi sinh vật). Phương pháp chuẩn độ iodine-thiosulfate được dùng để xác định dư lượng chlorine trong thực phẩm theo phương trình:
Cl2 + 2KI → KCl + I2
Lượng I2 sau đó được được nhận biết bằng hồ tinh bột, I2 bị khử bởi dung dịch chuẩn sodium thiosulfate theo phương trình: I2 + 2Na2S2O3 → 2NaI + Na2S2O6
Dựa vào thể tích dung dịch Na2S2O3 đã phản ứng, tính được dư lượng chlorine trong dung dịch mẫu. Tiến hành chuẩn độ 100 mL dung dịch mẫu bằng dung dịch Na2S2O3 0,01M thì thể tích Na2S2O3 đã dùng trong các lần chuẩn độ lần lượt như sau:
| Lần | 1 | 2 | 3 |
| Thể tích Na2S2O3 đã dùng (mL) | 8,6 | 8,7 | 8,5 |
(Dụng cụ chứa dung dịch chuẩn Na2S2O3 là loại buret 25 mL, vạch chia 0,1 mL). Tính lượng Cl2 trong mẫu sản phẩm trên.
(Xem giải) 3. Hợp chất X được sử dụng làm thuốc pháo, ngòi nổ, thuốc đầu diêm, thuốc giúp cây nhãn ra hoa… X có khối lượng mol bằng 122,5 g/mol, chứa ba nguyên tố A, Y, E. Trong phân tử X có 1 nguyên tử A, 1 nguyên tử Y. Thành phần phần trăm khối lượng nguyên tố E trong X bằng 39,19%. Nguyên tố E có 4 electron p.
a) Xác định công thức phân tử của X?
b) Viết công thức Lewis và chỉ rõ các loại liên kết hóa học có trong phân tử X?
Câu 2. (3,0 điểm)
(Xem giải) 1. Hãy nêu hiện tượng xảy ra và viết phương trình hóa học cho các thí nghiệm sau đây:
a) Đưa đũa thủy tinh vừa nhúng vào dung dịch HCl đậm đặc lên miệng lọ đựng dung dịch CH3NH2 đậm đặc.
b) Nhỏ vài giọt nước bromine vào ống nghiệm đựng sẵn 1 mL dung dịch aniline.
c) Nhỏ 2 mL dung dịch glucose 2% vào ống nghiệm chứa thuốc thử Tollens, lắc đều. Sau đó ngâm ống nghiệm trong cốc thủy tinh chứa nước nóng trong vài phút.
d) Cho glycerol dư vào ống nghiệm chứa cooper(II) hydroxide và lắc nhẹ.
(Xem giải) 2. Cho các phương trình phản ứng hóa học sau: (các phản ứng xảy ra theo đúng tỉ lệ mol)
(a) X + 2NaOH (t°) → X1 + 2X2
(b) X1 + H2SO4 → X3 + Na2SO4
(c) nX3 + nX4 (xt, t°) → Polymer A + 2nH2O
(d) X2 + CO (xt, t°) → X5
(e) X4 + 2X5 (H2SO4 đặc, t°) ⇋ X6 + 2H2O
Biết X là ester có công thức phân tử C10H10O4; X1, X2, X3, X4, X5, X6 là các hợp chất hữu cơ khác nhau; polymer A có kí hiệu PET, được sử dụng làm vật đựng đồ uống, chai lọ, khay đựng hoặc đóng gói các loại thực phẩm ăn nhanh như pizza, xúc xích… Hãy xác định các chất trong chuỗi phản ứng, viết các phương trình hóa học xảy ra.
(Xem giải) 3. Độ tan trong nước của một chất là số gam tan tối đa trong 100 gam nước của chất đó ở nhiệt độ xác định. Cho biết độ tan của glucose ở 25°C là 91 và ở 50°C là 244. Tính khối lượng glucose kết tinh thu được khi làm lạnh 172 gam dung dịch glucose bão hoà ở 50°C xuống 25°C. (Giả thiết khi làm lạnh sự bay hơi nước xảy ra không đáng kể.)
Câu 3. (2,25 điểm)
(Xem giải) 1. Xăng sinh học (Biogasonline) là hỗn hợp của xăng truyền thống và cồn sinh học C2H5OH được sử dụng cho các động cơ đốt trong như ô tô, xe máy. Một loại xăng sinh học chứa 5% C2H5OH về thể tích (D = 0,8 g/mL), 95% còn lại là C8H18 (D = 0,69 g/mL). Khi đốt cháy hoàn toàn 1 mol C2H5OH tỏa ra lượng nhiệt là 1365 kJ, 1 mol C8H18 tỏa ra lượng nhiệt là 5056 kJ. Trung bình chiếc xe máy Cup hiệu Honda của anh H di chuyển được 1 km thì cần nhiệt lượng chuyển thành công cơ học là 250 kJ.
a) Tính quãng đường xe di chuyển được khi dùng hết 100.000 đồng tiền xăng đó cho xe máy của anh H. Biết hiệu suất sử dụng nhiên liệu của động cơ là 40%, giá xăng 20.000 đồng/lít. (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến hàng phần trăm.)
b) Tại sao ở các cây xăng, kho chứa xăng dầu thường treo các biển cấm dưới đây?

(Xem giải) 2. Hợp chất hữu cơ X được dùng nhiều trong tổng hợp hữu cơ. Bảng phương pháp phân tích nguyên tố, người ta xác định được X chứa 62,07%C; 10,34%H; còn lại là O. Trên phổ MS của X, người ta thấy có peak ion phân tử [M+] có giá trị m/z bằng 58. Trên phổ IR của X có một peak trong vùng 1710 – 1690 cm⁻¹.
a) Xác định công thức cấu tạo của X.
b) Chất X có thể phản ứng với các chất nào sau đây: Na, NaOH, Thuốc thử Tollens, LiAlH4, I2/OH-? Viết phương trình hóa học của phản ứng xảy ra (ghi rõ điều kiện phản ứng nếu có).
Câu 4. (4,0 điểm)
(Xem giải) 1. Theo báo cáo mới nhất vừa được Uỷ ban Liên Chính phủ về biến đổi khí hậu (IPCC) công bố ngày 09/8/2021, lượng khí thải gây hiệu ứng nhà kính do các hoạt động của con người là nguyên nhân chính gây ra hiện tượng ấm lên khoảng 1,1°C của trái đất trong khoảng thời gian từ năm 1850 – 1900. Hãy giải thích vì sao dù lượng khí CO2 thải ra từ các hoạt động công nghiệp hằng năm rất lớn nhưng nồng độ của chất khí này trong khí quyển lại tăng chậm?
(Xem giải) 2. Cho cân bằng hoá học sau: N2(g) + 3H2(g) ⇌ 2NH3(g).
Cho 3,0 mol khí hydrogen và 1,0 mol khí nitrogen vào một bình kín dung tích 10 lít, có bột iron xúc tác, giữ bình ở 450°C. Biết giá trị Kc = 1,45. Tính hiệu suất của phản ứng tổng hợp ammonia?
(Xem giải) 3. Nguyên tố X đã được con người biết đến từ thời cổ xưa và được tìm thấy trong nhiều hợp chất phổ biến và có nhiều ứng dụng trong thực tiễn. Cho sơ đồ chuyển hóa của X như sau:
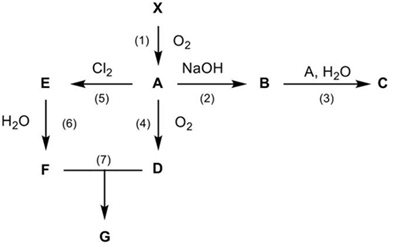
Biết:
+ A, B, C, D, E, F, G là kí hiệu cho các hợp chất chưa biết, đều chứa nguyên tố X.
+ Hợp chất D gồm hai nguyên tố, trong đó tỉ lệ khối lượng của X và nguyên tố còn lại tương ứng là 2 : 3.
+ Cho 3,2 gam A tác dụng với Cl2 thu được 5,4 gam E (hiệu suất 80% tính theo A).
+ Công thức hợp chất B và F đều chứa 3 nguyên tố hóa học.
Hãy xác định các chất X, A, B, C, D, E, F, G và viết các phương trình hóa học xảy ra (ghi rõ điều kiện phản ứng xảy ra nếu có).
(Xem giải) 4. Một hồ chứa nước thải sinh hoạt bị nhiễm ammonium (NH4+), gây ra hiện tượng phú dưỡng. Nồng độ NH4+ là 30 mg/L. Hồ có thể tích 4000 m³. Để xử lý nước, người ta sử dụng nước vôi trong để chuyển hóa NH4+ thành khí NH3, sau đó sử dụng khí chlorine để oxi hóa NH3 thành N2 và HCl. Hiệu suất của quá trình xử lý NH4+ bằng nước vôi trong là 90% và quá trình oxi hóa NH3 bằng khí chlorine xảy ra không hoàn toàn, chỉ đạt 85%.
a) Xác định khối lượng khí chlorine cần thiết để oxi hóa NH3 thành N2.
b) Theo quy chuẩn kỹ thuật quốc gia về nước thải sinh hoạt, nồng độ NH4+ không được vượt quá 5 mg/L. Xác định nồng độ NH4+ trong hồ sau khi xử lý và cho biết sau quá trình xử lý, nồng độ NH4+ đã đạt tiêu chuẩn môi trường chưa?
Câu 5. (2,75 điểm)
(Xem giải) 1. Saccharose monolaurate là một trong những chất phụ gia có chức năng kép do khả năng nhũ hoá và hoạt tính kháng khuẩn của nó. Saccharose monolaurate là ester được tạo ra từ phản ứng saccharose tác dụng với lauric acid.
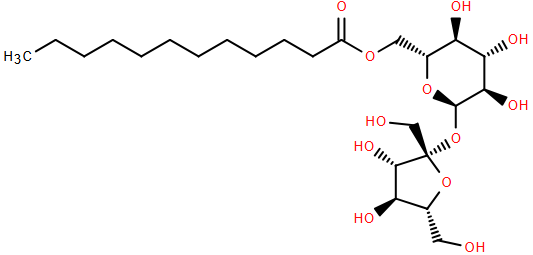
a) Cho biết công thức phân tử của saccharose monolaurate.
b) Phân tử saccharose monolaurate có 2 phần: Đuôi kị nước và đầu ưa nước. Giải thích vì sao phân tử saccharose monolaurate lại có 2 phần như trên?
c) Saccharose monolaurate có phản ứng với thuốc thử Tollens không? Giải thích.
d) Từ 400 gam saccharose và 100 gam lauric acid có thể điều chế được 123,14 gam saccharose monolaurate. Tính hiệu suất phản ứng.
(Xem giải) 2. Viết công thức cấu tạo và gán nhiệt độ sôi phù hợp (có giải thích) cho các hợp chất hữu cơ đơn chức, no, mạch hở ký hiệu bằng các chữ cái: A (C3H6O2), B (C2H4O2), C (C2H6O), D (CHCl3). Nhiệt độ sôi của chúng được sắp xếp ngẫu nhiên: 61,1°C; 31,8°C; 78,3°C; 141,2°C.
Biết:
+ A, C tạo được liên kết hydrogen với nước và liên kết hydrogen liên phân tử với nhau.
+ B tạo được liên kết hydrogen với nước nhưng không tạo được hydrogen liên phân tử với nhau.
+ D là một chất gây mê đường thở, tác dụng đến thần kinh trung ương gây chóng mặt, mệt mỏi.
(Xem giải) 3. Giải thích các tình huống sau:
a) Không nên ăn, uống các loại thực phẩm chứa nhiều vitamin C lúc gần uống sữa.
b) Dạ dày người tiêu hoá thức ăn chứa protein từ thực vật dễ dàng hơn từ động vật (cùng đơn vị khối lượng).


Bình luận