[2022-2023][Hóa 10] Kiểm tra giữa kỳ 1 trường Núi Thành – Quảng Nam
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Giải chi tiết và đáp án:
⇒ Mã đề: 001
| 1D | 2B | 3C | 4A | 5D | 6A | 7C | 8C | 9B | 10D |
| 11D | 12A | 13A | 14A | 15D | 16C | 17A | 18A | 19B | 20B |
| 21A |
I. PHẦN TRẮC NGHIỆM (21 CÂU – 7 ĐIỂM)
(Xem giải) Câu 1. Nếu hình dung nguyên tử như một khối cầu thì nó có đường kính khoảng 10^-10m. Đường kính của hạt nhân nguyên tử còn nhỏ hơn, vào khoảng 10^-14 m, như vậy đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng bao nhiêu lần?
A. 1000 . B. 100000. C. 10 . D. 10000.
(Xem giải) Câu 2. X là nguyên tố phi kim khi có số hiệu nguyên tử
A. ZX = 11. B. ZX = 15. C. ZX = 12 D. ZX = 10.
(Xem giải) Câu 3. Hợp kim cobalt được sử dụng rộng rãi trong các động cơ máy bay vì độ bền nhiệt độ cao là một yếu tố quan trọng. Nguyên tử cobalt có cấu hình thu gọn ở trạng thái cơ bản là [Ar]3d7 4s2. Số thứ tự cobalt trong bảng tuần hoàn là
A. 25. B. 24. C. 27. D. 29.
(Xem giải) Câu 4. Carbon có hai đồng vị bền là ![]() và
và ![]() . Oxygen có ba đồng vị bền là
. Oxygen có ba đồng vị bền là ![]() ,
, ![]() ,
, ![]() . Khối lượng phân tử CO2 (amu) lớn nhất là
. Khối lượng phân tử CO2 (amu) lớn nhất là
A. 49. B. 50. C. 46. D. 44.
(Xem giải) Câu 5. Hãy cho biết các hoạt động trong hình tương ứng với phương pháp học tập hóa học nào

A. Phương pháp luyện tập, ôn tập.
B. Phương pháp học tập trải nghiệm.
C. Phương pháp tìm hiểu lí thuyết.
D. Phương pháp học tập thông qua thực hành thí nghiệm.
(Xem giải) Câu 6. Năm 1869, nhà hóa học người Nga đã công bố bảng tuần hoàn các nguyên tố hóa học là
A. D.I.Medeleev. B. J.Chadwick.
C. Ernest Rutherford. D. J.J. Thomson.
(Xem giải) Câu 7. Cho các AO sau:
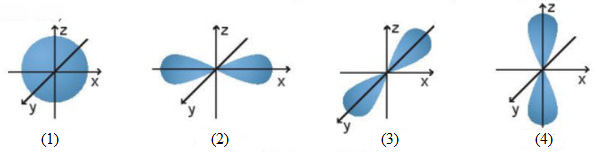
AOpy là hình vẽ
A. (2). B. (1). C. (3). D. (4).
(Xem giải) Câu 8. Số thứ tự của ô nguyên tố bằng
A. số neutron. B. số khối.
C. số hiệu nguyên tử. D. số electron ở lớp ngoài cùng.
(Xem giải) Câu 9. Theo mô hình nguyên tử hiện đại. Kết luận nào sai?
A. Vùng không gian quanh hạt nhân mà xác suất tìm thấy electron là khoảng 90% gọi là orbital nguyên tử.
B. Electron quay xung quanh hạt nhân theo các quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời.
C. Phân loại orbital dựa vào sự khác nhau về hình dạng và sự định hướng trong không gian.
D. Các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định.
(Xem giải) Câu 10. Đối tượng nghiên cứu của hóa học là
A. quy luật, đặc điểm phân bố của tự nhiên.
B. tìm hiểu các cấu trúc cơ bản tạo thành mọi sự sống.
C. sự lớn lên và sinh sản của tế bào.
D. tính chất và sự biến đổi của chất.
(Xem giải) Câu 11. Kết luận nào sau đây là đúng khi biết kí hiệu 3 nguyên tử sau 29X63, 29Y65 và 30Z65?
A. X và Z là hai đồng vị của cùng một nguyên tố hóa học và có cùng số neutron.
B. X và Y là hai đồng vị của cùng một nguyên tố hóa học và có cùng số khối.
C. Z và Y là hai đồng vị của cùng một nguyên tố hóa học và có cùng số khối.
D. X và Y là hai đồng vị của cùng một nguyên tố hóa học và có cùng số hiệu.
(Xem giải) Câu 12. Nguyên tố hóa học là những nguyên tử có cùng
A. số proton. B. số neutron.
C. số neutron và số proton. D. số khối.
(Xem giải) Câu 13. Cho các phát biểu về nguyên tử ![]() :
:
(a) Y có tổng các hạt mang điện nhiều hơn số hạt không mang điện là 20.
(b) Y có số hạt neutron nhiều hơn proton là 5.
(c) Cấu hình electron của Y là [Ar]3d10 4s1.
(d) Y là kim loại.
Số phát biểu đúng là
A. 3 B. 1 C. 2 D. 4
(Xem giải) Câu 14. Số electron tối đa trong lớp L là
A. 8. B. 2. C. 32. D. 18.
(Xem giải) Câu 15. Quan sát hình vẽ sau mô tả thí nghiệm tìm ra hạt nhân nguyên tử vào năm 1911 của nhà vật lý người New Zealand là E. Rutherford. Hãy cho biết phát biểu đúng?
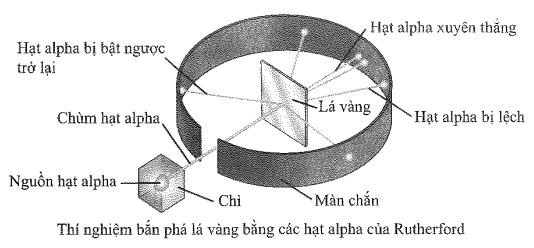
A. Nguyên tử có cấu tạo rỗng nên các hạt α bật ngược trở lại.
B. Hạt nhân nguyên tử mang điện tích âm nên hầu hết các hạt α xuyên qua lá vàng.
C. Hạt nhân nguyên tử có kích thước rất lớn hơn với kích thước nguyên tử.
D. Nguyên tử có cấu tạo rỗng nên hầu hết các hạt α xuyên qua lá vàng.
(Xem giải) Câu 16. Quá trình nào là quá trình biến đổi hóa học?
A. Hòa tan acetic acid (CH3COOH) vào nước được dung dịch acetic acid loãng dùng làm giấm ăn.
B. Hòa tan đường vào nước.
C. Cho kim loại Fe vào bình đựng dung dịch HCl thấy có khí thoát ra.
D. Thủy tinh nóng chảy được thổi thành bình cầu.
(Xem giải) Câu 17. Nguyên tố Y là một khoáng chất thiết yếu đối với sự phát triển của xương và răng, trong cơ thể Y tham gia vào quá trình co cơ, đông máu, điều hòa chức năng thận, thần kinh, tái tạo mô, tế bào và đảm bảo quá trình hoạt động của tim. Trong nguyên tử của nguyên tố Y có tổng số các hạt là 46. Biết số hạt mang điện dương ít hơn số hạt không mang điện là 1. Khẳng định nào sau đây đúng ?
A. Nguyên tử Y có điện tích hạt nhân của Y là +2,4.10^-18C, có 5 electron lớp ngoài cùng
B. Y là nguyên tố phi kim, có số hiệu nguyên tử là 17, có 5 electron ở phân lớp p.
C. Nguyên tử Y có 31 hạt mang điện, có 5 electron lớp ngoài cùng
D. Y là nguyên tố phi kim, có số hiệu nguyên tử là 15, có 2 electron độc thân.
(Xem giải) Câu 18. Số hiệu nguyên tử của nguyên tố X là 10. Ở trạng thái cơ bản, cấu hình electron của nguyên tử X là
A. 1s2 2s2 2p6. B. 1s2 2s2 2p8. C. 1s2 2s2 2p2. D. 1s2 2s2 2p4.
(Xem giải) Câu 19. Biết số neutron N, số hiệu của nguyên tử Z thì số khối A được tính theo công thức
A. A = Z – N. B. A = N + Z. C. A = N – Z. D. A = P – Z.
(Xem giải) Câu 20. Điện tích của electron là
A. -1,602.10^-24C. B. -1,602.10^-19C. C. +1,602.10^-19 C D. +1,602.10^-31 C.
(Xem giải) Câu 21. Hạt mang điện trong hạt nhân nguyên tử là
A. proton. B. electron và proton. C. neutron. D. electron.
II. PHẦN TỰ LUẬN (3 CÂU – 3 ĐIỂM)
(Xem giải) Câu 1. Nguyên tử của nguyên tố sodium (Na) có 11 electron.
a. Viết cấu hình electron của Na theo lớp, phân lớp và theo ô orbital nguyên tử.
b. Sodium là nguyên tố kim loại, phi kim hay khí hiếm? Vì sao?
(Xem giải) Câu 2. Phổ khối hay phổ khối lượng (MS: Mass Spectrum) chủ yếu được sử dụng đề xác định phân tử khối, nguyên tử khối của các chất và hàm lượng các đồng vị bền của một nguyên tố. Phổ khối của bạc (silver) được biểu diễn như ở hình bên.
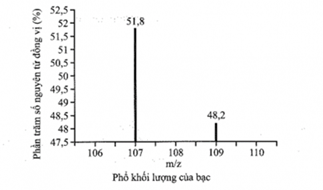
a. Xác định nguyên tử khối các đồng vị của silver (Ag)?
b. Tính nguyên tử khối trung bình của silver (Ag)?
(Xem giải) Câu 3. Trong thể dục thể thao, có một số vận động viên sử dụng các loại chất kích thích trong thi đấu, gọi là doping, dẫn đến thành tích đạt được của họ không thật so với năng lực vốn có. Một trong các loại doping thường gặp nhất là testosterone tổng hợp.
 Tỉ lệ giữa hai đồng vị
Tỉ lệ giữa hai đồng vị 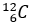 (98,98%) và
(98,98%) và 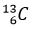 (1,11%) là không đổi đối với testosterone tự nhiên trong cơ thể. Trong khi testosterone tổng hợp (tức doping) có phần trăm số nguyên tử đồng vị
(1,11%) là không đổi đối với testosterone tự nhiên trong cơ thể. Trong khi testosterone tổng hợp (tức doping) có phần trăm số nguyên tử đồng vị 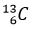 ít hơn testosterone tự nhiên. Đây chính là mấu chốt của xét nghiệm CIR (Carbon Isotope Ratio – Tỉ lệ đồng vị carbon) – một xét nghiệm với mục đích xác định xem vận động viên có sử dụng doping hay không.
ít hơn testosterone tự nhiên. Đây chính là mấu chốt của xét nghiệm CIR (Carbon Isotope Ratio – Tỉ lệ đồng vị carbon) – một xét nghiệm với mục đích xác định xem vận động viên có sử dụng doping hay không.
Giả sử, thực hiện phân tích CIR đối với một vận động viên thu được kết quả phần trăm số nguyên tử đồng vị 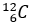 là x và
là x và 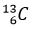 là y. Từ tỉ lệ đó, người ta tính được nguyên tử khối trung bình của carbon trong mẫu phân tích có giá trị là 12,0098.
là y. Từ tỉ lệ đó, người ta tính được nguyên tử khối trung bình của carbon trong mẫu phân tích có giá trị là 12,0098.
a. Với kết quả thu được, em có nghi ngờ vận động viên này sử dụng doping hay không? Vì sao?
b. Doping bị cấm bởi không chỉ làm ảnh hưởng tới tính công bằng của cuộc thi, những chất này còn gây ra nhiều tác hại cho sức khỏe vận động viên. Đặc biệt, doping còn có thể tạo ra các tác dụng phụ gây nguy hiểm cho tính mạng vận động viên. Hãy kể 2 tác hại của việc sử dụng doping mà em biết?


Bình luận