[2025 – 2026] Thi học sinh giỏi lớp 12 – Tỉnh Thanh Hóa
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề 018-H12A năm 2025-2026
⇒ Thời gian làm bài: 90 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1C | 2B | 3D | 4C | 5D | 6C | 7D | 8B | 9B | 10D |
| 11B | 12C | 13C | 14B | 15B | 16C | 17D | 18B | 19C | 20B |
| Câu 21 | Câu 22 | Câu 23 | Câu 24 | Câu 25 | Câu 26 | |
| (a) | S | S | Đ | Đ | Đ | Đ |
| (b) | S | Đ | S | S | S | S |
| (c) | Đ | S | Đ | Đ | Đ | S |
| (d) | Đ | Đ | Đ | S | Đ | Đ |
| Câu 27 | Câu 28 | Câu 29 | Câu 30 | Câu 31 | Câu 32 |
| 6521 | 3 | 3681 | 125 | 134 | 541 |
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 20. Mỗi câu thí sinh chỉ chọn một phương án đúng
(Xem giải) Câu 1: Các chất bảo quản BHA (butylated hydroxyanisole), BHT (butylated hydroxytoluene) hiện nay được sử dụng phổ biến trong thực phẩm, mỹ phẩm. Công thức của BHA, BHT được cho ở hình dưới:
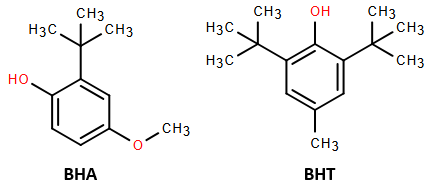
Phát biểu sai là
A. BHA, BHT có nhóm chức phenol nên sử dụng quá mức cho phép sẽ ảnh hưởng không tốt đến sức khỏe.
B. BHA và BHT đều tác dụng được với dung dịch NaOH.
C. BHA và BHT là các chất đồng đẳng của nhau.
D. Công thức phân tử của BHA và BHT lần lượt là C11H16O2 và C15H24O.
(Xem giải) Câu 2: Giá trị pH mà khi đó amino acid có nồng độ ion lưỡng cực là cực đại được gọi là điểm đẳng điện (kí hiệu là pI). Khi pH < pI thì amino acid đó tồn tại chủ yếu ở dạng cation, còn khi pH > pl thì amino acid đó tồn tại chủ yếu ở dạng anion. Khi đặt trong một điện trường, dạng anion sẽ di chuyển về dương còn dạng cation sẽ di chuyển về cực âm. Tính chất này được gọi là tính điện di và được dùng để tách, tinh chế amino acid ra khỏi hỗn hợp của chúng. Cho các giá trị pl của các chất sau:
| Chất | H2NCH2COOH (glycine) | HOOCCH2CH2CH(NH2)COOH (glutamic acid) | H2N[CH2]4CH(NH2)COOH (lysine) |
| pl | 6,0 | 3,2 | 9,7 |
Chọn phát biểu sai?
A. Ở pH = 9,7 glycine và glutamic acid đều di chuyển về cực dương, trong khi lysine đứng yên.
B. Trong dung dịch chứa ba chất, ở pH = 3,2 thì glycine di chuyển nhanh nhất về cực dương.
C. Tại pH = 6 có thể để tách ba chất trên ra khỏi hỗn hợp.
D. Khi pH thay đổi từ 9,7 đến 2,0 thì dạng ion lưỡng cực của lysine có thể nhận tối đa hai proton.
(Xem giải) Câu 3: Phân tử saccharose cấu tạo từ
A. hai đơn vị α-glucose qua liên kết α-1,2-glycoside.
B. một đơn vị α-glucose và một đơn vị α-fructose qua liên kết α-1,2-glycoside.
C. một đơn vị α-glucose và một đơn vị β-fructose qua liên kết α-1,4-glycoside.
D. một đơn vị α-glucose và một đơn vị β-fructose qua liên kết α-1,2-glycoside.
(Xem giải) Câu 4: Cho các phát biểu sau:
(1) Để tách riêng các alkane sau: pentane (sôi ở 36,1°C), heptane (sôi ở 98,4°C), octane (sôi ở 125,7°C), ta có thể dùng phương pháp chưng cất.
(2) Kết tinh là phương pháp tách biệt và tinh chế hỗn hợp các chất rắn dựa vào độ tan giống nhau và sự thay đổi độ tan của chúng theo nhiệt độ.
(3) Mật ong để lâu ngày thường thấy có những hạt rắn xuất hiện ở đáy chai, do nước trong mật ong bay hơi làm kết tinh saccharose loại đường chủ yếu trong mật ong.
(4) Sắc kí cột là phương pháp tách biệt và tinh chế hỗn hợp các chất dựa vào sự phân bố khác nhau của chúng giữa hai pha động và pha tĩnh.
(5) Phương pháp chiết lỏng – lỏng thường dùng để tách lấy chất hữu cơ khi nó ở dạng nhũ tương hoặc huyền phù trong nước.
Số phát biểu đúng là
A. 2. B. 4. C. 3. D. 1.
(Xem giải) Câu 5: Phân bón nào sau đây khi bón cho cây trồng có thể làm đất bị chua?
A. Potassium carbonate. B. Potassium nitrate.
C. Potassium chloride. D. Ammonium nitrate.
(Xem giải) Câu 6: Cho biết giá trị thế điện cực chuẩn của các cặp oxi hoá – khử sau:
| Cặp oxi hoá – khử | Zn2+/Zn | Ni2+/Ni | Cu2+/Cu | 2H+/H2 | Fe3+/Fe2+ |
| E°oxh/kh (V) | -0,762 | -0,257 | +0,340 | 0,000 | +0,771 |
Dựa vào bảng số liệu trên hãy cho biết kim loại copper có thể bị hoà tan trong dung dịch nào sau đây?
A. Dung dịch NiCl2 1M. B. Dung dịch ZnCl2 1M.
C. Dung dịch FeCl3 1M. D. Dung dịch HCl 1M.
(Xem giải) Câu 7: Để phân biệt ba hợp chất HCHO, CH3CHO, CH3COCH3, một học sinh tiến hành thí nghiệm thu được kết quả sau:
| Thuốc thử | (1) | (2) | (3) |
| Tollens | ✓ | ✕ | ✓ |
| I2/NaOH | ✕ | ✓ | ✓ |
(dấu ✓ là có phản ứng, dấu ✕ là không phản ứng) Ba chất (1), (2), (3) lần lượt là
A. CH3CHO, HCHO, CH3COCH3. B. CH3CHO, CH3COCH3, HCHO.
C. HCHO, CH3CHO, CH3COCH3. D. HCHO, CH3COCH3, CH3CHO.
(Xem giải) Câu 8: Cao su tự nhiên khi cho tác dụng với lưu huỳnh thu được cao su lưu hóa theo sơ đồ sau:
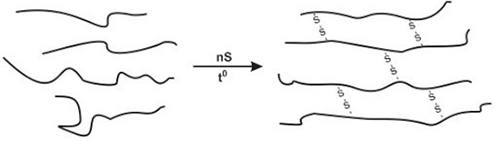
Phát biểu sai là
A. Khi đun nóng cao su với lưu huỳnh được cao su lưu hoá là phản ứng làm tăng mạch polymer.
B. Cao su tự nhiên được trùng hợp từ isoprene.
C. Trong một loại cao su lưu hoá có 2,0% sulfur về khối lượng, cứ 46 mắt xích isoprene có một cầu nối disulfide (-S-S-) (kết quả được làm tròn đến hàng đơn vị).
D. Cao su lưu hoá có các tính chất lí hoá nổi trội hơn so với cao su ban đầu.
(Xem giải) Câu 9: Các polymer thường được tổng hợp theo hai phương pháp phổ biến là phương pháp trùng hợp và phương pháp trùng ngưng. Phát biểu đúng là
A. Trùng hợp buta-1,3-diene thu được polymer có cấu trúc tương tự cao su tự nhiên.
B. Để thu được 8,6 kg keo dán chứa 80% poly(vinyl acetate) cần 8,6 kg vinyl acetate biết hiệu suất quá trình trùng hợp là 80%.
C. Nylon-6,6 được sử dụng phổ biến trong ngành dệt may và được điều chế từ phản ứng trùng hợp.
D. Sự khác biệt cơ bản giữa hai phản ứng điều chế polymer là trong phản ứng trùng hợp có tạo ra các phân tử nhỏ, còn trùng ngưng thì không tạo ra các phân tử nhỏ.
(Xem giải) Câu 10: Cho các alcohol có công thức như sau:
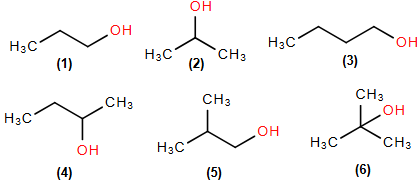
Số alcohol bị oxi hóa bằng CuO, đun nóng tạo thành sản phẩm có phản ứng iodoform là
A. 4. B. 3. C. 1. D. 2.
(Xem giải) Câu 11: Dung dịch nào sau đây làm cho quì tím chuyển thành màu xanh?
A. Glycine. B. Lysine. C. Alanine. D. Glutamic acid.
(Xem giải) Câu 12: Cho các phát biểu sau, phát biểu sai là
A. Carbohydrate là những hợp chất hữu cơ tạp chức, thường có công thức chung là Cn(H2O)m.
B. Do có nhóm -OH hemiacetal nên glucose có khả năng phản ứng với methanol khi có mặt HCl khan.
C. Trong môi trường acid, glucose và fructose có thể chuyển hóa qua lại lẫn nhau.
D. Maltose có trong một số hạt nảy mầm.
(Xem giải) Câu 13: Trong dung dịch CH3COOH tồn tại cân bằng: CH3COOH + H2O ⇋ CH3COO- + H3O+. Tác động làm cân bằng chuyển dịch theo chiều thuận là
A. nhỏ thêm vài giọt dung dịch HCl loãng. B. nhỏ thêm vài giọt dung dịch H2SO4 loãng.
C. nhỏ thêm vài giọt dung dịch NaOH. D. nhỏ thêm vài giọt dung dịch NaCl.
(Xem giải) Câu 14: Trong các nhận xét sau, nhận xét sai là
A. Các protein dạng hình sợi như keratin, collagen, myosin,… không tan trong nước cũng như các dung môi thông thường.
B. Gly-Ala phản ứng với thuốc thử biuret (Cu(OH)2 trong môi trường kiềm), tạo thành dung dịch có màu tím đặc trưng.
C. Protein phức tạp là loại protein tạo thành từ protein đơn giản và các thành phần “phi protein” như nucleic acid và lipid,…
D. Protein có thể bị đông tụ dưới tác dụng của nhiệt, acid, base hoặc ion kim loại nặng.
(Xem giải) Câu 15: Trong một bình kín có cân bằng hóa học sau: 2NO2(g) (màu nâu đỏ) ⇋ N2O4(g). (không màu). Tỉ khối hơi của hỗn hợp khí trong bình so với H2 ở nhiệt độ T1 bằng 18,6 và ở nhiệt độ T2 bằng 22,5. Biết T1 > T2. Cho các phát biểu sau:
(1) Khi tăng áp suất chung của hệ, cân bằng chuyển dịch theo chiều thuận.
(2) Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiếu làm tăng áp suất của hệ.
(3) Phản ứng thuận là phản ứng tỏa nhiệt.
(4) Màu hỗn hợp ở nhiệt độ T1 đậm hơn ở nhiệt độ T2.
Số phát biểu sai là
A. 4. B. 1. C. 2. D. 3.
(Xem giải) Câu 16: SO3 được điều chế từ quặng pyrite theo sơ đồ sau: FeS2 → SO2 → SO3 (1). Hấp thụ toàn bộ lượng SO3 điều chế được vào 1000 gam dung dịch H2SO4 98,0% thu được oleum X. Hoà tan 50,7 gam oleum X vào nước được dung dịch Y, cho dung dịch BaCl2 dư vào dung dịch Y thấy tạo thành 139,8 gam kết tủa. Khối lượng (gam) quặng pyrite (có chứa 80,0% FeS2, các tạp chất khác không chứa S) đã dùng bao nhiêu? (Chỉ làm tròn kết quả cuối cùng đến hàng đơn vị. Giả thiết hiệu suất của cả quá trình (1) là 75,0%, các phản ứng còn lại xảy ra hoàn toàn).
A. 2583 gam. B. 2358 gam. C. 3444 gam. D. 1937 gam.
(Xem giải) Câu 17: Bộ phận quan trọng nhất của máy tạo nhịp tim là một hệ pin điện hóa lithium – iodine (gồm hai cặp oxi hóa khử Li+/Li và I2/2I-). Hai điện cực được đặt vào tim, phát sinh dòng điện nhỏ kích thích tim đập ổn định. Cho biết: E°Li+/Li = -3,04V; E°I2/2I- = +0,54V; 1 năm = 365 ngày. Cho các phát biểu sau:
(1) Máy tạo nhịp tim có thể được đặt tạm thời hay lâu dài trong cơ thể tùy theo tình trạng sức khỏe và các bệnh lý kèm theo của bệnh nhân.
(2) Khi pin hoạt động Lithium đóng vai trò là anode, tại anode xảy ra quá trình khử.
(3) Sức điện động chuẩn của pin E°pin = 3,58 V.
(4) Nếu pin tạo ra một dòng điện ổn định bằng 2,5.10^-5 A thì một pin được chế tạo bởi 0,5 gam lithium có thể hoạt động tối đa trong thời gian 8,5 năm (chỉ làm tròn kết quả ở phép tính cuối cùng đến hàng phần mười).
Số phát biểu đúng là
A. 1. B. 3. C. 4. D. 2.
(Xem giải) Câu 18: Từ tinh bột (có trong các loại ngũ cốc như ngô, lúa mì, đậu tương,…) có thể chuyển hóa thành ethanol dùng để phối trộn với xăng thông thường theo một tỉ lệ nhất định tạo ra xăng sinh học như: xăng E5 RON 92 (gồm 5% ethanol và 95% xăng RON 92 về thể tích), xăng E10 RON 92 (gồm 10% ethanol và 90% xăng RON 92 về thể tích). Một loại xăng E5 có tỉ lệ số mol như sau: 5% ethanol, 35% heptane, 60% octane. Biết năng lượng sinh ra khi đốt cháy 1 mol các chất ethanol, heptane, octane lần lượt là: 1367 kJ, 4825 kJ và 5460 kJ. Các phản ứng xảy ra hoàn toàn và năng lượng giải phóng ra có 20% thải vào môi trường. Một xe máy chạy bình thường trong 1 giờ cần một năng lượng là 37688 kJ. Nếu xe máy vẫn chạy bình thường như trên thì thời gian để sử dụng hết 2 kg xăng E5 là t giờ. Giá trị của t gần nhất là
A. 3. B. 2. C. 1. D. 4.
(Xem giải) Câu 19: Cho các phát biểu sau:
(1) Cho sơ đồ phản ứng:
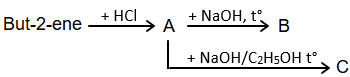
Biết các sản phẩm hữu cơ thu được đều là sản phẩm chính. Công thức cấu tạo của B và C lần lượt là CH3CH2CH(OH)CH3 và CH3CH2CH=CH2.
(2) Số alcohol có công thức C3H8Ox hoà tan được Cu(OH)2 ở nhiệt độ thường là 2.
(3) Cho các chất: saccharose, glucose, fructose, acetylene, ethylene và maltose. Trong các chất trên, có 4 chất có khả năng tham gia phản ứng tráng bạc.
(4) Rutin là hợp chất hữu cơ có trong nụ hoa hòe, có tác dụng làm giảm các chứng suy giảm tĩnh mạch, giảm cholesterol trong máu. Ngoài ra rutin còn được dùng để điều chế thuốc quercetin có tác dụng chống oxy hóa mạnh, kháng viêm, chống dị ứng, ngăn ngừa tế bào ung thư. Công thức cấu tạo của rutin và quercetin cho ở hình dưới đây:
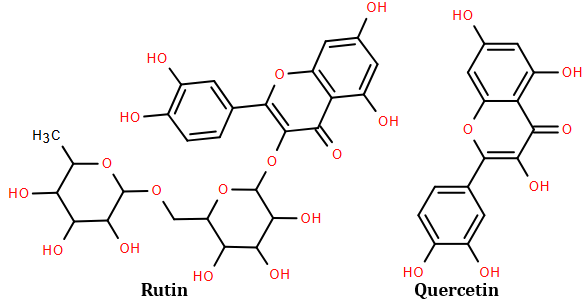
Trong môi trường acid, một phân tử rutin phản ứng với hai phân tử nước thu được sản phẩm gồm quercetin, glucose và rhamnose. Biết hàm lượng quercetin trong một viên thuốc có khối lượng 500,00 mg là 96,64% về khối lượng, phần còn lại là tá dược khác. Để sản xuất 1 triệu viên thuốc trên, cần 4038 kg bột hoa hòe (làm tròn kết quả cuối cùng đến hàng đơn vị). (Biết hàm lượng rutin trong bột hoa hòe là 30,20%, phần còn lại không tạo ra quercetin; hiệu suất toàn bộ quá trình sản xuất đạt 80,00%).
Số phát biểu đúng là
A. 3. B. 4. C. 1. D. 2.
(Xem giải) Câu 20: Tiến hành thí nghiệm theo các bước sau:
• Bước 1: Cho 10 mL dung dịch H2SO4 70% vào cốc thuỷ tinh, thêm một lượng nhỏ cellulose (bông) vào cốc và dùng đũa thuỷ tinh khuấy đều. Sau đó, đặt cốc thuỷ tinh vào cốc nước nóng và khuấy trong khoảng 3 phút để cellulose tan hết tạo dung dịch đồng nhất.
• Bước 2: Trung hoà dung dịch bằng cách thêm từ từ NaHCO3 đến khi dừng sủi bọt khí, sau đó thêm tiếp 5mL dung dịch NaOH 10%.
• Bước 3: Cho 5 mL dung dịch thu được ở trên vào ống nghiệm chứa Cu(OH)2 (được điều chế bằng cách cho 0,5 mL dung dịch CuSO4 5% vào 2 mL dung dịch NaOH 10%, lắc nhẹ). Đun nóng đều ống nghiệm khoảng 2 phút, sau đó để ống nghiệm trên giá khoảng 3 phút.
Cho các phát biểu sau:
(1) Ở bước 1, có thể thay dung dịch H2SO4 70% bằng dung dịch H2SO4 98%.
(2) Ở bước 1, xảy ra phản ứng thủy phân cellulose trong môi trường acid tạo thành glucose và fructose.
(3) Ở bước 2, mục đích thêm dung dịch NaOH để trung hòa lượng acid còn dư.
(4) Ở bước 3, Cu(OH)2 tan dần và thu được dung dịch màu xanh lam, khi đun nóng xuất hiện kết tủa màu đỏ gạch.
Số phát biểu không đúng là
A. 2. B. 3. C. 1. D. 4.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 21 đến câu 26. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 21: Acquy chì có cấu tạo như hình vẽ dưới đây:
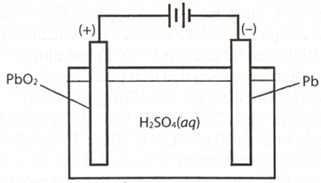
Cực dương là thanh than chì (C) được phủ PbO2 và cực âm là tấm chì (Pb), cùng nhúng vào dung dịch H2SO4 nồng độ 28%. Phản ứng xảy ra khi acquy xả điện là:
Pb(s) + PbO2(s) + 2H2SO4 (aq) → 2PbSO4(s) + 2H2O(l)
Biết rằng PbSO4 sinh ra từ điện cực nào đều bám hết vào điện cực đó.
a) Tại cathode, khi xả điện thì Pb bị oxi hóa theo phương trình: Pb(s) + H2SO4(aq) → PbSO4(s) + 2H+(aq) + 2e.
b) Tại anode, khi xả điện thì PbO2 bị khử theo phương trình: PbO2(s) + 2e + H2SO4(aq) → PbSO4(s) + 2OH-(aq).
c) Khi acquy xả điện, khối lượng các điện cực tăng lên.
d) Để thu được dung dịch H2SO4 28% người ta pha loãng 250 gam dung dịch H2SO4 98% bằng 625 gam nước.
(Xem giải) Câu 22: Hợp chất X (chỉ chứa C, H, O trong phân tử) là một chất hóa học giữ vai trò quan trọng đối với sức khỏe của con người. Hợp chất này có chức năng bảo vệ trạng thái cân bằng của vi sinh vật trong đường ruột và ngăn ngừa các bệnh về đường ruột, chống dị ứng, tăng cường hệ miễn dịch, kéo dài tuổi thọ,… Người ta xác định được phân tử khối của X là 90 bằng phương pháp phổ khối lượng MS. Bằng các phương pháp phổ hiện đại khác như phổ hồng ngoại IR và phổ cộng hưởng từ hạt nhân NMR, người ta xác định được trong phân tử của X chứa nhóm hydroxy và nhóm carboxyl cùng liên kết với một nguyên tử carbon. Đun nóng X với dung dịch sulfuric acid đặc (làm xúc tác), sau một thời gian thu được hỗn hợp các chất, trong đó có hợp chất hữu cơ Y (chỉ chứa 2 liên kết π). Trong phân tử Y, nguyên tố oxygen chiếm 44,44% về khối lượng và phân tử khối của Y nằm trong khoảng từ 75 đến 150.
a) X và Y đều là hợp chất hữu cơ tạp chức.
b) Hợp chất Y có công thức phân tử là C6H8O4.
c) Trong phân tử của hợp chất X có chứa 10 liên kết sigma (σ).
d) Cả X và Y đều tác dụng được với dung dịch NaOH.
(Xem giải) Câu 23: Từ xa xưa con người đã biết lên men các loại ngũ cốc hoa quả để tạo ra các đồ uống có cồn (có chứa ethanol – một alcohol quen thuộc). Ngày nay, alcohol được sử dụng phổ biến trong nhiều lĩnh vực khác nhau như làm dung môi, nguyên liệu hoá học, nhiên liệu, xăng sinh học…
a) Ethyl alcohol dễ tan trong nước vì có thể tạo liên kết hydrogen với phân tử nước.
b) Tiến hành sản xuất rượu vang bằng phương pháp lên men rượu với nguyên liệu là 16 kg quả nho tươi chứa 15% glucose về khối lượng), thu được 12,8 lít rượu vang 12°. Biết khối lượng riêng của ethyl alcohol là 0,8 g/mL. Giả thiết trong thành phần quả nho tươi chỉ có glucose bị lên men rượu, hiệu suất toàn bộ quá trình sản xuất là 72%.
c) Ta có thể tách ethanol ra khỏi dung dịch ethanol – nước bằng phương pháp chưng cất thường.
d) Một người uống hết 3 lon bia loại 330 mL có độ cồn 5°. Sau 4h, người này bị cảnh sát giao thông kiểm tra nồng độ cồn bằng máy đo hơi thở sử dụng dung dịch K2Cr2O7 trong môi trường acid. Khi dẫn 1,00 lít khí thở qua dung dịch K2Cr2O7 thì trong máy xảy ra phản ứng hóa học sau:
C2H5OH + K2Cr2O7 + H2SO4 → CH3COOH + Cr2(SO4)3 + K2SO4 + H2O
Số mol Cr2O72- trong dung dịch giảm từ 10^-4 mol xuống 9,6.10^-5 mol. Biết nồng độ ethanol (mg/L) trong hơi thở tỷ lệ với nồng độ ethanol trong máu là 1 : 2100. Khối lượng riêng ethanol là 0,8 g/mL, giả sử người này cơ thể chứa 5 lít máu.
Nếu tổng lượng ethanol đi vào khí thở là 10%, còn lại được hấp thụ vào máu. Tốc độ đào thải của cơ thể không đổi theo thời gian. Sau khi uống, thời gian tối thiểu để người này không còn nồng độ cồn trong máu là 4,4 giờ (chỉ làm tròn kết quả ở phép tính cuối cùng đến hàng phần mười).
(Xem giải) Câu 24: Tiến hành thí nghiệm theo các bước sau:
• Bước 1: Nhỏ vài giọt dung dịch ethylamine 5% vào giấy quỳ tím.
• Bước 2: Nhúng đũa thủy tinh sạch vào bình đựng dung dịch HCl đặc rồi đưa đầu đũa thủy tinh lại miệng của bình chứa dung dịch ethylamine đậm đặc.
• Bước 3: Cho vào ống nghiệm sạch 5 giọt dung dịch FeCl3 3%. Sau đó vừa lắc vừa thêm từ từ đến hết 2 mL dung dịch ethylamine 5%.
• Bước 4: Cho vào ống nghiệm sạch 5 giọt dung dịch CuSO4 5%. Sau đó vừa lắc vừa thêm từ từ đến dư dung dịch ethylamine 5%.
a) Sau bước 1, thấy giấy quỳ chuyển màu xanh.
b) Sau bước 2, thấy có khói trắng xuất hiện. Sau bước 3, thấy xuất hiện kết tủa màu xanh.
c) Trong bước 4, ban đầu thấy xuất hiện kết tủa màu xanh, sau đó kết tủa tan dần tạo dung dịch màu xanh lam.
d) Nếu thay dung dịch ethylamine ở trên bằng dung dịch aniline thì hiện tượng ở các bước 1, bước 2, bước 3 và bước 4 vẫn xảy ra tương tự.
(Xem giải) Câu 25: Năm 2025, mưa lớn liên tục gây ra lũ quét, lụt trên diện rộng, người dân cả nước chịu nhiều thiệt hại nặng nề về người và tài sản. Vấn đề xử lí nước sau lũ rất quan trọng, để giải quyết vấn đề này, có thể dùng phèn chua được coi là bước tiến mới trong xử lý nước sinh hoạt, nước thải, nước nuôi trồng thủy sản với vai trò là chất trợ lắng, keo tụ tạo bông.
a) Phèn chua là chất điện li mạnh.
b) Dung dịch phèn chua làm phenolphthalein chuyển thành màu hồng.
c) Nhỏ lượng dư dung dịch barium chloride vào dung dịch phèn chua thấy xuất hiện kết tủa trắng là do sự tạo kết tủa giữa anion sulfate trong dung dịch phèn chua với cation barium trong dung dịch barium chloride.
d) Ở 20°C nồng độ phần trăm của dung dịch KAl(SO4)2 bão hoà là 5,66%. Lấy 1200 gam dung dịch bão hòa KAl(SO4)2 ở 20°C đun nóng cho bay hơi bớt 400 gam nước, phần còn lại làm lạnh về 20°C. Khối lượng tinh thể phèn KAl(SO4)2.12H2O bị kết tinh khỏi dung dịch là 46,4 gam (chỉ làm tròn kết quả ở phép tính cuối cùng đến hàng phần mười).
(Xem giải) Câu 26: Phân đạm đóng vai trò quan trọng đối với cây trồng, vì nitrogen là một trong những nguyên tố bậc nhất tạo nên sự sống. Phân đạm cung cấp nitrogen cho cây trồng dưới dạng ion nitrate NO3- và ion ammonium NH4+. Độ dinh dưỡng của phân đạm được đánh giá bằng hàm lượng %N trong phân. Hai loại phân đạm được điều chế theo sơ đồ sau đây:
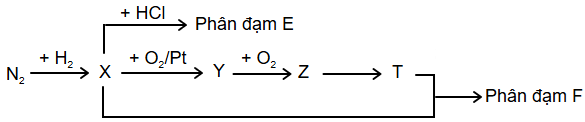
Cho các phát biểu sau:
a) Công thức phân tử của E và F lần lượt là NH4Cl và NH4NO3.
b) Cho các sơ đồ phản ứng xảy ra theo đúng tỉ lệ và bảng số liệu như sau:
E(s) → X(g) + HCl(g) (1)
F(s) → N2O(g) + 2H2O(g) (2)
Nhiệt tạo thành chuẩn của các chất sau:
| Chất | H2O(g) | N2O(g) | NH3(g) | HCl(g) | NH4NO3(s) | NH4Cl(s) |
| -241,82 | 82,05 | -45,90 | -92,30 | -365,61 | -314,89 |
Biến thiên enthalpy chuẩn của phương trình (1), (2) lần lượt là -176,69 kJ/mol và 35,98 kJ/mol.
c) Để phân biệt hai phân đạm E và F ta dùng dung dịch NaOH, đun nhẹ.
d) Cho một loại phân đạm với quy cách đóng gói 50 kg/bao và có độ dinh dưỡng 46%N. Tổng khối lượng phân đạm E và F cần lấy để cung cấp đủ lượng nitrogen bằng lượng nitrogen trong bao phân đạm trên là 71,75 kg (chỉ làm tròn kết quả ở phép tính cuối cùng đến hàng phần trăm). Biết tỷ lệ trộn của phân đạm E và F lần lượt là 1 : 2 về khối lượng.
PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 27 đến câu 32.
(Xem giải) Câu 27: Cho sơ đồ phản ứng:
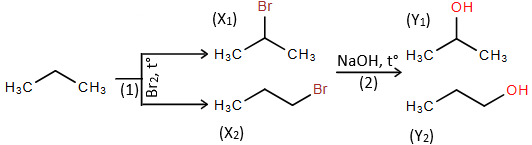
Cho các phát biểu sau:
(1) Các phản ứng (1) và (2) đều là phản ứng thế.
(2) Trong hỗn hợp sản phẩm chứa X1 và X2, chất X1 chiếm tỉ lệ lớn hơn.
(3) Nhiệt độ sôi của chất Y1 cao hơn nhiệt độ sôi của chất Y2.
(4) Khi thay Cl2 bằng Br2 ở phản ứng (1) thì tỉ lệ sản phẩm Y2/Y1 sau phản ứng (2) không thay đổi.
(5) Oxi hóa Y1 và Y2 bằng CuO đun nóng thu được các chất hữu cơ Z1 và Z2. Để phân biệt Z1 và Z2 có thể dùng phản ứng tạo iodoform hoặc phản ứng với Cu(OH)2 trong môi trường kiềm đun nóng.
(6) Trong phản ứng thế của propane với chlorine ở nhiệt độ phòng khi có ánh sáng, tỉ lệ khả năng phản ứng tương đối của nguyên tử hydrogen gắn ở nguyên tử carbon bậc I và nguyên tử carbon bậc II tương ứng là 1 : 4. Phần trăm của dẫn xuất monochloro thế tại nguyên tử hydrogen gắn ở nguyên tử carbon bậc I là 42,86%. (Kết quả được làm tròn đến hàng phần trăm).
Liệt kê các phát biểu đúng theo thứ tự giảm dần từ trái sang phải? (ví dụ: 432,…).
(Xem giải) Câu 28: Cho các phát biểu sau:
(1) C6H5NH2 (C6H5- có vòng benzene) có danh pháp thay thế là aniline.
(2) Glycine phản ứng được với dung dịch NaOH.
(3) Phân tử lysine có một nguyên tử nitrogen.
(4) Trong môi trường kiềm, dạng tồn tại chủ yếu của glycine là dạng cation.
(5) Protein là một trong những nguồn thức ăn chính bổ sung các amino acid thiết yếu và năng lượng cho cơ thể.
(6) “Gạch cua” nổi lên khi nấu riêu cua là hiện tượng đông tụ protein.
(7) Aniline dùng để sản xuất thuốc nổ TNT (2,4,6-trinitrotoluene).
Số phát biểu đúng là bao nhiêu?
(Xem giải) Câu 29: Một đồ vật được làm bằng kim loại Fe dạng hình trụ rỗng có bán kính trong là 1,50 cm, bán kính ngoài là 2,50 cm và chiều cao là 0,50 cm (hình bên). Người ta mạ kim loại Ni cho đồ vật trên bằng cách sử dụng kim loại Ni và đồ vật này làm hai điện cực rồi nhúng vào trong dung dịch NiSO4 1,0 M để tiến hành điện phân. Để đạt yêu cầu về mặt kĩ thuật thì lớp kim loại Ni phải có độ (đây là 0,05 mm và phủ đều trên các bề mặt của đồ vật.
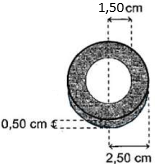
Biết: khối lượng riêng của kim loại Ni là 8,90 g/cm³; công thức tính thể tích của hình trụ tròn là V = π.r.h (r là bán kính đáy và h là chiều cao của hình trụ); Cho biết công thức định luật Faraday: m = A.I.t/n.F (m là khối lượng đơn chất giải phóng ở điện cực (gam); A = 59 là khối lượng mol nguyên tử của chất thu được ở điện cực; n là số electron mà nguyên tử hoặc ion đã cho hoặc nhận; I là cường độ dòng điện (A); t là thời gian điện phân (s); F = 96500 là hằng số Faraday; π = 3,14); phản ứng điện phân xảy ra hoàn toàn và toàn bộ Ni sinh ra bám hết vào vật cần mạ. Tính thời gian (theo giây) của quá trình mạ điện nếu sử dụng dòng điện có cường độ không đổi là 1,50 A? (Chỉ làm tròn ở phép tính cuối cùng đến hàng đơn vị).
(Xem giải) Câu 30: Saccharose octaacetate có công thức C28H38O19 hay (C2H3O2)8C12H14O3, là ester của acetic acid với saccharose. Saccharose octaacetate được dùng làm chất nhũ hoá, chất kháng nấm trong các chế phẩm thuộc lĩnh vực dược phẩm, mĩ phẩm. Cơ quan quản lí thực phẩm và dược phẩm Mỹ (FDA) cho phép sử dụng saccharose octaacetate làm chất phụ gia thực phẩm, chất chống cắn móng tay và mút ngón tay ở trẻ do tính chất rất đắng của nó.
Cho các phát biểu sau:
(1) Phân tử khối của saccharose octaacetate là 686.
(2) Trong phân tử saccharose octaacetate có 6 nhóm chức ester.
(3) Saccharose octaacetate với nồng độ cho phép, tương đối an toàn nên được ứng dụng trong lĩnh vực dược phẩm, mỹ phẩm.
(4) Để tổng hợp saccharose octaacetate theo phương pháp “Hoá học xanh” (green chemistry), người ta tiến hành ester hoá saccharose trong điều kiện chiếu xạ siêu âm (ultrasonic irradiation), cho 10 gam saccharose phản ứng với 30 mL acetic anhydride (D = 1,08 g/mL) với hiệu suất 75% thì thu được khối lượng saccharose octaacetate (chỉ làm tròn kết quả ở bước cuối cùng đến hàng phần mười) là 14,9 gam.
(5) Một nhà máy cần tráng một lớp bạc dày 0,25 μm cho một đơn hàng gồm 2025 chiếc gương hình tròn có đường kính 50 cm. Để hoàn thành đơn hàng này, nhà máy cần thủy phân m gam saccharose thành các monosaccharide rồi tiến hành tráng bạc. Biết hiệu suất của quá trình thủy phân, tráng bạc lần lượt là 80% và 90%, khối lượng riêng của bạc là 10,5 g/cm³; 1 μm = 10^-6 m. Giá trị của m là 1032,32 gam. (Chỉ làm tròn kết quả ở bước cuối cùng đến hàng phần trăm).
Liệt kê các phát biểu sai theo thứ tự tăng dần từ trái sang phải? (ví dụ: 123,…).
(Xem giải) Câu 31: Chất rắn A có trong tự nhiên dưới dạng nhiều khoáng vật. Nung nóng A ở 900°C là phương pháp để sản xuất lượng lớn chất B. Cho B phản ứng với nước sẽ được chất C và tỏa nhiều nhiệt. Trong phòng thí nghiệm, dung dịch C được dùng để phát hiện chất D. Chất D được sử dụng làm “đá khô” tạo khói trong nghi thức rót rượu ở đám cưới. Cho các phát biểu sau:
(1) Chất B được ứng dụng phổ biến làm chất khử chua, sát trùng, tẩy uế, hút ẩm trong công nghiệp,…
(2) Bình chữa cháy chứa chất D được dùng dập tắt đám cháy của mọi loại vật liệu.
(3) Khảo sát một lò sản xuất B trong công nghiệp sử dụng than đá làm nhiên liệu.
Giả thiết:
+ Để phân hủy 1 kg A cần cung cấp một nhiệt lượng là 1800 kJ.
+ Đốt cháy 1 kg than đá giải phóng một nhiệt lượng là 27000 kJ, trong đó 50% lượng nhiệt này được hấp thụ để phân hủy A.
+ Than đá chứa 1% sulfur (ở dạng vô cơ và hữu cơ như FeS2, CaSO4, CxHySH…) về khối lượng, 80% lượng sulfur bị đốt cháy tạo thành SO2 và 1,6% SO2 sinh ra phát thải vào khí quyển.
Lò có công suất 420 tấn B/ngày. Giả thiết toàn bộ lượng SO2 phát thải trong 30 ngày từ lò nung vôi trên chuyển hết thành H2SO4 trong nước mưa với nồng độ là 2.10^-5M. Nếu lượng nước mưa này rơi đều trên một vùng đất rộng 40 km², sẽ tạo ra một trận mưa acid với lượng mưa trung bình là 15 mm. (Chỉ làm tròn kết quả ở bước cuối cùng đến hàng đơn vị).
(4) Khi nhiệt độ phòng là 25°C, cho 10 gam A ở dạng viên vào cốc đựng 100 gam dung dịch hydrochloric acid loãng và nhanh chóng cho lên một cân điện tử. Đọc giá trị khối lượng cốc tại thời điểm ban đầu và sau 1 phút.
Lặp lại thí nghiệm khi nhiệt độ phòng là 35°C. Kết quả thí nghiệm được ghi trong bảng sau:
| Số thứ tự | Nhiệt độ (°C) | Khối lượng cốc (gam) | |
| Thời điểm đầu | Sau 1 phút | ||
| 1 | 25 | 235,40 | 235,13 |
| 2 | 35 | 235,78 | 235,21 |
Giả sử ban đầu cốc chứa dung dịch HCl và A có khối lượng 235,40 gam. Thực hiện thí nghiệm ở 45°C. Sau 1 phút khối lượng cốc có giá trị là 234,2 gam (Chỉ làm tròn kết quả ở bước cuối cùng đến hàng phần mười, bỏ qua khối lượng nước bay hơi trong các thí nghiệm).
Liệt kê các phát biểu đúng theo thứ tự tăng dần từ trái sang phải? (ví dụ: 123,…).
(Xem giải) Câu 32: Dầu ăn là sản phẩm phổ biến được sử dụng trong các căn bếp gia đình. Hàng ngày có hàng nghìn lít dầu ăn đã qua sử dụng bị thải loại. Người ta có thể tái chế dầu ăn đã qua sử dụng để sản xuất xà phòng bằng cách làm sau đây: Dầu ăn thừa đã lọc bỏ cặn, tạp chất sau đó đun nóng với dung dịch NaOH thu lấy xà phòng rồi trộn với phụ gia, đóng bánh tạo bánh xà phòng. Cho các phát biểu sau:
(1) Dầu ăn đã qua sử dụng nếu đổ trực tiếp ra môi trường sẽ gây ô nhiễm nguồn nước.
(2) Nếu muốn giảm chi phí, người ta có thể sử dụng dung dịch nước vôi trong dư để làm xà phòng từ dầu thừa.
(3) Dầu cá biển chứa nhiều acid béo omega-6. Các loại dầu thực vật (dầu mè, dầu đậu nành, dầu hướng dương,…) chứa nhiều acid béo omega-3.
(4) Ngoài cách sản xuất xà phòng từ dầu ăn đã qua sử dụng, xà phòng còn được sản xuất từ dầu mỏ.
(5) Một cơ sở sản xuất xà phòng lifebuoy trong một ngày sẽ sản xuất được 1612 bánh xà phòng (mỗi bánh xà phòng nặng 120 gam) chứa 72% muối của acid béo, khối lượng NaOH đã tham gia phản ứng là 25.10³ gam NaOH. Giả sử chỉ có 70% lượng chất béo ban đầu tham gia phản ứng. Cơ sở đã sử dụng 200333 gam chất béo (có chỉ số acid bằng 7) chứa 5% tạp chất để sản xuất số bánh xà phòng trên trong 1 ngày. (Chỉ làm tròn kết quả ở bước cuối cùng đến hàng đơn vị). (Biết chỉ số acid là số mg KOH cần dùng để trung hòa hết lượng acid béo tự do có trong 1 gam chất béo).
Liệt kê các phát biểu đúng theo thứ tự giảm dần từ trái sang phải? (ví dụ: 432,…).


Bình luận