[2025] Thi thử TN sở GDĐT Đắk Nông
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 161
⇒ Đề thi, đáp án và giải chi tiết:
| 1A | 2A | 3B | 4D | 5B | 6A | 7C | 8A | 9D |
| 10C | 11B | 12A | 13D | 14D | 15A | 16C | 17D | 18A |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | Đ | Đ | Đ | Đ | 61,5 | 3456 | 3,1 |
| (b) | S | Đ | S | Đ | 26 | 27 | 28 |
| (c) | S | Đ | S | S | 4 | 0,62 | 2,42 |
| (d) | S | S | Đ | Đ |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1: Hiện tượng phú dưỡng là một biểu hiện của môi trường ao, hồ bị ô nhiễm do dư thừa các chất dinh dưỡng. Sự dư thừa dinh dưỡng chủ yếu do hàm lượng các ion nào sau đây vượt quá mức cho phép?
A. Nitrate, phosphate. B. Chloride, sulfate. C. Sodium, potassium. D. Calcium, magnesium.
(Xem giải) Câu 2: Cao su thiên nhiên được khai thác từ mủ cây cao su. Cao su thiên nhiên có thành phần chính là polymer của isoprene (cấu trúc như hình bên).
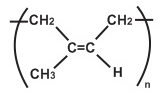
Cao su thiên nhiên không dẫn điện, không thấm nước và khí, có tính đàn hồi tốt nhưng tính đàn hồi chỉ tồn tại trong một khoảng nhiệt độ hẹp. Phát biểu nào sau đây sai?
A. Cao su thiên nhiên tan tốt được trong nước và trong xăng, dầu.
B. Lưu hóa cao su sẽ làm tăng tính cơ lí của cao su thiên nhiên.
C. Phân tử polymer của cao thu thiên có cấu hình cis.
D. Phân hủy cao su thiên nhiên bởi nhiệt thu được isoprene.
(Xem giải) Câu 3: Trimethylamine có công thức phân tử là
A. C3H7N. B. C3H9N. C. C2H7N. D. C3H7O2N.
(Xem giải) Câu 4: Phân tích một mẫu nước tự nhiên thấy chứa nhiều các ion: Na+, Ca2+, HCO3–, Cl– và SO42–. Chất nào sau đây không sử dụng để làm mềm mẫu nước trên?
A. Na2CO3. B. K2CO3. C. Na3PO4. D. KCl.
(Xem giải) Câu 5: Dung dịch chất nào sau đây không làm quỳ tím chuyển sang màu xanh?
A. Methylamine. B. Alanine. C. Lysine. D. Ethylamine.
(Xem giải) Câu 6: Ở điều kiện chuẩn, sức điện động của pin Zn-Cu và pin Mg-Zn lần lượt đo được là 1,10V và 1,61V. Sức điện động của pin Mg-Cu đo được ở điều kiện chuẩn là
A. 2,71V. B. 0,31V. C. 3,82V. D. 0,51V.
(Xem giải) Câu 7: Trong cơ thể người, ion Mg2+ (Z = 12) tham gia cấu trúc tế bào, tổng hợp protein và tổng hợp chất sinh năng lượng ATP. Tổng số hạt proton và electron của ion Mg2+ là
A. 26. B. 20. C. 22. D. 24.
(Xem giải) Câu 8: Hình dưới đây là ký hiệu của 6 polymer nhiệt dẻo phổ biến có thể tái chế:
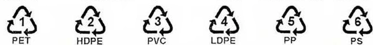
Các ký hiệu này thường được in trên bao bì, vỏ hộp, đồ dùng,… để giúp nhận biết vật liệu polymer cũng như thuận lợi cho việc thu gom, tái chế. Polymer có ký hiệu số 5 được điều chế bằng phản ứng trùng hợp monomer nào dưới đây?
A. CH2=CH-CH3. B. CH2=CH2. C. CH2=CH-CI. D. CH2=CH-C6H5.
(Xem giải) Câu 9: Chất nào sau đây thuộc loại chất béo:
A. (CH3COO)3C3H5. B. (C16H33COO)2C2H4.
C. (C15H31COO)3C4H7. D. (C17H29COO)3C3H5.
(Xem giải) Câu 10: Xét phản ứng giữa ethene với HBr: CH2 = CH2 + HBr → CH3CH2Br
Phản ứng xảy ra theo cơ chế cộng electrophile (tác nhân electrophile là các tiểu phân thiếu electron). Các giai đoạn của cơ chế diễn ra như sau:
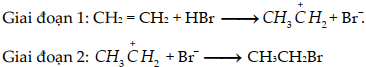
Nhận định nào sau đây đúng?
A. Tác nhân electrophile trong cơ chế trên là Br-.
B. Phản ứng giữa alkene với HBr luôn cho ra một sản phẩm.
C. Giai đoạn 2 là quá trình kết hợp giữa carbocation (tiểu phân mang điện tích dương trên nguyên tử carbon) với Br-.
D. Ở giai đoạn 1 có sự phá vỡ liên kết σ C-C.
(Xem giải) Câu 11: Geranyl acetate là hợp chất hữu cơ có trong tinh dầu hoa hồng và được sử dụng nhiều trong mĩ phẩm. Trong công nghiệp, geranyl acetate được điều chế theo sơ đồ sau:
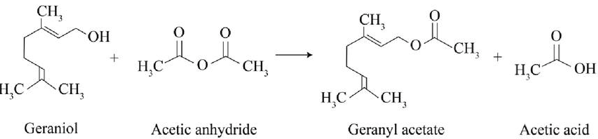
Công thức phân tử của geranyl acetate là
A. C12H18O2. B. C12H20O2. C. C12H22O2. D. C11H18O2.
(Xem giải) Câu 12: Sodium chloride là hợp chất có sẵn trong tự nhiên và có nhiều ứng dụng quan trong trong cuộc sống như làm gia vị thức ăn và trong công nghiệp như sản xuất sodium hydoxyde, chlorine,… Công thức của sodium chloride là
A. NaCl. B. KCl. C. NaClO. D. NaOH.
(Xem giải) Câu 13: Cho các kim loại kim: Fe – Cu; Fe – C; Fe – Zn; Fe – Mg. Khi để lâu trong không khí ẩm, số hợp kim trong đó Fe bị ăn mòn điện hóa là
A. 3. B. 4. C. 1. D. 2.
(Xem giải) Câu 14: Khi điện phân dung dịch CuSO4 bằng dòng điện một chiều (với điện cực anode bằng Cu) thì ở anode luôn ưu tiên xảy ra quá trình
A. khử H2O thành H2 và OH-. B. oxi hoá H2O thành H+ và O2.
C. khử Cu2+ thành Cu. D. oxi hoá Cu thành Cu2+.
(Xem giải) Câu 15: Trong mạng tinh thể kim loại chứa các cation kim loại được sắp xếp theo một trật tự nhất định cùng với các electron chuyển động
A. tự do trong toàn bộ mạng tinh thể. B. xung quanh một vị trí xác định.
C. trong một khu vực không gian nhất định. D. theo một quỹ đạo xác định.
(Xem giải) Câu 16: Insulin là hormon có tác dụng điều tiết lượng đường trong máu. Thủy phân một phần insulin thu được heptapeptit X mạch hở. Khi thủy phân không hoàn toàn X, thu được hỗn hợp có chứa các peptit: Glu-Gln-Cys. Gly-Ile-Val, Gln-Cys-Cys, Val-Glu-Gln. Nếu đánh số thứ tự amino axit đầu N là số 1 thì amino axit ở vị trí số 4 trong X là
A. Gln. B. Val. C. Glu. D. Cys.
(Xem giải) Câu 17: Carbohydrate nào sau đây có trong hoa quả, rau, củ, đặc biệt có nhiều trong thân cây mía, củ cải đường và hoa thốt nốt?
A. Cellulose. B. Fructose. C. Glucose. D. Saccharose.
(Xem giải) Câu 18: Một chất hữu cơ X có công thức phân tử C2H4O2, trên phổ IR thấy có tín hiệu số sóng trong vùng 1750 – 1670 cm-1. Cho X vào dung dịch NaOH (loãng, dư), thấy hỗn hợp tách thành 2 lớp riêng biệt; sau đó đun nhẹ vài phút thấy tạo thành dung dịch không màu, đồng nhất. Vậy X có thể là chất nào sau đây?
A. HCOOCH3. B. HOCH2CH2OH. C. HOCH2CHO. D. CH3COOH.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19: Tiến hành thí nghiệm xà phòng hóa chất béo:
• Bước 1: Cho vào bát sứ nhỏ khoảng 2 mL dầu dừa và 6 mL dung dịch NaOH 40%.
• Bước 2: Đun sôi nhẹ hỗn hợp, liên tục khuấy đều bằng đũa thủy tinh khoảng 30 phút và thỉnh thoảng thêm nước cất để giữ cho thể tích hỗn hợp không đổi rồi để nguội hỗn hợp.
• Bước 3: Rót thêm vào hỗn hợp 7-10 mL dung dịch NaCl bão hòa nóng, khuấy nhẹ rồi để yên hỗn hợp.
a) Sau bước 2 thấy có lớp chất rắn màu trắng chứa muối sodium của acid béo nổi lên.
b) Mục đích chính của việc thêm dung dịch NaCl ở bước 3 là làm tăng tốc độ của phản ứng xà phòng hoá
c) Ở bước 1, nếu thay mỡ lợn bằng dầu nhớt thì hiện tượng thí nghiệm sau bước 2 vẫn xảy ra tương tự.
d) Có thể thay dung dịch NaCl bão hòa bằng dung dịch HCl bão hòa.
(Xem giải) Câu 20: Glutamic acid có vai trò quan trọng trong quá trình xây dựng cấu trúc tế bào của con người. Ngoài ra, muối monosodium glutamate còn được dùng chế biến gia vị thức ăn (bột ngọt hay mì chính). Glutamic acid có cấu trúc như hình sau:
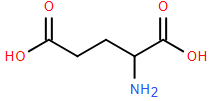
Glutamic acid có điểm đẳng điện pI = 3,2 (pI là giá trị pH mà khi đó amino acid có nồng độ ion lưỡng cực là cực đại. Khi pH < pI thì amino acid đó tồn tại chủ yếu ở dạng cation, còn khi pH > pI thì amino acid đó tồn tại chủ yếu ở dạng anion).
a) Glutamic acid thuộc loại hợp chất hữu cơ tạp chức, trong phân tử chứa hai loại nhóm chức.
b) Tên thay thế của glutamic acid là 2-aminopentane-1,5-dioic acid.
c) Trong dung dịch pH = 6, có thể tách hỗn hợp gồm glutamic acid và lysine (pl = 9,7) bằng phương pháp điện di.
d) Bột ngọt (mì chính) là một loại gia vị được sản xuất từ dung dịch NaOH 40% và tinh thể glutamic acid (chứa 80% acid) bằng cách dùng dung dịch NaOH trung hòa dung dịch glutamic acid đến pH = 6,8. Sau đó đem lọc, cô đặc và kểt tinh dung dịch sản phẩm bằng phương pháp sấy chân không ở nhiệt độ thấp. Bột ngọt thu được có độ tinh khiết 99 %. Giả thiết hiệu suất của cả quá trình tính theo glutamic acid là 85%. Để thu được 2 tấn bột ngọt cần tối thiểu 2,52 tấn tinh thể glutamic acid.
(Xem giải) Câu 21: Trong công nghiệp, kim loại Al được sản xuất từ nguyên liệu chính là quặng bauxite (thành phần chính là Al2O3.2H2O). Một nhà máy sản xuất nhôm bằng phương pháp điện phân nóng chảy Al2O3 với anode bằng than chì, ở hiệu điện thế U = 4,8V. Cho biết:
– Mỗi ngày nhà máy sản xuất 27 tấn Al với hiệu suất sử dụng điện năng 95%.
– Công của dòng điện (J) là A = UIt (U: hiệu điện thế (V), I: cường độ dòng điện (A), t: thời gian điện phân (s), số Faraday F = 96485 C/mol).
– Giá điện trung bình cho sản xuất là 1600 đồng .
– Khối lượng riêng của nhôm kim loại là 2,7 g/cm³.
– Giá bán nhôm thành phẩm là 80 triệu đồng/tấn.
Toàn bộ lượng nhôm thu được trong một ngày được đúc hết thành các tấm nhôm thành phẩm dạng hình hộp chữ nhật (dài 100 cm, rộng 50 cm, cao 10 cm).
a) Trong quá trình điện phân, khí thoát ra ở cực dương chủ yếu là CO2 và CO.
b) Trong quá trình điện phân tại cathode xảy ra quá trình oxi hóa Al3+.
c) Số tiền điện nhà máy chi cho quá trình điện phân Al2O3 mỗi ngày là 618 triệu đồng (kết quả làm tròn đến hàng đơn vị).
d) Giá thành mỗi tấm nhôm thành phẩm là 10,8 triệu đồng.
(Xem giải) Câu 22: Cellulose là thành phần chính tạo nên màng tế bào thực vật, làm nên bộ khung của cây. Thân cây, cành cây được dùng làm nguyên liệu để sản xuất đồ gỗ, sản xuất giấy,…
a) Cellulose có công thức (C6H10O5)n, phân tử cellulose cấu tạo từ nhiều đơn vị β-glucose qua liên kết β-1,4-glycoside và hình thành chuỗi không nhánh.
b) Hiện nay, xăng sinh học E5 (xăng chứa 5% ethanol về thể tích) đang được sử dụng ở nước ta để thay thế một phần xăng truyền thống. Trong một nhà máy, ethanol được sản xuất từ cellulose theo sơ đồ sau: Cellulose → Glucose → Ethanol. Toàn bộ lượng ethanol thu được từ 3,24 tấn mùn cưa (chứa 52% cellulose) pha chế được 15548 L xăng E5. Biết ethanol có khối lượng riêng là 0,8 g/mL, hiệu suất của cả quá trình sản xuất ethanol là 65%.
c) Cho 10 mL dung dịch H2SO4 70% vào cốc thủy tinh (dung tích 250mL), thêm một lượng nhỏ cellulose (bông) vào cốc và dùng đũa thủy tinh khuấy đều trong khoảng 1 phút thì thấy cellulose tan hết và thu được dung dịch đồng nhất.
d) Cellulose là chất rắn, dạng sợi, màu trắng, không tan trong nước ngay cả khi đun nóng nhưng tan trong nước Schweizer.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23: Để xác định độ tinh khiết của một mẫu quặng pyrite người ta cân chính xác 13 gam mẫu pyrite (thành phần chính là FeS2) không tinh khiết, thực hiện hai giai đoạn phản ứng:
(1) 4FeS2 + 11O2 (t°) → 2Fe2O3 + 8SO2
(2) Fe2O3 + 3CO (t°) → 2Fe + 3CO2
Sau khi kết thúc các phản ứng thu được 2,8 gam sắt. Biết hiệu suất toàn bộ quá trình là 75%. Phần trăm khối lượng của FeS2 tinh khiết có trong mẫu ban đầu là a%. Tính giá trị của a. (coi các tạp chất không tham gia phản ứng). (Kết quả làm tròn đến hàng phần muời)
(Xem giải) Câu 24: Cho các phát biểu sau:
(1) Dipeptide Gly-Ala có phản ứng màu biuret.
(2) Dung dịch glutamic acid đổi màu quỳ tím thành xanh.
(3) Methyl formate và glucose có cùng công thức đơn giản nhất.
(4) Methylamine có lực base mạnh hơn ammonia.
(5) Saccharose có phản ứng thủy phân trong môi trường acid.
(6) Methyl methacrylate làm mất màu nước bromine.
Phát biểu nào đúng? (Liệt kê theo số thư tự tăng dần: vd: 1234,23, …. )
(Xem giải) Câu 25: Trong công nghiệp sản xuất sulfuric acid, người ta dùng dung dịch H2SO4 98% để hấp thụ hoàn toàn SO3 tạo ra sản phẩm là oleum. Lấy 5,0 gam oleum sinh ra ở trên pha loãng với nước cất thu được 1000 mL dung dịch H2SO4 loãng (dung dịch X). Để xác định nồng độ H2SO4 trong X, người ta tiến hành chuẩn độ như sau:
• Bước 1: Rửa sạch burette loại 25 mL bằng nước cất, tráng lại bằng dung dịch chuẩn NaOH 0,1M rồi lắp burette lên giá đỡ, cho dung dịch chuẩn NaOH 0,1M vào burette, điều chỉnh dung dịch trong burette đến vạch 0.
• Bước 2: Hút chính xác 10,0 mL dung dịch X cho vào bình tam giác 250 mL. Thêm 3 – 4 giọt phenolphthalein, lắc đều.
• Bước 3: Mở khóa burette để dung dịch NaOH được nhỏ từ từ xuống bình tam giác, lắc đều cho đến khi dung dịch chuyển từ không màu sang màu hồng bền trong khoảng 30 giây thì dừng lại, ghi thể tích dung dịch NaOH đã dùng. Kết quả của 3 lần chuẩn độ như sau:
| Lần chuẩn độ | 1 | 2 | 3 |
| Thể tích dung dịch NaOH đã dùng (mL) | 11,7 | 11,8 | 11,7 |
Để sản xuất được 10 tấn oleum ở trên cần dùng m tấn dung dịch H2SO4 98%. Tính giá trị của m (làm tròn đến hàng phần chục).
(Xem giải) Câu 26: Cho các dung dịch sau: ethylene glycol, glucose, saccharose, fructose, tinh bột, cellulose. Có bao nhiêu chất có thể tham gia phản ứng với tạo dung dịch màu xanh lam?
(Xem giải) Câu 27: Phương pháp trao đổi ion để làm mềm nước cứng dựa trên sự thay thế các ion Mg2+ và Ca2+ trong nước cứng (kí hiệu chung là M2+) bằng các cation Na+, H+ có trong các gốc -SO3Na hoặc -SO3H được gắn vào trong nhựa trao đổi ion. Khi nước cứng đi qua nhựa, các ion Mg2+ và Ca2+ sẽ được giữ lại và các ion H+, Na+ từ nhựa sẽ đi vào nước theo phản ứng: M2+ + 2R-SO3X → (R-SO3)2M + 2X+ (trong đó X+ là H+ hoặc Na+). Một loại nhựa cationite có phần trăm khối lượng sulfur là 7,94% được sử dụng để loại bỏ các ion trong nước cứng. Nếu khối lượng nhựa cationite đó là 500 gam thì tổng số mol Mg2+ và Ca2+ tối đa có thể được loại bỏ là x mol. Giá trị của x là bao nhiêu? (Làm tròn kết quả đến hàng phần trăm)
(Xem giải) Câu 28: Calcium oxalate (CaC2O4) không tan trong nước. Tính chất này đã được sử dụng để phân lập và xác định lượng ion Ca2+ trong máu. Calcium oxalate phân lập từ máu được hòa tan trong acid và được chuẩn độ bằng dung dịch theo phản ứng:
MnO4- + C2O42- + H+ → Mn2+ + CO2 + H2O
Trong một thí nghiệm, người ta thấy rằng calcium oxalate được phân lập từ 10,0 mL một mẫu máu phản ứng vừa đủ với 24,2mL dung dịch KMnO4 0,001M. Tính số miligam calcium trong 10,0 mL mẫu máu trên.


Bình luận