[2022 – 2023] Thi học sinh giỏi lớp 12 – Bến Tre
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 180 phút
⇒ Đề thi, đáp án và giải chi tiết:
Câu 1. (3,0 điểm)
(Xem giải) 1. Một anion X- có tổng số hạt là 53, trong đó số hạt mang điện chiếm 66,04%.
a. Xác định kí hiệu và tên gọi của nguyên tử X.
b. Lập công thức hợp chất khí với hiđro của X. Gọi tên hợp chất khí đó.
c. Cho hợp chất khí (nói trên) tan vào nước thu được dung dịch Y. Chỉ dùng dung dịch Y làm thuốc thử, hãy nhận biết bốn dung dịch riêng biệt sau: Na2CO3, Na2SO3, Na2SO4, Na2S. Viết phương trình hoá học của các phản ứng xảy ra (nếu có).
(Xem giải) 2. So sánh và giải thích độ mạnh: tính axit, tính khử của các chất HF, HCl, HBr, HI.
Câu 2. (4,0 điểm)
(Xem giải) 1. Cho 3,424 gam hỗn hợp X gồm Mg, Cu tác dụng với 0,2 lít dung dịch AgNO3. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y và 9,696 gam chất rắn Z. Cho dung dịch NaOH dư vào dung dịch Y được kết tủa E. Lọc lấy kết tủa E, nung đến khối lượng không đổi thu được 2,08 gam chất rắn G. Viết các phương trình phản ứng xảy ra và xác định nồng độ mol của dung dịch AgNO3.
(Xem giải) 2. Cho X, Y là hai trong số bốn chất sau: NaCl, FeCl2, Fe(NO3)2 và Al(NO3)3. Hòa tan hoàn toàn hỗn hợp X, Y (có số mol bằng nhau) vào nước thu được dung dịch Z. Chia Z thành ba phần bằng nhau để tiến hành các thí nghiệm:
Thí nghiệm 1: Cho dung dịch NaOH dư vào phần 1, thu được n1 mol kết tủa.
Thí nghiệm 2: Cho dung dịch NH3 dư vào phần 2, thu được n2 mol kết tủa.
Thí nghiệm 3: Cho dung dịch AgNO3 dư vào phần 3, thu được n3 mol kết tủa.
Biết các phản ứng xảy ra hoàn toàn và n1 < n2 < n3. Hãy chọn cặp chất X, Y thỏa mãn và viết các phương trình phản ứng xảy ra.
Câu 3. (3,0 điểm)
(Xem giải) 1. Khí SO3 được tổng hợp trong công nghiệp theo phản ứng:
SO2 (k) + ½O2 (k) ⇌ SO3 (k) ΔH = -192,5 kJ
Hãy nêu các biện pháp làm tăng hiệu suất quá trình tổng hợp SO3.
(Xem giải) 2. Cho cân bằng hóa học sau: N2O4 (k) ⇌ 2NO2 (k) (1)
Thực nghiệm cho biết khối lượng mol phân tử trung bình của hai khí trên ở 35°C bằng 72,45 g/mol và ở 45°C bằng 66,80 g/mol.
a. Tính độ phân li của N2O4 ở mỗi nhiệt độ trên?
b. Tính hằng số cân bằng Kp của (1) ở mỗi nhiệt độ trên? Biết P = 1 atm.
c. Cho biết theo chiều nghịch, phản ứng thu nhiệt hay tỏa nhiệt?
Câu 4. (2,0 điểm)
(Xem giải) 1. Một học sinh trong lúc làm thí nghiệm sơ ý làm rơi vỡ nhiệt kế thủy ngân, làm chất độc thủy ngân rơi vãi xuống nền nhà. Với hóa chất sẵn có trong phòng thí nghiệm, em hãy trình bày cách xử lí để tránh gây ô nhiễm môi trường?
(Xem giải) 2. Cho sơ đồ điều chế khí O2 trong phòng thí nghiệm:
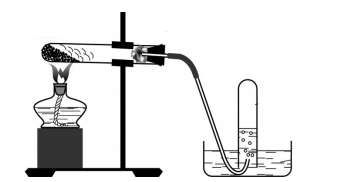
a. Chỉ ra ba chất có thể là X trong ống nghiệm ở sơ đồ trên, viết phương trình phản ứng minh họa.
b. Hãy giải thích tại sao trong thí nghiệm trên:
– Khí O2 lại được thu bằng phương pháp dời nước?
– Ống nghiệm khi lắp hơi chúc xuống và khi kết thúc thí nghiệm phải tháo ống dẫn khí trước khi tắt đèn cồn?
Câu 5. (3,0 điểm)
(Xem giải) 1. Thổi 672 ml (đktc) hỗn hợp khí A gồm một ankan, một anken và một ankin (đều có số nguyên tử cacbon trong phân tử bằng nhau) qua lượng dư dung dịch AgNO3/NH3, thì thấy có 3,4 gam AgNO3 đã tham gia phản ứng. Cũng lượng hỗn hợp khí A như trên làm mất màu vừa hết 200 ml dung dịch Br2 0,15 M.
a. Xác định công thức phân tử và tính khối lượng mỗi chất trong A.
b. Đề nghị phương pháp tách riêng từng chất ra khỏi hỗn hợp A.
(Xem giải) 2. Hỗn hợp X gồm 3 axit hữu cơ đơn chức, mạch hở gồm 1 axit no và 2 axit không no (chứa 1 liên kết π trong gốc). Cho m gam X phản ứng vừa đủ với 150 ml dung dịch NaOH 2M, thu được 25,56 gam muối. Đốt cháy hoàn toàn m gam X rồi hấp thụ toàn bộ sản phẩm cháy vào dung dịch NaOH dư thì khối lượng dung dịch tăng thêm 40,08 gam.
a. Tính tổng khối lượng 2 axit không no trong m gam hỗn hợp X nói trên.
b. Viết phương trình phản ứng hóa học của axit no nói trên lần lượt với: dung dịch KMnO4/H2SO4, etylen glicol (có xúc tác H2SO4 đặc).
Câu 6. (2,5 điểm)
(Xem giải) 1. Hợp chất hữu cơ X có MX < 200. Tỉ lệ khối lượng các nguyên tố trong X là mC : mH : mO = 36 : 5 : 40. Khi cho X tác dụng với Na dư hoặc NaHCO3 dư đều cho số mol khí bằng số mol X đã phản ứng. Mặt khác, X tác dụng với NaOH trong dung dịch theo tỉ lệ mol 1 : 2, thu được dung dịch chỉ chứa một muối. Viết công thức cấu tạo có thể có của X.
(Xem giải) 2. Chất X là một amino axit có mạch cacbon không phân nhánh. Cho 0,02 mol X tác dụng vừa đủ với 80 ml dung dịch HCl 0,25M. Sau phản ứng, đem cô cạn dung dịch thu được 3,67 muối khan. Mặt khác, đem trung hòa 1,47 gam X với một lượng vừa đủ dung dịch NaOH. Cô cạn dung dịch sau phản ứng thu được 1,91 gam muối khan. Xác định công thức cấu tạo của X (Giả thiết các phản ứng xảy ra hoàn toàn).
Câu 7. (2,5 điểm)
(Xem giải) 1. Cho a gam hỗn hợp gồm Fe, Cu và Al vào bình đựng 300 ml dung dịch H2SO4 0,1 M. Sau khi các phản ứng xảy ra hoàn toàn, thu được một chất rắn và có 448 ml khí (đktc) thoát ra. Thêm tiếp NaNO3 vào bình, lượng NaNO3 phản ứng tối đa là 0,425 gam, khi các phản ứng kết thúc thu được khí NO (đktc, sản phẩm khử duy nhất) và khối lượng muối trong dung dịch là 3,865 gam. Tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp đầu.
(Xem giải) 2. Hòa tan hoàn toàn m gam hỗn hợp CuCl2 và KCl vào nước thu được dung dịch X. Tiến hành điện phân X với các điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Tổng số mol khí thu được trên cả hai điện cực (n) phụ thuộc vào thời gian điện phân (t) được mô tả như đồ thị bên dưới (đồ thị gấp khúc tại các điểm M, N).
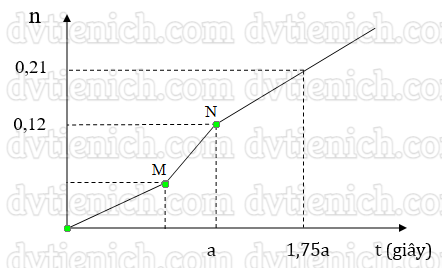
Giả thiết hiệu suất điện phân là 100%, bỏ qua sự bay hơi của nước. Hãy xác định giá trị của m.


Bình luận