Giải đề thi ĐH-CĐ năm 2005 – Khối A
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 180 phút
Câu I (1,5 điểm)
(Xem giải) 1. Viết cấu hình electron, xác định vị trí (ô, chu kỳ, phân nhóm, nhóm) của lưu huỳnh (Z = 16) trong bảng hệ thống tuần hoàn các nguyên tố hoá học. Viết phương trình phản ứng hóa học của H2S với O2, SO2, nước clo. Trong các phản ứng đó H2S có tính khử hay tính oxi hóa, vì sao?
(Xem giải) 2. Hãy điều chế canxi kim loại và magie kim loại từ quặng đôlômit (CaCO3.MgCO3) với điều kiện chỉ dùng nước, dung dịch HCl (các thiết bị thí nghiệm có đủ).
(Xem giải) Câu II (1,5 điểm)
Viết các phương trình phản ứng hoá học dưới dạng công thức cấu tạo rút gọn của các chất theo các dãy chuyển hoá sau (cho biết A2 và A3 là các sản phẩm chính):
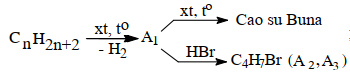
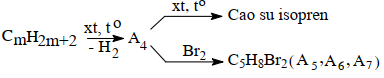
Câu III (1,5 điểm)
(Xem giải) 1. Chỉ được sử dụng một dung dịch chứa một chất tan để nhận biết các dung dịch muối sau: Al(NO3)3, (NH4)2SO4, NaNO3, NH4NO3, MgCl2, FeCl2 đựng trong các lọ riêng biệt bị mất nhãn. Viết các phương trình phản ứng hoá học xảy ra.
(Xem giải) 2. Đốt cháy hoàn toàn 33,4 gam hỗn hợp B1 gồm bột các kim loại Al, Fe và Cu ngoài không khí, thu được 41,4 gam hỗn hợp B2 gồm 3 oxit. Cho toàn bộ hỗn hợp B2 thu được tác dụng hoàn toàn với dung dịch H2SO4 20 % có khối lượng riêng d = 1,14 g/ml.
a) Viết các phương trình phản ứng hoá học xảy ra.
b) Tính thể tích tối thiểu của dung dịch H2SO4 20 % để hòa tan hết hỗn hợp B2.
Câu IV (1,5 điểm)
1.
(Xem giải) a) Viết các phương trình phản ứng hoá học chứng tỏ phenol có tính axit, nhưng là axit yếu.
(Xem giải) b) Axit fomic có thể cho phản ứng tráng gương với bạc oxit trong dung dịch amoniac và phản ứng khử Cu(OH)2 thành kết tủa đỏ gạch Cu2O. Giải thích và viết các phương trình phản ứng hoá học xảy ra.
(Xem giải) 2. Đốt cháy hoàn toàn 1,04 gam một hợp chất hữu cơ D cần vừa đủ 2,24 lít khí O2 (đktc), chỉ thu được khí CO2, hơi H2O theo tỉ lệ thể tích VCO2 : VH2O = 2 : 1 ở cùng điều kiện nhiệt độ và áp suất. Xác định công thức phân tử, công thức cấu tạo của D, biết tỉ khối hơi của D so với hiđro bằng 52, D chứa vòng benzen và tác dụng được với dung dịch brom. Viết phương trình phản ứng hóa học xảy ra.
(Xem giải) Câu V (2,0 điểm)
Hỗn hợp bột E1 gồm Fe và kim loại R có hóa trị không đổi. Trộn đều và chia 22,59 gam hỗn hợp E1 thành ba phần bằng nhau. Hoà tan hết phần một bằng dung dịch HCl thu được 3,696 lít khí H2. Phần hai tác dụng hoàn toàn với dung dịch HNO3 (loãng), thu được 3,36 lít khí NO (là sản phẩm khử duy nhất).
1. Viết các phương trình phản ứng hoá học xảy ra và xác định tên của kim loại R. Biết các thể tích khí đo ở đktc.
2. Cho phần ba vào 100 ml dung dịch Cu(NO3)2, lắc kỹ để Cu(NO3)2 phản ứng hết, thu được chất rắn E2 có khối lượng 9,76 gam. Viết các phương trình phản ứng hoá học xảy ra và tính nồng độ mol/l của dung dịch Cu(NO3)2.
(Xem giải) Câu VI (2,0 điểm)
Cho 0,1 mol một este G1 tác dụng vừa đủ với 100 ml dung dịch NaOH 2M, thu được hỗn hợp hai muối của hai axit hữu cơ mạch hở G2, G3 đều đơn chức và 6,2 gam một rượu G4. Axit hữu cơ G2 no, không tham gia phản ứng tráng gương. Axit G3 không no, chỉ chứa một liên kết đôi (C=C), có mạch cacbon phân nhánh. Đốt cháy hết hỗn hợp hai muối thu được ở trên tạo ra Na2CO3, CO2 và H2O. Cho toàn bộ khí cacbonic và hơi nước sinh ra đi qua bình đựng dung dịch Ca(OH)2 dư, thu được 50 gam kết tủa.
1. Viết các phương trình phản ứng hoá học xảy ra.
2. Xác định công thức cấu tạo của rượu G4, của hai axit G2, G3 và của este G1.


Bình luận