[2019] Khảo sát chất lượng đầu năm THPT Hàn Thuyên – Hóa 11
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Giải chi tiết và đáp án:
| 1D | 2D | 3C | 4D | 5B | 6B | 7B | 8B | 9C | 10B |
| 11B | 12D | 13C | 14D | 15D | 16B | 17D | 18C | 19C | 20B |
| 21A | 22C | 23A | 24A | 25A | 26D | 27A | 28A | 29C | 30B |
| 31C | 32D | 33A | 34A | 35B | 36C | 37A | 38A | 39D | 40C |
Câu 1: Cấu hình electron của nguyên tử kim loại X là 1s2 2s2 2p6 3s2 3p1. Vậy kim loại X là
A. Li B. Mg C. Na D. Al
(Xem giải) Câu 2: Công thức phân tử nào dưới đây của một loại oleum là đúng?
A. H2S3O9. B. H2S3O7. C. H2S2O6. D. H2S2O7.
Câu 3: Chất nào sau đây thường được dùng để chống nấm mốc lương thực, thực phẩm và tẩy trắng bột giấy?
A. Cl2 B. O3 C. SO2 D. O2
Câu 4: Khi đun nấu thức ăn, nếu củi được chẻ nhỏ thì quá trình cháy xảy ra nhanh hơn. Vậy người ta đã dựa vào yếu tố nào sau đây để tăng tốc độ phản ứng?
A. nhiệt độ B. nồng độ C. áp suất D. diện tích tiếp xúc
Câu 5: Không dùng lọ thuỷ tinh đựng dung dịch axit nào sau đây?
A. HCl B. HF C. H2SO4 D. HI
Câu 6: Để làm khô khí Sunfurơ (SO2) có lẫn hơi nước ta có thể dùng chất nào dưới đây?.
A. CaO B. H2SO4 đặc C. NaOH khan D. H2SO4 loãng
Câu 7: Nguyên tố nào sau đây không thuộc nhóm VIA trong bảng tuần hoàn các nguyên tố hóa học?
A. Selen (Se). B. Clo (Cl). C. Lưu huỳnh (S). D. Oxi (O).
(Xem giải) Câu 8: Cho phương trình hóa học của phản ứng: X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
A. 7,5.10^-4 mol/(l.s). B. 1,0.10^-4 mol/(l.s). C. 4,0.10^-4 mol/(l.s). D. 5,0.10^-4 mol/(l.s).
Câu 9: Cặp kim loại nào dưới đây thụ động trong H2SO4 đặc nguội.
A. Zn, Al. B. Zn, Fe. C. Al, Fe. D. Cu, Fe.
Câu 10: Cho phản ứng sau: Mg + H2SO4 → MgSO4 + H2S + H2O. Tổng hệ số các chất (số nguyên tối giản) sau khi cân bằng là
A. 10. B. 18. C. 9. D. 19
Câu 11: Tốc độ phản ứng không phụ thuộc vào yếu tố nào sau đây?
A. Chất xúc tác. B. Thời gian xảy ra phản ứng.
C. Nồng độ của các chất phản ứng. D. Bề mặt tiếp xúc giữa các chất phản ứng.
Câu 12: Để phân biệt CO2 và SO2 chỉ cần dùng thuốc thử là
A. Dung dịch Ba(OH)2 B. CaO C. Dung dịch NaOH D. Nước brom
Câu 13: Để pha loãng dung dịch H2SO4 đậm đặc trong phòng thí nghiệm, người ta tiến hành theo cách nào dưới đây?
A. Cho nhanh axit vào nước và khuấy đều. B. Cho nhanh nước vào axit và khuấy đều.
C. Cho từ từ axit vào nước và khấy đều. D. Cho từ từ nước vào axit và khuấy đều.
(Xem giải) Câu 14: Cho cân bằng phản ứng: N2 (k) + O2 (k) ⇔ 2NO (k); ∆H > 0. Cặp yếu tố nào sau đây đều ảnh hưởng đến sự chuyển dịch cân bằng trên?
A. Nồng độ và chất xúc tác B. Áp suất và nồng độ
C. Áp suất và nhiệt độ D. Nhiệt độ và nồng độ
Câu 15: Nguyên tố Oxi có cấu hình electron 1s2 2s2 2p4. Vị trí của nguyên tố Oxi trong bảng tuần hoàn các nguyên tố hóa học là
A. chu kì 3, nhóm VIA B. chu kì 4, nhóm IIA C. chu kì 2, nhóm IVA D. chu kì 2, nhóm VIA
(Xem giải) Câu 16: Trong tự nhiên kali có 2 đồng vị 19K39 và 19K41 (chiếm 6,5%). Thành phần phần trăm khối lượng của 19K39 trong KClO3 là?
A. 28,1% B. 29,7% C. 26,3% D. 28,2%
(Xem giải) Câu 17: Cho hình vẽ mô tả sự điều chế Clo trong phòng thí nghiệm như sau :
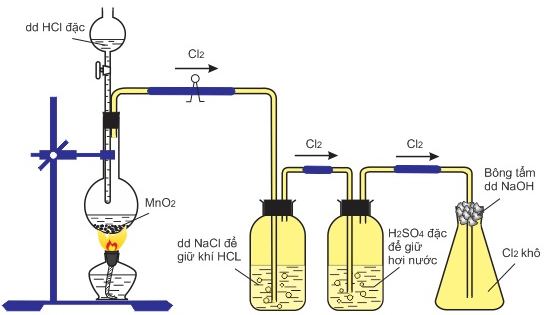
Phát biểu nào sau đây không đúng :
A. Không thể thay dung dịch HCl đặc bằng dung dịch NaCl.
B. Khí Clo thu được trong bình eclen là khí Clo khô.
C. Có thể thay MnO2 bằng KMnO4.
D. Có thể thay H2SO4 đặc bằng CaO khan.
(Xem giải) Câu 18: Cho phản ứng: NaX(rắn) + H2SO4(đặc) → NaHSO4 + HX(khí). Các hidro halogenua (HX) có thể điều chế theo phản ứng trên là
A. HBr và HI. B. HCl, HBr và HI.
C. HF và HCl. D. HF, HCl, HBr và HI.
Câu 19: Trái cây được bảo quản lâu hơn trong môi trường vô trùng. Trong thực tế, người ta sử dụng nước ozon để bảo quản trái cây. Ứng dụng trên dựa vào tính chất nào sau đây?
A. Ozon trơ về mặt hóa học. B. Ozon là chất khí có mùi đặc trưng.
C. Ozon là chất có tính oxi hóa mạnh. D. Ozon không tác dụng được với nước .
Câu 20: Điều khẳng định nào sau đây là đúng khi nói về ion đơn nguyên tử X2- có:
A. số p – số e = 2. B. số e – số p = 2.
C. số e – (số p + số n) = 2. D. số e = số p.
(Xem giải) Câu 21: Thực hiện các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH loãng ở nhiệt độ thường.
(b) Cho Fe3O4 vào dung dịch HCl loãng (dư).
(c) Cho hỗn hợp FeO và Fe2O3 vào dung dịch H2SO4 đặc, nóng (dư).
(d) Cho hỗn hợp Cu và FeO vào dung dịch H2SO4 loãng (dư).
Sau khi phản ứng kết thúc, số thí nghiệm tạo ra hai muối là
A. 2. B. 4. C. 1. D. 3.
Câu 22: Các khí sinh ra khi cho dung dịch H2SO4 đặc, nóng dư vào đường Saccarozơ (C12H22O11) là:
A. H2S và SO2 B. SO3 và CO2 C. SO2 và CO2 D. H2S và CO2
(Xem giải) Câu 23: Cho sơ đồ biến hóa sau:

Trong 6 phản ứng trên có bao nhiêu phản ứng oxi hóa – khử?
A. 5. B. 3. C. 4. D. 6.
(Xem giải) Câu 24: Oxit cao nhất của nguyên tố R ứng với công thức RO2. Trong hợp chất khí của R với hiđro, R chiếm 75% về khối lượng. Khẳng định nào sau đây là sai ?
A. Phân tử RO2 là phân tử phân cực.
B. Lớp ngoài cùng của nguyên tử R (ở trạng thái cơ bản) có 4 electron.
C. Độ âm điện của nguyên tử nguyên tố R lớn hơn độ âm điện của nguyên tử nguyên tố hiđro.
D. Liên kết hóa học giữa các nguyên tử trong phân tử RO2 là liên kết cộng hóa trị có cực.
Câu 25: Để nhận biết ion sunfat (SO42-) trong dung dịch ta có thể dùng thuốc thử nào dưới đây?
A. dung dịch muối bari B. dung dịch muối kali
C. dung dịch muối natri D. dung dịch muối magie
(Xem giải) Câu 26: Hỗn hợp X gồm Zn, Mg và Fe. Hòa tan hết 23,40 gam hỗn hợp X vào dung dịch HCl thu được 11,20 lít khí (đktc). Để tác dụng với vừa hết 23,40 gam hỗn hợp X cần 12,32 lít khí Clo (đktc). Khối lượng của Fe trong hỗn hợp X là:
A. 8,4 gam. B. 2,8 gam. C. 11,2 gam. D. 5,6 gam.
(Xem giải) Câu 27: Đốt cháy 4,16 gam hỗn hợp gồm Mg và Fe trong khí O2, thu được 5,92 gam hỗn hợp X chỉ gồm các oxit. Hòa tan hoàn toàn X trong dung dịch HCl vừa đủ, thu được dung dịch Y. Cho dung dịch NaOH dư vào Y, thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi, thu được 6 gam chất rắn. Mặt khác cho Y tác dụng với dung dịch AgNO3 dư, thu được m gam kết tủa. Biết rằng; trong dung dịch Ag+ oxi hóa được Fe2+ thành Fe3+ và bị khử thành Ag. Giá trị của m gần nhất là
A. 32,5 B. 31,5 C. 33,0 D. 32,0
(Xem giải) Câu 28: Cho hỗn hợp khí oxi và ozon, sau thời gian ozon bị phân hủy hết (2O3 → 3O2) thì thể tích khí tăng lên 30% so với ban đầu (cùng điều kiện nhiệt độ và áp xuất). Tỉ lệ thể tích của oxi và ozon trong hỗn hợp ban đầu là:
A. 2 : 3 B. 3 : 2 C. 1 : 2 D. 2 : 1
(Xem giải) Câu 29: Trộn KMnO4 và KClO3 với một lượng bột MnO2 trong bình kín được hỗn hợp X. Lấy 52,550 gam X đem nung nóng, sau một thời gian thu được hỗn hợp chất rắn Y và V lít khí O2. Biết KClO3 bị nhiệt phân hoàn toàn tạo 14,9 gam KCl chiếm 36,315 % khối lượng Y. Sau đó, cho toàn bộ Y tác dụng hoàn toàn với axit HCl đặc dư đun nóng, sau phản ứng cô cạn dung dịch thu được 51,275 gam muối khan. Hiệu suất của phản ứng nhiệt phân muối KMnO4 trong X là
A. 75,0%. B. 62,5%. C. 80,0%. D. 90,0%.
(Xem giải) Câu 30: Thổi một luồng CO qua hỗn hợp Fe và Fe2O3 nung nóng được chất khí B và hỗn hợp D gồm Fe, FeO, Fe3O4 và Fe2O3. Cho B lội qua dung dịch nước vôi trong dư thấy tạo 6 gam kết tủa. Hòa tan D bằng H2SO4 đặc, nóng dư thấy tạo ra 0,18 mol SO2 và dung dịch E. Cô cạn E thu được 24 gam muối khan. Thành phần phần trăm của Fe trong hỗn hợp ban đầu là
A. 41,67%. B. 58,33%. C. 50%. D. 40%.
(Xem giải) Câu 31: Hòa tan hoàn toàn 12,45 gam hỗn hợp kim loại X gồm Mg, Al, Zn, Fe trong dung dịch H2SO4 loãng vừa đủ, thu được V lít khí (đktc) và dung dịch Y. Cô cạn dung dịch Y thu được 41,25 gam muối khan. Giá trị của V là:
A. 3,36 lit B. 4,48 lit C. 6,72 lit D. 2,24 lit
(Xem giải) Câu 32: Từ 400 kg quặng có chứa 60% FeS2 (còn lại là tạp chất không chứa lưu huỳnh) ta có thể sản xuất được bao nhiêu kg dung dịch H2SO4 95%. Giả sử khối lượng bị hao hụt trong quá trình sản xuất là 5%.
A. 240,0kg B. 412,6kg C. 372,4kg D. 392,0kg
(Xem giải) Câu 33: Đun nóng một hỗn hợp gồm Fe và S đến khi kết thúc phản ứng thu được chất rắn X. Cho X tan hoàn toàn trong dung dịch HCl dư thu được 2,24 lít (đktc) hỗn hợp khí Y. Tỉ khối hơi của Y so với hiđro bằng 9. Khối lượng của Fe và S trong hỗn hợp ban đầu tương ứng là
A. 5,6 và 1,6 B. 2,8 và 1,6 C. 5,6 và 3,2 D. 2,8 và 3,2
(Xem giải) Câu 34: Cho một kim loại vào dung dịch H2SO4 thấy thoát ra 5,6 lit khí (đktc). Sục toàn bộ khí đó vào dung dịch NaOH dư thấy dung dịch nặng thêm 8,5 gam. Muối thu được sau phản ứng với dung dịch NaOH là
A. Na2S B. NaHS C. NaHSO3 D. Na2SO3
(Xem giải) Câu 35: Hoà tan 1,92 gam kim loại M (hoá trị n) vào dung dịch HCl và H2SO4 loãng (vừa đủ), thu được 1,792 lít khí H2 (đktc). Kim loại M là
A. Al. B. Mg. C. Cu. D. Fe.
(Xem giải) Câu 36: Hoà tan hoàn toàn 3,80 gam hỗn hợp hai kim loại kiềm thuộc hai chu kì liên tiếp trong dung dịch HCl dư, thu được 2,24 lít khí H2 (đktc). Hai kim loại kiềm đó là
A. K và Rb. B. Na và K. C. Li và Na. D. Li và K.
(Xem giải) Câu 37: Ở trạng thái cơ bản:
– Phân lớp electron ngoài cùng của nguyên tử nguyên tố X là np2n+1.
– Tổng số electron trên các phân lớp p của nguyên tử nguyên tố Y là 7.
– Số hạt mang điện trong nguyên tử nguyên tố Z nhiều hơn số hạt mang điện trong nguyên tử nguyên tố X là 20 hạt. Nhận xét nào sau đây là sai?
A. Số oxi hóa cao nhất của X trong hợp chất là +7.
B. Oxit và hiđroxit của Y có tính lưỡng tính.
C. Nguyên tố X và Y thuộc 2 chu kì kế tiếp.
D. Độ âm điện giảm dần theo thứ tự X, Y, Z.
(Xem giải) Câu 38: Hỗn hợp X gồm các kim loại Mg, Al, Zn. Lấy m gam hỗn hợp X tác dụng hết với dung dịch HCl (dư), thu được 6,72 lít khí (ở đktc). Cũng lấy m gam X tác dụng hết với dung dịch H2SO4 đặc, nóng (dư), thu được V lít khí SO2 (sản phẩm khử duy nhất, ở đktc) và (m + a) gam muối. Giá trị của V và a lần lượt là
A. 6,72 và 28,8. B. 6,72 và 57,6. C. 3,36 và 14,4. D. 3,36 và 28,8.
(Xem giải) Câu 39: Nung m gam hỗn hợp X gồm FeS và FeS2 trong một bình kín chứa không khí (gồm 20% thể tích O2 và 80% thể tích N2) đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn và hỗn hợp khí Y có thành phần thể tích: N2 = 83,33%; SO2 = 10,42% còn lại là O2. Thành phần % theo khối lượng của FeS trong X là
A. 12,67%. B. 26,83%. C. 66,52%. D. 9,29%.
Câu 40: Mệnh đề nào sau đây đúng?
A. Bất cứ phản ứng hóa học nào cũng phải đạt đến trạng thái cân bằng hóa học.
B. Khi phản ứng thuận nghịch ở trạng thái cân bằng thì phản ứng dừng lại.
C. Chỉ có những phản ứng thuận nghịch mới có trạng thái cân bằng hóa học.
D. Ở trạng thái cân bằng, lượng chất ở 2 vế của phương trình hóa học luôn bằng nhau.

Bình luận