Tổng hợp Lý thuyết hóa vô cơ (Phần 1)
⇒ Đáp án: (Chưa kiểm duyệt)
| 1A | 2A | 3B | 4D | 5B | 6A | 7D | 8D | 9D | 10C |
| 11C | 12D | 13D | 14C | 15C | 16C | 17C | 18D | 19B | 20A |
| 21C | 22A | 23A | 24D | 25C | 26D | 27A | 28A | 29D | 30C |
| 31D | 32C | 33B | 34B | 35B | 36A | 37D | 38D | 39C | 40C |
| 41D | 42B | 43C | 44A | 45C | 46C | 47D | 48C | 49C | 50B |
Câu 1. Cho Fe3O4 vào dung dịch H2SO4 loãng dư thu được dung dịch X. Dung dịch X tác dụng được với bao nhiêu chất trong các chất sau: Cu, NaNO3, AgNO3, Fe(NO3)3, HCl.
A. 4 B. 3 C. 5 D. 2
Câu 2. Cho các phân tử sau: MgCl2, HBr, Cl2, KNO3, NH4Cl, K2O, NaBr, HNO3. Số chất có chứa liên kết ion trong phân tử là.
A. 5 B. 3 C. 6 D. 4
Câu 3. Thực hiện các thí nghiệm sau:
(1) Sục khí CO2 đến dư vào dung dịch Na[Al(OH)4].
(2) Sục khí CO2 đến dư vào dung dịch Ca(OH)2.
(3) Sục khí NH3 đến dư vào dung dịch AlCl3.
(4) Sục khí NH3 đến dư vào dung dịch CuSO4.
(5) Sục khí H2S đến dư vào dung dịch FeCl2.
(6) Sục khí H2S đến dư vào dung dịch CuSO4.
Sau khi kết thúc thí nghiệm, số trường hợp thu được kết tủa là.
A. 4 B. 3 C. 5 D. 2
Câu 4. Nhúng thanh Zn vào dung dịch HCl, sau đó cho vài giọt CuCl2 vào. Hiện tương quan sát được là.
A. Thanh kẽm tan ít đi do có một lượng đồng kim loại bám vào.
B. Khí thoát ra ít hơn do có một lượng đồng bám vào thanh kẽm, ngăn cách thanh kẽm tiếp xúc với dung dịch HCl.
C. Thanh kẽm tan ra nhanh hơn nhưng khí thoát ra ít hơn.
D. Thanh kẽm tan ra nhanh hơn và khí thoát ra nhiều hơn.
Câu 5. Cho các nhận định sau:
(1) Nước cứng là nước chứa nhiều ion Ca2+ và Mg2+.
(2) Phương pháp làm mềm nước cứng tạm thời bằng cách đun nóng.
(3) Nước cứng làm mất tác dụng của xà phòng.
(4) Có thể dùng dung dịch HCl để làm mềm nước cứng tạm thời.
(5) Dung dịch Na3PO4 được sử dụng đề làm mềm nước cứng vĩnh cữu.
Số nhận định đúng là.
A. 5 B. 4 C. 3 D. 6
Câu 6. Thực hiện các thí nghiệm sau:
(1) Cho bột Fe vào dung dịch CuCl2.
(2) Điện phân dung dịch CuSO4 bằng điện cực trơ.
(3) Điện phân nóng chảy Al2O3.
(4) Nung nóng hỗn hợp gồm Al và Fe2O3 (tỉ lệ mol 2 : 1)
(5) Thổi luồng khí CO đến dư qua ống sứ chứa CuO.
(6) Cho Na vào dung dịch CuSO4.
Sau khi kết thúc thí nghiệm, số trường hợp thu được đơn chất là.
A. 6 B. 4 C. 5 D. 3
Câu 7. Cho cân bằng sau: 2SO2 (k) + O2 (k) → 2SO3 (k). Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này là.
A. Phản ứng thuận thu nhiệt (ΔH > 0), cân bằng chuyển dịch theo chiều nghịch khi tăng nhiệt độ.
B. Phản ứng nghịch tỏa nhiệt (ΔH < 0), cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
C. Phản ứng nghịch thu nhiệt (ΔH > 0), cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
D. Phản ứng thuận tỏa nhiệt (ΔH < 0), cân bằng chuyển dịch theo chiều nghịch khi tăng nhiệt độ.
Câu 8. Phản ứng nào sau đây là sai?
A. Al + NaOH + 3H2O → Na[Al(OH)4] + H2
B. 3NH3 + AlCl3 + 3H2O → 3NH4Cl + Al(OH)3
C. (NH4)2CO3 + Ca(OH)2 → CaCO3 + 2NH3 + 2H2O
D. 2Fe + 6H2SO4 (đặc, nguội) → Fe2(SO4)3 + 3SO2 + 6H2O
Câu 9. Nhận định nào sau đây là đúng?
A. Theo chiều tăng dần điện tích hạt nhân, các kim loại kiềm có nhiệt độ nóng chảy tăng dần.
B. Các kim loại kiềm thổ đều tan trong nước khi đun nóng.
C. Nhôm tan được trong môi trường axit và bazơ nên nhôm có tính chất lưỡng tính
D. Trong mọi hợp chất, Flo chỉ có duy nhất một mức oxi hóa là -1.
Câu 10. Nguyên tử của nguyên tố X có cấu hình electron là [Ne] 3s2 3p1. Nguyên tử nguyên tố Y có tổng số electron ở các phân lớp p là 11. Cho các nhận định sau:
(1) X là kim loại phổ biến trong võ trái đất.
(2) Y thuộc nhóm halogen.
(3) Điều chế kim loại X bằng cách điện phân nóng chảy XY3.
(4) Oxit và hydroxit của X có tính chất lưỡng tính.
(5) Y được dùng để khử trùng nước
(6) Tổng số hiệu của X, Y là 30.
Số nhận định đúng là.
A. 6 B. 4 C. 5 D. 3
Câu 11. Nhận định nào sau đây là sai?
A. Phèn chua có công thức là K.Al(SO4)2.12H2O.
B. Thạch cao nung có công thức là CaSO4.H2O.
C. Urê có công thức là (NH4)2CO.
D. Amophot là phân phức hợp có công thức (NH4)2HPO4 và NH4H2PO4.
Câu 12. Thực hiện các thí nghiệm sau:
(1) Sục khí CO2 đến dư vào dung dịch Na[Al(OH)4].
(2) Sục khí CO2 đến dư vào dung dịch Ca(OH)2.
(3) Sục khí NH3 đến dư vào dung dịch AlCl3.
(4) Sục khí NH3 đến dư vào dung dịch CuCl2.
Sau khi kết thúc thí nghiệm, số trường hợp thu được kết tủa là.
A. (1) và (2) B. (2) và (4) C. (3) và (4) D. (1) và (3)
Câu 13. Phản ứng nào sau đây xảy ra ăn mòn điện hóa.
A. Fe + 2FeCl3 → 3FeCl2 B. 3Fe + 2O2 → Fe3O4
C. Fe + 2HCl → FeCl2 + H2 D. Fe + CuCl2 → FeCl2 + Cu
Câu 14. Nhận định nào sau đây là đúng.
A. Các kim loại kiềm đều có cấu trúc lập phương tâm diện.
B. Các kim loại kiềm thổ (từ Be đến Ca) tác dụng được với nước khi đun sôi.
C. Các kim loại đều có tính dẫn điện, dẫn nhiệt và có tính ánh kim.
D. Ở trạng thái tự nhiên, các kim loại đều ở thể rắn.
Câu 15. Phản ứng nào sau đây là phản ứng oxi hóa – khử.
A. Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O.
B. Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O.
C. Cl2 + 2NaOH → NaCl + NaClO + H2O.
D. ZnO + 2NaOH + H2O → Na2[Zn(OH)4].
Câu 16. Thí nghiệm nào sau đây thu được kết tủa sau khi kết thúc phản ứng.
A. Nhỏ từ từ đến dư dung dịch NH3 vào dung dịch CuCl2.
B. Sục khí H2S vào dung dịch AlCl3.
C. Hòa tan urê trong dung dịch nước vôi trong dư
D. Nhỏ từ từ đến dư dung dịch H2SO4 vào dung dịch NaAlO2.
Câu 17. Nguyên tử của nguyên tố X có tổng số electron ở phân lớp s là 5. Nguyên tử của nguyên tố Y có tổng số electron ở phân lớp p là 11. Cho các nhận định sau:
(1) X là kim loại nhẹ; Y là nguyên tố halogen.
(2) Bán kính của X lớn hơn bán kính của Y.
(3) Tổng số hiệu của X và Y là 40.
(4) X được dùng chế tạo tế bào quang điện; Y được dùng để khử trùng nước.
(5) Trong công nghiệp, X và Y được điều chế bằng cách điện phân nóng cháy hợp chất XY.
(6) Trong mọi hợp chất, X luôn có mức oxi hóa +1; còn Y luôn có mức oxi hóa -1.
Nhận định sai là.
A. 4 B. 1 C. 3 D. 2
Câu 18. Nhận định nào sau đây là đúng.
A. Ta dùng dung dịch HCl để làm mềm nước cứng tạm thời.
B. Trong mọi hợp chất, hydro chỉ có một mức oxi hóa duy nhất là +1.
C. Cation Fe2+ bền hơn cation Fe3+.
D. Nhôm là kim loại phổ biến nhất trong võ trái đất.
Câu 19. Cho (x + 2y) mol Ba vào dung dịch X chứa NH4+; Ba2+ và HCO3-, đun nóng cho các phản ứng xảy ra hoàn toàn, thu được (2x + 2y) mol khí; (x + 2y) mol kết tủa và dung dịch Y. Chất tan có trong dung dịch Y là.
A. Ba(HCO3)2 B. Ba(OH)2 C. NH4HCO3 D. Ba(HCO3)2 và NH4HCO3
Câu 20. Cho các phản ứng sau:
(1) CaCO3 → CaO + khí (X)
(2) Cu + HNO3 → Cu(NO3)2 + khí (Y) + H2O
(3) MnO2 + HCl → MnCl2 + khí (Z) + H2O
(4) (NH4)2CO3 + NaOH → Na2CO3 + khí (T) + H2O
Cho lần lượt các khí X, Y, Z, T qua dung dịch Ca(OH)2. Số trường hợp có thể thu được dung dịch chứa 2 muối là.
A. 3 B. 2 C. 4 D. 1
Câu 21. Nguyên tử của nguyên tố X có cấu hình electron là [Ne] 3s2 3p1. Nguyên tử nguyên tố Y có tổng số electron ở các phân lớp p là 11. Cho các nhận định sau:
(1) X là kim loại phổ biến trong võ trái đất.
(2) Y thuộc nhóm halogen.
(3) Điều chế kim loại X bằng cách điện phân nóng chảy XY3.
(4) Oxit và hydroxit của X có tính chất lưỡng tính.
(5) Y được dùng để khử trùng nước
(6) Tổng số hiệu của X, Y là 30.
Số nhận định đúng là.
A. 6 B. 4 C. 5 D. 3
Câu 22. Đạm hai lá có công thức là.
A. NH4NO3 B. (NH2)2CO C. NH4H2PO4 D. (NH4)2SO4
Câu 23. Cho các nhận định sau:
(1) Thành phần chính trong phân supe photphat kép là Ca(H2PO4)2.
(2) Phân đạm amoni không nên bón cho vùng đất bị nhiễm phèn, nhiễm mặn.
(3) Độ dinh dưỡng của phân natri được đánh giá bằng hàm lượng phần trăm Na2O có trong phân.
(4) Urê có công thức (NH2)2CO.
(5) Trong công nghiệp, phân supe phốtphat đơn được điều chế từ quặng photphoric hay apatit.
(6) Amophot là phân phức hợp có công thức NH4H2PO4 và (NH4)2HPO4.
Số nhận định đúng là.
A. 5 B. 4 C. 3 D. 6
Câu 24. Nhận định nào sau đây là đúng?
A. Theo chiều tăng dần điện tích hạt nhân, các kim loại kiềm có nhiệt độ nóng chảy tăng dần.
B. Các kim loại kiềm thổ đều tan trong nước khi đun nóng.
C. Nhôm tan được trong môi trường axit và bazơ nên nhôm có tính chất lưỡng tính
D. Trong mọi hợp chất, Flo chỉ có duy nhất một mức oxi hóa là -1.
Câu 25. Thực hiện các thí nhiệm sau:
(1) Đốt cháy bột sắt trong hơi brom.
(2) Đốt cháy hỗn hợp gồm Fe và S (không có khí).
(3) Cho bột sắt vào dung dịch AgNO3 dư.
(4) Cho bột sắt vào dung dịch HNO3 dư.
(5) Cho bột sắt vào dung dịch HCl loãng dư.
Số thí nghiệm thu được muối Fe3+ là.
A. 5 B. 2 C. 3 D. 4
Câu 26. Phản ứng nào sau đây không là phản ứng oxi hóa khử
A. Cl2 + 2NaOH → NaCl + NaClO + H2O
B. Al + NaOH + 3H2O → Na[Al(OH)4] + H2
C. 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
D. CaCO3 → CaO + CO2
Câu 27. Dãy gồm các kim loại được sắp xếp theo chiều tính khử giảm dần là.
A. Mg, Zn, Cu. B. Mg, Cu, Zn. C. Cu, Mg, Zn. D. Cu, Zn, Mg.
Câu 28. Cho dãy các chất sau: Al(OH)3, NaHSO4, KHCO3, ZnO, (NH4)2CO3, HCOONH4, Al, NaH2PO4. Số chất trong dãy vừa tác dụng với dung dịch HCl; vừa tác dụng với dung dịch NaOH là.
A. 7 B. 6 C. 5 D. 4
Câu 29. Dãy các chất nào sau đây mà trong phân tử đều có chứa liên kết ion?
A. NaCl, Na2O, CaO, HCl B. NaCl, NaNO3, CaO, Cl2.
C. NaCl, CaO, HBr, Na2HPO4 D. NaCl, NaNO3, CaO, Na2HPO4.
Câu 30. Điều nào sau đây là đúng?
A. Các kim loại đều có tính khử mạnh, tính dẫn nhiệt, dẫn điện và tính ánh kim.
B. Các kim loại tác dụng với lưu huỳnh đều cần có nhiệt độ.
C. Tính chất chung của các kim loại do các electron tự do trong kim loại gây nên.
D. Trong mọi hợp chất, các kim loại đều có một mức oxi hóa dương duy nhất.
Câu 31. Điều nhận định nào sau đây là sai?
A. Nước mềm là nước không chứa hoặc chứa ít cation Ca2+ và Mg2+.
B. Kim loại Ag có độ dẫn điện tốt nhất trong các kim loại.
C. Kim loại Li có khối lượng riêng nhỏ hơn khối lượng riêng của nước.
D. Kim loại Ca khử được Cu2+ trong dung dịch thành Cu.
Câu 32. Phản ứng nào sau đây thuộc phản ứng oxi hóa khử.
A. CuO + 2HCl → CuCl2 + H2O B. Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
C. SO2 + 2H2S → 3S + 2H2O D. FeCl3 + 3AgNO3 → Fe(NO3)3 + 3AgCl
Câu 33. Thực hiện các thí nghiệm sau:
(1) Sục khí CO2 vào dung dịch Ca(OH)2 dư.
(2) Sục khí Cl2 vào dung dịch NaOH dư.
(3) Sục khí NO2 vào dung dịch NaOH dư.
(4) Cho Fe3O4 vào dung dịch HCl loãng dư.
(5) Sục khí H2S vào dung dịch NaOH dư.
(6) Sục khí NH3 vào dung dịch AlCl3 dư.
Số dung dịch chứa 2 muối sau khi kết thúc thí nghiệm là.
A. 3 B. 4 C. 2 D. 5
Câu 34. Phản ứng nào sau đây là sai?
A. 2Fe + 6H2SO4 (đặc, nóng) → Fe2(SO4)3 + 3SO2 + 6H2O
B. Al + 6HNO3 (đặc, nguội) → Al(NO3)3 + 3NO2 + 3H2O
C. Fe + H2SO4 (loãng, nóng) → FeSO4 + H2
D. 2Al + H2SO4 (loãng, nguội) → Al2(SO4)3 + 3H2
Câu 35. Dung dịch của chất nào sau đây không làm đổi màu quỳ tím?
A. Axit glutamic: HOOC-CH2-CH2-CH(NH2)COOH.
B. Glyxin: H2N-CH2-COOH.
C. Lysin: H2NCH2-[CH2]3CH(NH2)COOH.
D. Axit ađipic: HOOC-(CH2)4-COOH.
Câu 36. Thực hiện các thí nghiệm sau:
(1) Cho dung dịch NaOH đến dư vào dung dịch AlCl3.
(2) Cho dung dịch HCl đến dư vào dung dịch Na[Al(OH)4].
(3) Sục khí CO2 đến dư vào dung dịch Ba(OH)2.
(4) Sục khí NH3 đến dư vào dung dịch CuCl2.
(5) Sục khí CO2 đến dư vào dung dịch Na[Al(OH)4]
(6) Cho dung dịch HCl đến dư vào dung dịch Ca(HCO3)2.
Sau khi kết thúc thí nghiệm, số trường hợp không thu được kết tủa là.
A. 5 B. 4 C. 3 D. 2
Câu 37. Cho các chất sau: Na2O, HCl, Cl2, CaCl2, AlCl3, NaNO3. Số chất trong dãy mà phân tử có chứa liên kết ion là.
A. 4 B. 2 C. 5 D. 3
Câu 38. Cho Na dư vào dung dịch chứa ZnCl2. Hãy cho biết hiện tượng xảy ra?
A. có khí bay lên và có kết tủa trắng xuất hiện sau đó tan 1 phần.
B. có kim loại Zn xuất hiện.
C. có khí bay lên và có kết tủa trắng xuất hiện
D. có khí bay lên và có kết tủa trắng xuất hiện sau đó tan hoàn toàn.
Câu 39. Hai nguyên tố X, Y có số hiệu nguyên tử lần lượt là 11 và 17. Cho các nhận định sau
(1) X là kim loại nhẹ; Y thuộc nhóm halogen
(2) X được dùng làm chất trao đổi nhiệt trong một số lò phản ứng hạt nhân.
(3) X và Y chỉ có một mức oxi hóa duy nhất trong mọi hợp chất.
(4) X được dùng làm chất xúc tác trong một số phản ứng hữu cơ, còn Y được dùng khử trùng nước.
(5) X có cấu trúc lập phương tâm khối.
(6) X tác dụng với nước cần phải đun nóng.
Số nhận định đúng là
A. 6 B. 5 C. 4 D. 3
Câu 40.
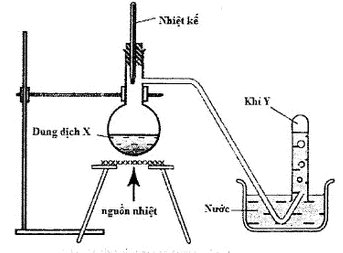
Hình vẽ trên minh họa điều chế khí nào sau đây
A. CH3COONa + NaOH → CH4 + Na2CO3
B. HCOONH4 + NaOH → HCOONa + NH3 + H2O
C. CH3-CH2OH → CH2=CH2 + H2O
D. CH3NH3Cl + NaOH → NaCl + CH3NH2 + H2O
Câu 41. Cho các nguyên tố sau : K, Ca thuộc chu kì 4 và Mg, Al thuộc chu kì 3 của bảng tuần hoàn. Tính kim loại của các nguyên tố giảm dần theo thứ tự nào dưới đây?
A. Ca, K, Mg, Al B. K, Ca, Al, Mg C. K, Mg, Ca, Al D. K, Ca, Mg , Al
Câu 42. Cho các phản ứng sau:
(1) CaCO3 → CaO + khí (X)
(2) Cu + HNO3 → Cu(NO3)2 + khí (Y) + H2O
(3) MnO2 + HCl → MnCl2 + khí (Z) + H2O
(4) (NH4)2CO3 + NaOH → Na2CO3 + khí (T) + H2O
(5) FeS + HCl → FeCl2 + khí (G)
Cho lần lượt các khí X, Y, Z, T, G qua dung dịch Ca(OH)2 dư. sau khi kết thúc thí nghiện, số trường hợp thu được dung dịch chứa 2 muối là.
A. 3 B. 2 C. 4 D. 1
Câu 43. X, Y là hai nguyên tố thuộc cùng chu kỳ của bảng hệ thống tuần hoàn các nguyên tố. Trong đó X thuộc IIA và Y thuộc IIIA với ZX + ZY = 25. Nhận định nào sau đây là sai?
A. Hợp chất của X được dùng để chế tạo máy bay, ô tô.
B. Oxit và hydroxit của Y tan trong môi trường bazơ mạnh.
C. X, Y đều được điều chế bằng cách điện phân nóng chảy muối clorua của chúng.
D. Y là kim loại phổ biến nhất trong võ trái đất.
Câu 44. Cho các phản ứng sau:
(1) Fe + S → (2) Hg + S → (3) Na + H2O →
(4) NaCl + AgNO3 → (5) Ba(OH)2 + NaHCO3 → (6) Al + NaOH + H2O →
Số phản ứng xảy ra ngay ở điều kiện thường là.
A. 5 B. 4 C. 6 D. 3
Câu 45. Khi nhiệt độ tăng lên 100, tốc độ phản ứng hóa học tăng gấp 3 lần. Hỏi tốc độ phản ứng đó giảm đi bao nhiêu lần khi nhiệt độ giảm từ 800C xuống còn 500C.
A. 54 lần B. 36 lần C. 27 lần D. 18 lần
Câu 46. Phát biểu nào sau đây không đúng?
A. Tính chất hoá học chung của kim loại là tính khử.
B. Nguyên tắc làm mềm nước cứng là làm giảm nồng độ ion Ca2+, Mg2+
C. Có thể điều chế nhôm bằng cách điện phân nóng chảy AlCl3.
D. Trong các hợp chất, nguyên tố kim loại kiềm thổ chỉ có số oxi hóa là +2.
Câu 47. Sản xuất amoniac trong công nghiệp dựa trên phương trình hoá học sau:
N2 (k) + 3H2 (k) → 2NH3 (k) ΔH < 0
Để thu được nhiều amoniac. Biện pháp đúng là.
A. giảm nồng độ của khí nitơ và khí hiđro. B. giảm áp suất chung và nhiệt độ của hệ.
C. tăng nhiệt độ của hệ. D. tăng áp suất chung của hệ và giảm nhiệt độ của hệ.
Câu 48. Người ta sản xuất khí nitơ trong công nghiệp bằng cách nào sau đây?
A. Cho không khí đi qua hơi nước. B. Dùng phốt pho để đốt cháy hết oxi không khí.
C. Chưng cất phân đoạn không khí lỏng. D. Nhiệt phân dung dịch NH4NO2 bão hòa.
Câu 49. X, Y, Z là các nguyên tử của nguyên tố đều thuộc nhóm chính trong bảng hệ thống tuần hoàn và được sắp xếp như sau:
| X | Z |
| Y |
Tổng số proton của X, Y, Z là 45. Cho các nhận định sau
(1) X, Y, Z đều là kim loại nhẹ và có tính khử mạnh.
(2) X, Y, Z tác dụng với nước ở điều kiện thường.
(3) Trong tự nhiên, X và Y có nhiều ở dạng hợp chất của quặng đolomit.
(4) Các oxit và hydroxit của Y và Z có tính chất lưỡng tính.
(5) Hợp chất của X được dùng chế tạo tên lửa, máy bay, ô tô.
(6) Z được được điều chế bằng cách điện phân nóng chảy muối ZCln.
Số nhận định đúng là.
A. 5 B. 6 C. 4 D. 3
Câu 50. Phát biểu nào sau đây không đúng.
A. Nước mềm là nước không chứa hoặc chứa ít ion Ca2+, Mg2+.
B. Nước cứng tạm thời là nước có chứa ion HCO3-.
C. Nước cứng là nước có chứa nhiều ion Ca2+, Mg2+.
D. Nước cứng vĩnh cữu là nước cứng có chứa ion Cl- hoặc SO42- hoặc cả hai.

Có đáp án chi tiết k ạ