Tổng hợp Lý thuyết hóa vô cơ (Phần 3)
⇒ Đáp án: (Chưa kiểm duyệt)
|
101D |
102C | 103D | 104C | 105D | 106A | 107A | 108B | 109B | 110D |
|
111B |
112D | 113B | 114B | 115D | 116D | 117C | 118C | 119A |
120D |
|
121A |
122C | 123D | 124C | 125D | 126D | 127D | 128C | 129D |
130C |
|
131C |
132D | 133C | 134D | 135B | 136B | 137C | 138C | 139D |
140B |
| 141C | 142C | 143C | 144D | 145C | 146D | 147B | 148D | 149B |
150C |
Câu 101. Nhận định nào sau đây là sai?.
A. Các kim loại kiềm có màu trắng bạc, có tính khử mạnh.
B. Natri được dùng làm chất trao đổi nhiệt trong một số lò phản ứng hạt nhân.
C. Trong mọi hợp chất, các kim loại kiềm chỉ có một mức oxi hóa là +1.
D. Trong phân nhóm chính nhóm IA, chỉ chứa các kim loại kiềm.
Câu 102. Phản ứng nào sau đây là sai?
A. Fe + 2HCl → 2FeCl2 + H2. B. 2Fe + 3Cl2 → 2FeCl3
C. 4Fe + 3O2 → 2Fe2O3 D. Fe + S → FeS
Câu 103. Urê có công thức là.
A. (NH4)2SO4 B. NH4NO3 C. (NH4)2HPO4 D. (NH2)2CO
Câu 104. Cho các nhận định sau:
(1) Độ dinh dưỡng của phân đạm được tính bằng hàm lượng phần trăm nitơ có trong phân.
(2) Supe phốtphat kép thành phần chính chứa Ca(H2PO4)2 + CaSO4.
(3) Không nên bón phân đạm amoni trên vùng đất nhiễm phèn, nhiễm mặn.
(4) Amophot là phân phức hợp có công thức NH4H2PO4 và (NH4)2HPO4.
Số nhận định đúng là.
A. 2 B. 4 C. 3 D. 1
Câu 105. Phản ứng nào sau đây không là phản ứng oxi hóa – khử.
A. Cl2 + 2NaOH → NaCl + NaClO + H2O
B. 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
C. 2Cu + 4HCl + O2 → 2CuCl2 + 2H2O
D. Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Câu 106. Nguyên tử của nguyên tố X có tổng số electron ở phân lớp s là 5. Nguyên tử của nguyên tố Y có tổng số electron ở phân lớp p là 11. Cho các nhận định sau:
(1) X là kim loại nhẹ; Y là nguyên tố halogen.
(2) Bán kính của X lớn hơn bán kính của Y.
(3) Tổng số hiệu của X và Y là 40.
(4) X được dùng chế tạo tế bào quang điện; Y được dùng để khử trùng nước.
(5) Trong công nghiệp, X và Y được điều chế bằng cách điện phân nóng cháy hợp chất XY.
(6) Trong mọi hợp chất, X luôn có mức oxi hóa +1; còn Y luôn có mức oxi hóa -1.
Nhận định sai là.
A. 4 B. 1 C. 3 D. 2
Câu 107. Mặt trái của “hiệu ứng nhà kính” là gây ra sự khác thường về khí hậu, gây hạn hán, lũ lụt, ảnh hưởng đến môi trường sinh thái và cuộc sống con người. Sự tăng nồng độ của chất hóa học nào sau đây là nguyên nhân chính gây ra hiện tượng trên?
A. CO2 B. CH4 C. CFCl3 D. NO2
Câu 108. Cho các dung dịch: NaOH, Ba(HCO3)2, Ca(OH)2, HCl, NaHCO3, BaCl2 phản ứng với nhau từng đôi một. Số cặp chất xảy ra phản ứng ( nhiệt độ thường ) là.
A. 9 B. 8 C. 6 D. 7
Câu 109. Điều chế oxi trong phòng thí nghiệm theo mô hình sau
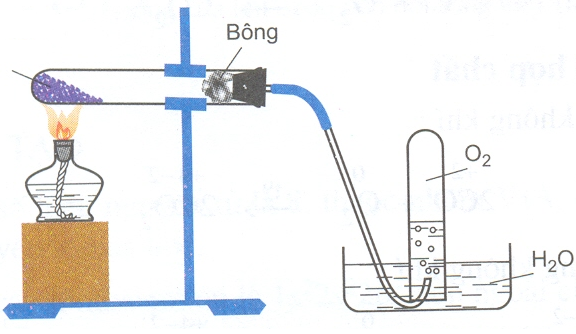
Nhận định nào sau đây là sai?
A. X là KMnO4. B. X là NaHCO3. C. X là (KClO3 + MnO2). D. X là NaNO3
Câu 110. Điều chế khí Cl2 trong phòng thí nghiệm từ MnO2 và dung dịch HCl đặc, nóng.
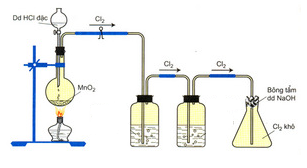
Khí Cl2 sinh ra thường lẫn hơi nước và khí hidro clorua. Để thu được khí Cl2 khô thì bình (1) và bình (2) lần lượt đựng.
A. Dung dịch H2SO4 đặc và dung dịch AgNO3.
B. Dung dịch H2SO4 đặc và dung dịch NaCl.
C. Dung dịch NaOH và dung dịch H2SO4 đặc.
D. Dung dịch NaCl và dung dịch H2SO4 đặc.
Câu 111. Để làm khô CO2 người ta dẫn khí CO2 có lẫn hơi nước đi qua.
A. Ca(OH)2 B. P2O5 C. NaOH đặc. D. CaO
Câu 112. Điều này sau đây là sai?
A. Nhiệt phân đến cùng muối Ba(HCO3)2 thu được phần rắn chứa BaO.
B. Đun nóng nước cứng tạm thời thu được 2 loại kết tủa là CaCO3 và MgCO3.
C. Nhôm là kim loại phổ biến nhất trong võ trái đất.
D. Na, K và Al đều có cấu trúc lập phương tâm khối.
Câu 113. Nguyên tử của nguyên tố R có tổng số electron trên các phân lớp s bằng 5. R là
A. Fe (Z = 26) B. Na (Z =11) C. Al (Z = 13) D. K (Z = 19)
Câu 114. Ở nhiệt độ cao, khí CO khử được oxit nào sau đây?
A. Al2O3 B. Fe2O3 C. BaO D. Na2O
Câu 115. Nhận định nào sau đây là sai?
A. Flo có tính oxi hóa mạnh hơn clo.
B. Dung dịch HF hòa tan được SiO2.
C. Muối AgF tan được trong nước.
D. Trong các hợp chất, ngoài mức oxi hóa là -1, flo và clo còn có số oxi hóa là +1, +3, +5, +7.
Câu 116. Cấu hình electron của ion X2+ là 1s2 2s2 2p6 3s2 3p6 3d10. Vị trí của X trong bảng tuần hoàn.
A. Ô 28, chu kì 3, nhóm VIIIB. B. Ô 30, chu kì 4, nhóm IIA
C. Ô 30, chu kì 3, nhóm VIIIB. D. Ô 30, chu kì 4, nhóm IIB
Câu 117. Chất được dùng để tẩy trắng giấy và bột giấy trong công nghiệp là.
A. N2O B. CO2 C. SO2 D. NO2
Câu 118. Cho các chất sau: Al, Na2CO3, AlCl3, KHCO3, K2SO4, Al2O3, Al(OH)3, (NH4)2SO3. Số chất vừa tác dụng với axit HCl và vừa tác dụng với dung dịch Ba(OH)2 là.
A. 5 B. 8 C. 6 D. 7
Câu 119. Sục từ từ khí CO2 đến dư vào dung dịch chứa hỗn hợp gồm BaCl2 và NaOH. Hiện tượng của thí nghiệm là.
A. Xuất hiện kết tủa trắng, sau đó kết tủa tan tạo thành dung dịch trong suốt
B. Xuất hiện kết tủa trắng
C. Xuất hiện kết tủa trắng, sau đó kết tủa tan tạo thành dung dịch màu xanh
D. Không có hiện tượng gì xảy ra
Câu 120. Trong các thí nghiệm sau:
(1) Cho khí O3 tác dụng với Ag.
(2) Nhiệt phân KMnO4.
(3) Cho khí H2 tác dụng với CuO đun nóng.
(4) Cho K2SO4 tác dụng với dung dịch BaCl2.
(5) Cho khí SO2 tác dụng với dung dịch H2S
(6) Cho Zn tác dụng với axit H2SO4 loãng..
Số thí nghiệm tạo ra đơn chất là.
A. 6 B. 3 C. 4 D. 5
Câu 121. Mưa axit ảnh hưởng tới hệ thực vật, phá hủy các vật liệu bằng kim loại, các bức tượng bằng đá, gây bệnh cho con người và động vật. Hiện tượng trên gây ra chủ yếu do khí thải của nhà máy nhiệt điện, phương tiện giao thông và sản xuất công nghiệp. Tác nhân chủ yếu trong khí thải gây ra mưa axit là.
A. SO2 và NO2 B. CH4 và NH3 C. CO và CH4 D. CO và CO2.
Câu 122. Phản ứng tạo ra muối sắt (II) là.
A. FeCO3 tác dụng với dung dịch HNO3 loãng dư
B. Fe2O3 tác dụng với dung dịch HCl
C. Fe tác dụng với dung dịch HCl
D. Fe(OH)3 tác dụng với dung dịch H2SO4.
Câu 123. Nguyên tử của nguyên tố X có cấu hình electron 1s2 2s2 2p6 3s1; nguyên tử của nguyên tố Y có cấu hình electron 1s2 2s2 2p6 3s2 3p5. Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
A. cộng hoá trị B. cho nhận C. kim loại. D. ion
Câu 124. Oxit của một nguyên tố kim loại nhóm B trong bảng tuần hoàn nào sau đây là một oxit lưỡng tính?
A. CrO3 B. CrO C. Cr2O3 D. Al2O3
Câu 125. Cho cấu hình electron của các nguyên tố của nguyên tử sau:
(X): [Ne] 3s1 (Y): [Ne] 3s2 3p4 (Z): [Ar] 4s2 (T): [Ne] 3s2 3p5
Cho các nhận định sau:
(1) X và Z là các kim loại tan trong nước ở điều kiện thường.
(2) T là nguyên tố halogen.
(3) Bán kính nguyên tử của Z lớn hơn bán kính nguyên tử của T.
(4) Nguyên tử X được dùng làm chất xúc tác trong các phản ứng tổng hợp hữu cơ.
Số nhận định đúng là.
A. 2 B. 1 C. 3 D. 4
Câu 126. Điều khẳng định nào nao sau đây là sai?
A. Trong phân nhóm chính nhóm IIA chỉ chứa các kim loại kiềm thổ.
B. Thành phần của sắt trong thép cao hơn trong gang.
C. Gang và thép đều là hợp kim của sắt.
D. Độ dẫn điện của Au tốt hơn Cu.
Câu 127. Dãy gồm các ion cùng tồn tại trong một dung dịch.
A. Fe3+, Ag+, NO3-, Cl- B. Fe2+, H+, Cl-, NO3-.
C. Ba2+, K+, HSO4-, OH‑. D. Fe2+, Cu2+, SO42-, NO3-.
Câu 128. Cho sơ đồ phản ứng:
Fe(NO3)2 → X → Y → Z → Fe(NO3)3
Các chất X và T lần lượt là.
A. FeO và HNO3 B. Fe3O4 và AgNO3 C. FeO và AgNO3 D. Fe2O3 và HNO3
Câu 129. Thực hiện các thí nghiệm sau:
(1) Cho Al2S3 vào dung dịch HCl loãng dư.
(2) Cho FeS vào dung dịch HCl loãng dư.
(3) Cho Mg vào dung dịch H2SO4 đặc, dư.
(4) Đốt cháy hỗn hợp H2 và S trong bình kín không chứa không khí.
Số thí nghiệm có thể thu được khí H2S là.
A. 3 B. 2 C. 1 D. 4
Câu 130. Dãy các hợp chất nào sau đây là các hợp chất ion.
A. KNO3, KF, H2O B. AlCl3, CaO, NaOH
C. KCl, Na2O, NH4Cl D. HNO3, CaCl2, NH4NO3
Câu 131. Phản ứng nào sau đây không là phản ứng oxi hóa – khử.
A. 2FeBr3 + 6H2SO4 (đặc) → Fe2(SO4)3 + 3SO2 + 3Br2 + 6H2O
B. 2Fe3O4 + 10H2SO4 (đặc) → 3Fe2(SO4)3 + SO2 + 10H2O
C. Na2SO3 + H2SO4 (đặc) → Na2SO4 + SO2 + H2O
D. Na2S2O3 + 3H2SO4 (đặc) → Na2SO4 + 4SO2 + 3H2O
Câu 132. Tiến hành thí nghiệm như hình vẽ
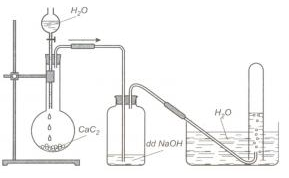
Nhận định nào sau đây là đúng
A. Có thể thay bình đựng dung dịch NaOH bằng dung dịch KMnO4.
B. Khí thu được là metan.
C. Có thể thay bình đựng dung dịch NaOH bằng dung dịch AgNO3 trong NH3.
D. Khí thu được là axetilen.
Câu 133. Hệ cân bằng sau thực hiện trong bình kín:
CO (k) + H2O (k) → CO2 (k) + H2 (k) ΔH < 0
Nhận định nào sau đây là sai?
A. Khi nhiệt độ không đổi, tăng áp suất chung của hệ cân bằng không bị chuyển dịch.
B. Thêm khí CO2 vào hệ, cân bằng chuyển dịch theo chiều nghịch.
C. Tăng nhiệt độ của hệ, cân bằng chuyển dịch theo chiều thuận.
D. Giảm nhiệt độ của hệ, cân bằng chuyển dịch theo chiều thuận.
Câu 134. Nhận định nào sau đây là sai?.
A. Các kim loại kiềm có màu trắng bạc, có tính khử mạnh.
B. Natri được dùng làm chất trao đổi nhiệt trong một số lò phản ứng hạt nhân.
C. Trong mọi hợp chất, các kim loại kiềm chỉ có một mức oxi hóa là +1.
D. Trong phân nhóm chính nhóm IA, chỉ chứa các kim loại kiềm.
Câu 135. Thực hiện các thí nghiệm sau:
(1) Sục khí CO2 đến dư vào dung dịch Na[Al(OH)4].
(2) Sục khí CO2 đến dư vào dung dịch Ca(OH)2.
(3) Sục khí NH3 đến dư vào dung dịch AlCl3.
(4) Sục khí NH3 đến dư vào dung dịch CuSO4.
(5) Sục khí H2S đến dư vào dung dịch FeCl2.
(6) Sục khí H2S đến dư vào dung dịch CuSO4.
Sau khi kết thúc thí nghiệm, số trường hợp thu được kết tủa là.
A. 4 B. 3 C. 5 D. 2
Câu 136. Tính chất vật lý nào dưới đây của kim loại không phải do các electron tự do gây ra?
A. Tính dẻo. B. Tính cứng. C. Ánh kim. D. Tính dẫn điện và nhiệt.
Câu 137. Kim loại nhẹ có nhiều ứng dụng trong kĩ thuật và đời sống là kim loại nào?
A. Fe B. Cu C. Al D. Mg
Câu 138. Cho các chất riêng biệt sau: FeSO4, AgNO3, Na2SO3, H2S, HI, Fe3O4, Fe2O3 tác dụng với dung dịch H2SO4 đặc, nóng. Số trường hợp xảy ra phản ứng oxi hóa – khử là.
A. 6 B. 3 C. 4 D. 5
Câu 139. Phản ứng nào sau đây không là phản ứng oxi hóa – khử.
A. Cl2 + 2NaOH → NaCl + NaClO + H2O
B. 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
C. 2Cu + 4HCl + O2 → 2CuCl2 + 2H2O
D. Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Câu 140. Thực hiện các thí nghiệm sau:
(1) Thổi khí O2 vào dung dịch KI.
(2) Cho bột Cu vào dung dịch chứa NaHSO4 và NaNO3.
(3) Sục khí H2S vào dung dịch CuCl2.
(4) Cho dung dịch FeCl3 và dung dịch AgNO3
(5) Cho dung dịch NaF vào dung dịch AgNO3.
(6) Cho bột Cu vào dung dịch FeCl3.
Số thí nghiệm có phản ứng xảy ra là.
A. 6 B. 4 C. 3 D. 5
Câu 141. Phản ứng nào sau đây thuộc phản ứng oxi hóa – khử.
A. 2NaHCO3 + Ba(OH)2 → Na2CO3 + BaCO3 + 2H2O
B. 2NaHSO4 + Ba(OH)2 → Na2SO4 + BaSO4 + 2H2O
C. H2S + SO2 → 3S + 2H2O
D. AgNO3 + HCl → HNO3 + AgCl
Câu 142. Thí nghiệm nào sau đây thu được kết tủa sau khi kết thủa phản ứng.
A. Sục khí NH3 đến dư vào dung dịch ZnCl2.
B. Cho dung dịch AgNO3 vào dung dịch H3PO4.
C. Sục khí NH3 đến dư vào dung dịch AlCl3.
D. Sục khí H2S đến dư vào dung dịch FeCl2.
Câu 143. Điều khẳng định nào sau đây là sai?
A. Trong tự nhiên, các kim loại kiềm tồn tại nhiều với dạng hợp chất.
B. Các kim loại kiềm đều tác dụng với nước ở điều kiện thường.
C. Cho Na vào dung dịch CuSO4 thu được kết tủa màu đỏ.
D. Trong các phản ứng, các kim loại kiềm chỉ thể hiện tính khử.
Câu 144. Phản ứng nào sau đây là sai?
A. 3CO + Fe2O3 → 2Fe + 3CO2 B. H2 + CuO → Cu + H2O
C. Cu + 2FeCl3 → 2FeCl2 + CuCl2 D. 2Fe + 3H2SO4 → Fe2(SO4)3 + 3H2
Câu 145. Đạm hai lá có công thức là.
A. NH4H2PO4 B. (NH4)2HPO4 C. NH4NO3 D. (NH4)2SO4
Câu 146. Chất nào sau đây mà phân tử chứa liên kết ion.
A. H2O B. HNO3 C. AlCl3 D. K2O
Câu 147. Điều nào sau đây là đúng.
A. Phân supe phốtphat đơn thành phần chứa Ca(H2PO4)2.
B. Bón nhiều đạm amoni lâu ngày làm đất trở nên chua.
C. Amophot là phân phức hợp có công thức (NH4)2HPO4 + KNO3.
D. Trong công nghiệp, phân lân nung chảy được điều chế từ quặng đolomit
Câu 148. Cho dãy các chất sau: Zn(OH)2, Al2O3, CaHPO4, (NH4)2CO3, HCOONH4, (NH4)2SO4, KHCO3, NaHSO4, NH2-CH2-COOH. Số chất trong dãy có tính chất lưỡng tính là.
A. 4 B. 6 C. 5 D. 7
Câu 149. Có 3 dung dịch X, Y, Z chỉ chứa một chất tan. Thực hiện các thí nghiệm sau:
+ Cho X vào Y thấy xuất hiện kết tủa trắng, để lâu ngoài không khí bị hóa đen.
+ Cho Y vào Z thấy xuất hiện kết tủa trắng, để lâu ngoài không khí bị hóa đen.
+ Cho X vào Z không thấy hiện tượng.
Ba dung dịch X, Y, Z chứa chất tan lần lượt là.
A. Fe(NO3)2; BaCl2; AgNO3 B. BaCl2; AgNO3; Fe(NO3)2
C. AgNO3; Fe(NO3)2; BaCl2 D. Fe(NO3)3; AgNO3; BaCl2.
Câu 150. Nguyên tử của nguyên tố X có tổng số electron phân lớp p là 7. Nguyên tử của nguyên tố Y có tổng số hạt mang điện nhiều hơn X là 8. Nhận định nào sau đây là sai?
A. X là kim loại nhẹ, Y là nguyên tố halogen.
B. Tổng số hiệu của X, Y là 30.
C. Hợp chất tạo bởi X, Y là hợp chất ion.
D. X là kim loại có nhiều ứng dụng trong kĩ thuật và trong đời sống con người


Bình luận