Một pin điện hoá Zn – H2 được thiết lập ở các điều kiện như hình vẽ bên (vôn kế có điện trở rất lớn).
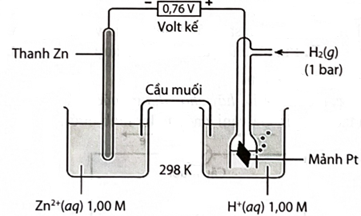
Phát biểu nào sau đây không đúng
A. Giá trị thế điện cực chuẩn của cặp oxi hoá – khử Zn2+/Zn là 0,76 V.
B. Quá trình khử xảy ra ở cathode là: 2H+ + 2e → H2.
C. Chất điện li trong cầu muối là KCl.
D. Phản ứng hoá học xảy ra trong pin là: Zn + 2H+ → Zn2+ + H2.
E. Có thể thay điện cực Pt bằng điện cực Fe để tăng khả năng hấp phụ khí H2, từ đó giúp pin điện hóa hoạt động ổn định hơn.
∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗
Hình thay thế:

Câu trả lời tốt nhất
A. Sai, E pin = E°2H+/H2 – E°Zn2+/Zn = 0,76
E°2H+/H2 = 0 —> E°Zn2+/Zn = -0,76
B. Đúng, tại cathode H+ nhận electron và bị khử trên bề mặt Pt: 2H+ + 2e → H2.
C. Đúng, KCl điện li tốt, không tương tác hóa học với các chất trong dung dịch. Đây là lựa chọn lý tưởng.
D. Đúng, phản ứng hoá học xảy ra trong pin là: Zn + 2H+ → Zn2+ + H2.
E. Sai, Fe không hấp phụ H2 ổn định như Pt. Fe có thể hấp phụ quá yếu hoặc quá mạnh tùy điều kiện bề mặt, dẫn đến pin hoạt động trồi sụt. Khi pin ngừng hoạt động, Pt trơ nên không bị ăn mòn, Fe thì tan trong acid nên không thể sử dụng lâu dài.
Pt là tốt nhất về mặt chức năng cho điện cực hydrogen, nhưng Pt cũng rất đắt giá. Có thể thay thế Pt bằng các điện cực Ni hoặc Co (không tốt, ở mức chấp nhận được) nhưng phải xử lý bề mặt trước khi sử dụng.

