Đồ thị hình bên biểu diễn nồng độ theo thời gian phân huỷ dinitrogen tetraoxide ở 100°C, trong bình kín dung tích 1,0 L theo phản ứng: N2O4 (g, không màu) ⇌ NO2 (g, nâu đỏ)
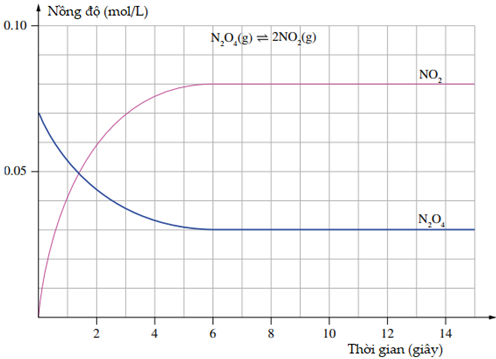
Sử dụng đồ thị để trả lời các câu hỏi sau:
a) Nồng độ N2O4 và NO2 ban đầu trong bình là bao nhiêu?
b) Nồng độ của N2O4, NO2 lúc cân bằng là bao nhiêu?
c) Khi phản ứng đạt trạng thái cân bằng, có bao nhiêu mol N2O4 bị phân hủy?
d) Các vùng nằm ngang của đồ thị biểu thị điều gì?
e) Thời gian (theo giây) để hệ đạt được trạng thái cân bằng là bao nhiêu?
f) Một học sinh nghiên cứu phản ứng này ghi lại những quan sát của cô ấy theo thời gian. Hiện tượng bạn học sinh sẽ quan sát được khi phản ứng diễn ra là gì?
Câu trả lời tốt nhất
(a) Nồng độ đầu của N2O4 là 0,07M, của NO2 là 0M.
(b) Lúc cân bằng: [N2O4] = 0,03M; [NO2] = 0,08M.
(c) Khi phản ứng đạt trạng thái cân bằng, có 1(0,07 – 0,03) = 0,04 mol N2O đã bị phân hủy.
(d) Các vùng nằm ngang của đồ thị biểu thị phản ứng đã đạt đến trạng thái cân bằng, nồng độ các chất không thay đổi nữa.
(e) Hệ đạt được trạng thái cân bằng sau khoảng 6s.
(g) Hiện tượng: Ban đầu không màu, khi phản ứng diễn ra thì màu sắc đậm dần, tới giây thứ 6 thì không thay đổi nữa.

