Quặng pyrite thường dùng trong sản xuất gang và điều chế H2SO4 trong công nghiệp. Thành phần chính của quặng pyrite là FeS2. Biết trong tự nhiên, Fe và S có các đồng vị tương ứng với tỉ lệ phần trăm số nguyên tử theo bảng cho dưới đây.
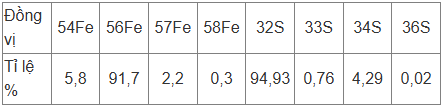
a) Tính nguyên tử khối trung bình của Fe và S.
b) Tính phần trăm về khối lượng của đồng vị 56Fe trong FeS2. (Làm tròn đến hàng phần trăm).
Câu trả lời tốt nhất
(a)
Nguyên tử khối trung bình của Fe = (54.5,8 + 56.91,7 + 57.2,2 + 58.0,3)/100 = 55,912
Nguyên tử khối trung bình của S = (32.94,93 + 33.0,76 + 34.4,29 + 36.0,02) = 32,0942
(b)
1 mol FeS2 nặng 55,912 + 2.32,0942 = 120,1004 gam
1 mol FeS2 chứa 1 mol Fe, trong đó n56Fe = 91,7%.1 = 0,917 mol
—> %56Fe trong FeS2 = 0,917.56/120,1004 = 42,76%
×

