Năng lượng hoạt hóa (kí hiệu Ea) là năng lượng tối thiểu mà các chất phản ứng cần phải có để phản ứng có thể xảy ra. Phương trình kinh nghiệm Arrhenius biểu diễn mối liên hệ giữa nhiệt độ, năng lượng hoạt hóa với hằng số tốc độ phản ứng: 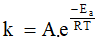 , trong đó:
, trong đó:
• k: hằng số tốc độ của phản ứng
• A: hằng số đặc trưng cho mỗi phản ứng
• e = 2,7183 (cơ số logarit tự nhiên)
• R: hằng số khí lí tưởng (R = 8,314 J/(mol.K))
• T: nhiệt độ theo thang Kelvin: T(K) = t (°C) + 273
• Ea: năng lượng hoạt hóa, đơn vị J/mol
Câu 1. Cho các phát biểu sau:
(a) Năng lượng hoạt hóa càng lớn thì phản ứng càng dễ xảy ra.
(b) Khi nhiệt độ phản ứng càng cao thì tốc độ phản ứng càng lớn.
(c) Chất xúc tác làm giảm năng lượng hoạt hóa từ đó làm tăng tốc độ phản ứng.
(d) Nếu một phản ứng có hằng số tốc độ là 11 M-1.s-1 tại nhiệt độ 345 K và hằng số thực nghiệm Arrhenius (A) là 20 M-1.s-1 thì năng lượng hoạt hoá của phản ứng trên là 1418 J.mol-1.
Các phát biểu sai là
A. (c) và (d). B. (a) và (d).
C. (b) và (c). D. (a) và (b).
Câu 2. Cho các phát biểu sau:
(1) Phản ứng có năng lượng hoạt hóa càng nhỏ thì tốc độ phản ứng càng lớn.
(2) Với đa số phản ứng, nhiệt độ càng cao, tốc độ phản ứng càng lớn.
(3) Chất xúc tác làm giảm năng lượng hoạt hóa từ đó làm tăng tốc độ phản ứng.
(4) Một phản ứng hoá học có hằng số tốc độ là 11 M-1.s-1 tại nhiệt độ 445K và hằng số đặc trưng A là 20 M-1.s-1 thì năng lượng hoạt hoá của phản ứng trên là 1418 J/mol (kết quả làm tròn đến hàng đơn vị).
(5) Một phản ứng hoá học có năng lượng hoạt hóa Ea = 100 kJ/mol, khi tăng nhiệt độ từ 298K lên 308K thì tốc độ phản ứng tăng lên 3,7 lần (kết quả làm tròn đến hàng phần mười).
Số phát biểu đúng là
A. 5. B. 3. C. 2. D. 4.
Câu trả lời tốt nhất
Câu 1.
(a) Sai, năng lượng hoạt hóa (Ea) càng lớn thì rào cản năng lượng càng cao, phản ứng càng khó xảy ra. Ngược lại, Ea nhỏ thì phản ứng dễ xảy ra hơn.
(b) Đúng, theo phương trình Arrhenius thì k tỉ lệ thuận với T nên T tăng thì k tăng, mà k tăng thì tốc độ phản ứng tăng.
(c) Đúng, chất xúc tác cung cấp cơ chế phản ứng mới với năng lượng hoạt hóa thấp hơn nên tốc độ phản ứng tăng.
(d) Sai:
lnk = lnA – Ea/RT —> Ea = RT(lnA – lnk) ≈ 1715 J/mol
Câu 2.
(1) Đúng, năng lượng hoạt hóa càng nhỏ thì hằng số tốc độ k càng lớn, tốc độ phản ứng càng lớn.
(2) Đúng, khi T càng lớn thì hằng số tốc độ k càng lớn, tốc độ phản ứng càng lớn. Chỉ số ít phản ứng thuận nghịch tỏa nhiệt mạnh, khi nhiệt độ càng cao thì phản ứng thuận sẽ bị kìm hãm.
(3) Đúng, chất xúc tác tạo ra “con đường đi mới”, ở đó năng lượng hoạt hóa nhỏ hơn và tốc độ phản ứng cao hơn.
(4) Sai:
lnk = lnA – Ea/RT —> Ea = RT(lnA – lnk) ≈ 2212 J/mol
(5) Đúng
lnλ = ln(k2/k1) = -Ea(1/T2 – 1/T1)/R = 1,31046
—> λ = 3,7

