Trong phòng thí nghiệm, một nhóm học sinh tìm hiểu ảnh hưởng của thời gian lưu giữ tới nồng độ FeSO4 trong dung dịch. Giả thuyết của nhóm học sinh là: “Khi để lâu, nồng độ FeSO4 trong dung dịch giảm”. Nhóm học sinh chuẩn bị 250,0 mL dung dịch FeSO4 (nồng độ khoảng 0,1 M) đựng trong bình kín (dán nhãn bình là Y) và tiến hành các thí nghiệm ở hai thời điểm khác nhau như sau:
– Ngày thứ nhất:
• Bước 1: Lấy 10,00 mL dung dịch trong bình Y cho vào bình tam giác rồi thêm tiếp 5 mL dung dịch H2SO4 2 M.
• Bước 2: Chuẩn độ dung dịch trong bình tam giác bằng dung dịch KMnO4 2,20×10^-2 M đến khi xuất hiện màu hồng nhạt (bền trong khoảng 20 giây) thì dừng. Ghi lại thể tích dung dịch KMnO4 đã dùng.
Lặp lại thí nghiệm chuẩn độ thêm 2 lần. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 10,70 mL. Nồng độ của Fe(II) xác định được là C1 M.
– Ngày thứ tám:
Xác định lại hàm lượng Fe(II) của dung dịch chứa trong bình Y theo các bước tương tự như ngày thứ nhất. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 9,92 mL. Nồng độ của Fe(II) xác định được là C2 M.
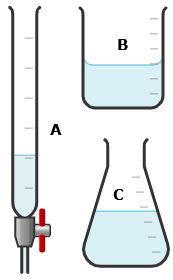
Nồng độ dung dịch KMnO4 như nhau trong các thí nghiệm chuẩn độ. Sự thay đổi nồng độ của Fe(II) (q%) được tính theo công thức: q% = (C1 – C2)/C1
a) Khi chuẩn độ, dung dịch KMnO4 được nhỏ trực tiếp vào bình tam giác từ dụng cụ kí hiệu là (B) được minh họa ở Hình 1.
b) Giá trị của q là 7,9. (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến hàng phần mười).
c) Giá trị của C2 là 0,109. (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến hàng phần nghìn).
d) Kết quả thu được từ các thí nghiệm phù hợp với giả thuyết ban đầu của nhóm học sinh.
Câu trả lời tốt nhất
(a) Sai, dụng cụ B là cốc chia độ, không dùng để chuẩn độ mà phải dùng dụng cụ A (burette) do:
+ Cốc chia độ có độ chính xác kém hơn nhiều so với burette.
+ Cốc chia độ không kiểm soát được dòng chảy như burette.
Vì vậy không dùng cốc chia độ để chuẩn độ vì nó không đảm bảo độ chính xác, kiểm soát dòng chảy, và không thích hợp về thiết kế. Trong chuẩn độ, chỉ một vài giọt dư cũng làm sai lệch kết quả, nên bắt buộc phải dùng burette.
(b) Sai
Phản ứng chuẩn độ:
5Fe2+ + 8H+ + MnO4- —> 5Fe3+ + Mn2+ + 4H2O
C1 = 5.10,70.2,20×10^-2/10 = 0,1177M
C2 = 5.9,92.2,20×10^-2/10 = 0,10912M
q% = (C1 – C2)/C1 = 7,3%
(c) Đúng
(d) Đúng, kết quả thí nghiệm hoàn toàn phù hợp với giả thuyết ban đầu, càng để lâu nồng độ Fe2+ càng giảm do bị oxi hóa:
12Fe2+ + 3O2 + 6H2O —> 8Fe3+ + 4Fe(OH)3

