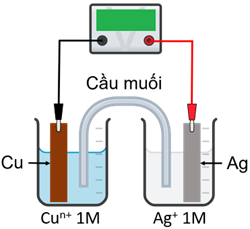
Một nhóm học sinh thiết lập pin điện hoá ở điều kiện chuẩn theo sơ đồ như hình dưới. Các giá trị thế điện cực chuẩn của một số cặp oxi hoá – khử được cho ở trong bảng:
Cu2+(aq) + e → Cu+(aq) E° = +0,16V
Cu2+(aq) + 2e → Cu(s) E° = +0,34V
Cu+(aq) + e → Cu(s) E° = +0,52V
Ag+(aq) + e → Ag(s) E° = +0,80V
a) Với n = 1 hoặc n = 2, khi pin hoạt động, điện cực Ag luôn đóng vai trò là cathode.
b) Với n = 2 sức điện động chuẩn của pin đo được bằng 0,46V.
c) Với n = 1, khi pin hoạt động, nồng độ của ion Cu+ tăng dần.
d) Cầu muối có vai trò khép kín mạch điện và trung hoà dung dịch điện li ở hai điện cực.
Câu trả lời tốt nhất
(a) Đúng, E°Cu2+/Cu hay E°Cu+/Cu đều nhỏ hơn E°Ag+/Ag nên điện cực Ag luôn đóng vai trò là cathode.
(b) Đúng, E°Cu-Ag = E°Ag+/Ag – E°Cu2+/Cu = 0,8 – 0,34 = 0,46V
(c) Sai, với n = 1, khi pin hoạt động tại anode:
Cu(s) —> Cu+(aq) + 1e
Tuy Cu+(aq) có được tạo ra thêm nhưng gần như không thể tích lũy vì Cu+(aq) rất kém bền, sẽ tự tiêu hủy do tự oxi hóa khử:
2Cu+(aq) —> Cu(s) + Cu2+(aq)
(d) Đúng, dòng ion chuyển động có hướng trong cầu muối làm kín mạch điện, đồng thời trung hòa điện tích ở 2 cốc dung dịch.

