Chlorine và sodium hydroxide là hoá chất được sử dụng để sản xuất nhiều chất trung gian trong các ngành công nghiệp hoá học (polymer, bột giấy, giấy), dược phẩm, thuốc bảo vệ thực vật, sản xuất xà phòng, luyện kim,… Công nghệ sử dụng phổ biến để điều chế Cl2 và NaOH là điện phân dung dịch NaCl có màng ngăn. Mô hình thiết bị điện phân được thể hiện trong hình sau:
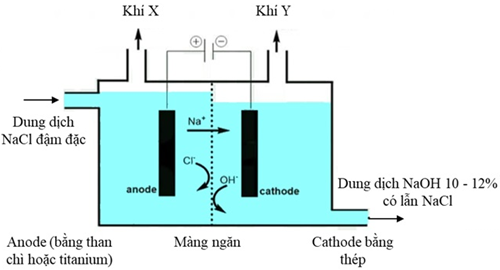
Dung dịch NaCl được đưa vào từ anode và được duy trì ở mức cao hơn bên cathode giúp chất lỏng chảy từ trái sang phải, ngăn không cho dung dịch NaOH chảy sang ngăn anode.
a) Phương trình hoá học của phản ứng điện phân: 2NaCl(aq) + 2H2O(l) → Cl2(g) + H2(g) + 2NaOH(aq)
b) Để thu được dung dịch NaOH tinh khiết hơn (nồng độ 50%) có thể tăng nồng độ dung dịch NaCl ban đầu.
c) Ở cathode, nước bị khử thay vì Na+ do thế điện cực chuẩn của cặp 2H+/H2 cao hơn Na+/Na.
d) Tiến hành điện phân liên tục 5,00 giờ với dòng điện không đôi 25,0 kA (hiệu suất dòng cho cả 2 điện cực là 96,5%) 2000 kg dung dịch muối ăn NaCl 25% được cấp vào ngăn anode. Dung dịch thu được ở cathode là NaOH 12,0% khối lượng, chứa 2,0% NaCl (do rò rỉ và kéo theo). Khối lượng NaCl còn lại ở anode là 214,83125 kg. Biết trong quá trình điện phân, màng ngăn không đảm bảo nên đã có 5% Cl2 sinh ra phản ứng với NaOH.
Câu trả lời tốt nhất
(a) Đúng
(b) Sai, NaCl đã bão hòa nên không thể tăng thêm nồng độ tại nhiệt độ đó nữa. Độ tan của NaCl cũng tăng chậm khi nhiệt độ tăng nên NaOH 50% là không khả thi.
(c) Sai, nước bị khử thay vì Na+ do thế điện cực chuẩn của cặp 2H2O/H2+2OH- cao hơn Na+/Na.
(d) Đúng
ne = It/F —> nCl2 = 96,5%ne/2 = 2250 mol = 2,25 kmol
và nNaOH = 2nCl2 = 4,5 kmol
nCl2 phản ứng với NaOH = 2,25.5% = 0,1125
Cl2 + 2NaOH —> NaCl + NaClO + H2O
0,1125….0,225……………0,1125
nNaOH còn lại = 4,5 – 0,225 = 4,275
mNaCl (ngăn cathode) = 4,275.40.2%/12% = 28,5 kg
Bảo toàn các dạng tồn tại của Na: Ban đầu (NaCl) = Sau phản ứng (NaCl ngăn anode, NaCl ngăn cathode, NaOH, NaClO)
—> mNaCl (ngăn anode) = 2000.25% – 4,275.58,5 – 0,1125.58,5 – 28,5 = 214,83125 kg

