Cho cân bằng hoá học và sơ đồ tổng hợp ammonia:
N2(g) + 3H2(g) ⇋ 2NH3(g) ΔrH = -92 kJ
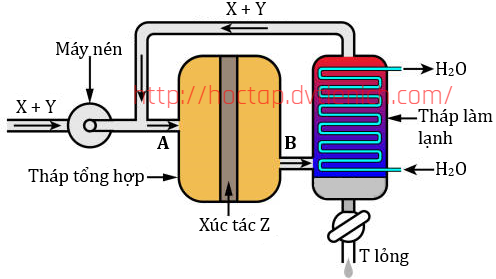
a. Bộ phận nén có vai trò tăng áp suất của hệ phản ứng trong tháp phản ứng lên đến gần 200 bar để cân bằng phản ứng tổng hợp ammonia chuyển dịch theo chiều thuận (chiều tạo ammonia).
b. Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch còn hằng số cân bằng không thay đổi
c. Nhiệt độ sôi của T thấp hơn so với X và Y nên tại tháp làm lạnh toàn bộ khí T sẽ hóa lỏng sau đó tách ra, còn X và Y vẫn ở trạng thái khí và thực hiện vòng tuần hoàn mới.
d. Nếu thể tích chất X và chất Y lấy ban đầu lần lượt bằng 3,7185 m³ và 1,2395 m³ thì sau phản ứng thể tích chất T thu được là 0,4958 m³ (các khí đo ở điều kiện chuẩn). Hiệu suất phản ứng tổng hợp ammonia bằng 20%. Biết ở điều kiện thường Y khá trơ.
Câu trả lời tốt nhất
(a) Đúng, phản ứng thuận có số phân tử khí giảm nên áp suất cao sẽ làm cân bằng chuyển dịch theo chiều thuận.
(b) Sai, chiều nghịch thu nhiệt nên khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch. Hằng số cân bằng phụ thuộc nhiệt độ nên khi tăng nhiệt độ thì hằng số cân bắng sẽ thay đổi.
(c) Sai, nhiệt độ sôi của T (NH3) cao hơn so với X và Y nên tại tháp làm lạnh toàn bộ khí T sẽ hóa lỏng sau đó tách ra.
(d) Đúng:
Từ tỉ lệ phản ứng và tính chất ở điều kiện thường Y khá trơ —> X là H2, Y là N2
VNH3 = 1,2395.2.20% = 0,4958 m³

