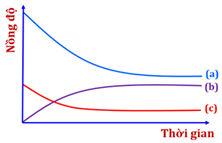
Cho đồ thị bên biểu diễn sự biến thiên nồng độ của các chất trong hệ phản ứng theo thời gian (với điều kiện nhiệt độ không đổi) của hai phản ứng sau:
(1) N2(g) + 3H2(g) ⇋ 2NH3(g) với hằng số cân bằng K1
(2) ½N2(g) + ³⁄₂H2(g) ⇋ NH3(g) với hằng số cân bằng K2
Phát biểu nào sau đây đúng?
A. Đường (a), (b) và (c) lần lượt biểu diễn sự biến thiên nồng độ của N2(g), NH3(g) và H2(g).
B. Phản ứng nhanh đạt đến trạng thái cân bằng hơn khi thêm chất xúc tác.
C. Mối liên hệ giữa hằng số cân bằng K1 và K2 là K1 = 2K2.
D. Tại thời điểm cân bằng, nồng độ N2(g), H2(g) và NH3(g) không đổi do phản ứng đã dừng lại.
Câu trả lời tốt nhất
A. Sai, (a) giảm mạnh hơn (c) nên (a) biểu diễn H2, (c) biểu diễn N2, (b) tăng nên (b) biểu diễn NH3.
B. Đúng, chất xúc tác làm tăng tốc độ phản ứng thuận và nghịch khiến hệ nhanh đạt trạng thái cân bằng hơn.
C. Sai, K1 = [NH3]²/[N2][H2]³ và K2 = [NH3]/[N2]½[H2]³⁄₂ nên K1 = (K2)²
D. Sai, tại thời điểm cân bằng, nồng độ N2(g), H2(g) và NH3(g) không đổi do phản ứng vẫn diễn ra nhưng tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.

