Cho hình vẽ mô tả thí nghiệm điều chê khí Cl2 từ MnO2 và HCl đặc
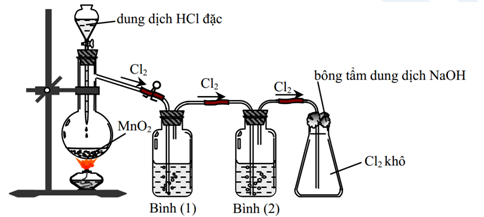
a) Viết phương trình hóa học điều chế khí Cl2.
b) Cho biết khí Cl2 sinh ra thường lẫn những tạp chất nào? Để thu được khí Cl2 khô thì bình (1) và bình (2) lần lượt đựng dung dịch chất nào?
c) Cho biết vai trò của bông tẩm dung dịch NaOH? Viết phương trình phản ứng minh họa (nếu có).
Câu 2. Phát biểu nào sau đây đúng?
A. Bình (1) để hấp thụ khí HCl, bình (2) để hấp thụ hơi nước.
B. Có thể đổi vị trí bình (1) và bình (2) cho nhau.
C. Chất lỏng sử dụng trong bình (1) lúc đầu là nước cất.
D. Bình (2) đựng trong dung dịch H2SO4 đặc, có thể thay thế bằng bình đựng CaO.
Câu trả lời tốt nhất
Phản ứng: MnO2 + 4HCl —> MnCl2 + Cl2 + 2H2O
Khí Cl2 sinh ra thường lẫn khí HCl và hơi H2O.
Bình 1 đựng dung dịch NaCl bão hòa để hấp thụ (hòa tan) khí HCl (Cl2 tan không đáng kể trong NaCl bão hòa).
Bình 2 đựng dung dịch H2SO4 đặc để hấp thụ hơi H2O (làm khô).
Bông tẩm dung dịch NaOH để ngăn khí Cl2 thoát ra ngoài (do Cl2 là khí độc)
Cl2 + 2NaOH —> NaCl + NaClO + H2O
A. Đúng
B. Sai, làm khô phải là bước sau cùng, nếu làm khô trước thì Cl2 sẽ ẩm trở lại khi dẫn qua bình 1.
C. Sai, dùng nước cất thì cả HCl và Cl2 đều bị hòa tan làm hao hụt Cl2.
D. Sai, không thể thay H2SO4 đặc bằng CaO vì CaO khi hút ẩm sẽ giữ lại Cl2 làm hao hụt Cl2:
CaO + H2O —> Ca(OH)2
Ca(OH)2 + Cl2 —> CaOCl2 + H2O

