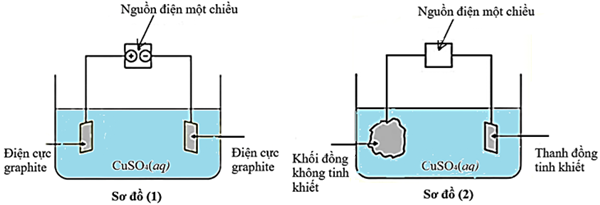
Cho sơ đồ (1) biểu diễn sự điện phân dung dịch CuSO4(aq) với điện cực trơ, sơ đồ (2) biểu diễn quá trình tinh luyện đồng (Cu) bằng phương pháp điện phân. Trong sơ đồ (2), các khối đồng có độ tinh khiết thấp được gắn với một điện cực của nguồn điện, các thanh đồng mỏng có độ tinh khiết cao được gắn với một điện cực của nguồn điện. Dung dịch điện phân là dung dịch CuSO4.
Câu 1.
a. Trong sơ đồ (1), điện cực âm được gọi là cathode và điện cực dương gọi là anode.
b. Khi điện phân xảy ra ở sơ đồ (1), thì ban đầu ở cực âm xảy ra quá trình khử ion Cu2+ và ở cực dương xảy ra quá trình oxi hóa H2O.
c. Khi điện phân xảy ra ở sơ đồ (2), nồng độ ion Cu2+ trong dung dịch sẽ giảm dần theo thời gian.
d. Muốn tinh luyện Cu như sơ đồ (2) thì khối Cu không tinh khiết phải được nối vào anode, còn thanh Cu tinh khiết được nối vào cathode, khi đó khối lượng Cu tan ra từ anode bằng khối lượng Cu bàm vào cathode.
Câu 2.
a) Trong sơ đồ (2), tổng khối lượng của thanh đồng tinh khiết (cathode) tăng lên luôn đúng bằng tổng khối lượng của khối đồng không tinh khiết (anode) giảm đi.
b) Để thanh đồng tinh khiết ở sơ đồ (2) ngày càng dày lên, ta phải duy trì dòng điện xoay chiều đi qua hệ thống.
c) Trong sơ đồ (1), màu xanh lam của dung dịch CuSO4 sẽ nhạt dần theo thời gian điện phân.
d) Ở sơ đồ (1), sau một thời gian điện phân, pH của dung dịch tại khu vực gần anode (+) sẽ giảm xuống.
Câu trả lời tốt nhất
Câu 1.
(a) Đúng
Anode là nơi xảy ra quá trình oxi hóa. Trong sơ đồ (1), anode là cực dương, tại đó xảy ra quá trình oxi hóa H2O:
2H2O —> O2 + 4H+ + 4e
Cathode là nơi xảy ra quá trình khử. Trong sơ đồ (1), cathode là cực âm, tại đó xảy ra quá trình khử Cu2+:
Cu2+ + 2e —> Cu
(b) Đúng
(c) Sai, ở sơ đồ (2), nồng độ ion Cu2+ trong dung dịch không thay đổi theo thời gian, do có bao nhiều Cu2+ bị khử tại cathode thì lại có bấy nhiêu Cu2+ được tạo ra bên anode bù lại:
Anode: Cu —> Cu2+ + 2e
Cathode: Cu2+ + 2e —> Cu
(d) Đúng, sơ đồ (2) xảy ra hiện tượng cực dương tan, khi đó khối Cu không tinh khiết phải nối vào cực dương (anode), chỉ Cu tan ra còn tạp chất thì lắng xuống đáy.
Câu 2.
(a) Sai, m anode giảm = mCu tan ra + m tạp chất lắng xuống
m cathode tăng = mCu bám vào
Theo bảo toàn electron: mCu tan ra = mCu bám vào —> m anode giảm > m cathode tăng
(b) Sai, quá trình điện phân phải sử dụng dùng điện 1 chiều (DC).
(c) Đúng, ở sơ đồ (1) Cu2+ giảm dần (bị khử tại cathode nhưng không được bổ sung) nên màu xanh nhạt dần.
(d) Đúng, tại anode sơ đồ (1): 2H2O —> O2 + 4H+ + 4e, do H+ sinh ra liên tục tại anode nên pH khu vực này giảm xuống.

