Để đánh giá mức độ tự diễn biến của một phản ứng tại nhiệt độ T, người ta dựa vào đại lượng biến thiên năng lượng tự do Gibbs (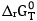 ). Nếu
). Nếu 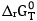 > 0: phản ứng không tự xảy ra;
> 0: phản ứng không tự xảy ra; 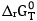 < 0 : phản ứng tự xảy ra. Giá trị của đại lượng này được tính theo biểu thức:
< 0 : phản ứng tự xảy ra. Giá trị của đại lượng này được tính theo biểu thức: 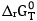 =
= 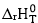 – T.
– T.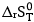
Trong đó:
+ T: nhiệt độ tính theo thang Kelvein (K);
+ 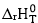 : Biến thiên enthalpy của phản ứng;
: Biến thiên enthalpy của phản ứng;
+ 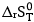 : Biến thiên entropy của phản ứng (đại lượng đặc trưng cho độ mất trật tự của hệ ở một trạng thái và điều kiện xác định).
: Biến thiên entropy của phản ứng (đại lượng đặc trưng cho độ mất trật tự của hệ ở một trạng thái và điều kiện xác định).
Tính giá trị thấp nhất của T (làm trong đến hàng đơn vị) để phản ứng sau tự xảy ra:
CaCO3(s) → CaO(s) + CO2(g)
Cho biết: 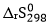 = 159,26 J/mol.K và nhiệt tạo thành chuẩn của các chất như sau:
= 159,26 J/mol.K và nhiệt tạo thành chuẩn của các chất như sau:
Chất…………… (kJ/mol)
(kJ/mol)
CaCO3(s)…….-1207,0
CaO(s)……….-635,0
CO2(s)……….-393,5
Giả sử 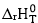 và
và 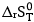 của quá trình không phụ thuộc vào nhiệt độ.
của quá trình không phụ thuộc vào nhiệt độ.
Câu trả lời tốt nhất
 = -635,0 – 393,5 – (-1207,0) = 178,5 kJ = 178500 J
= -635,0 – 393,5 – (-1207,0) = 178,5 kJ = 178500 J
Phản ứng bắt đầu xảy ra khi:
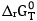 =
= 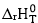 – T.
– T.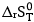 = 0
= 0
—> T = 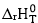 /
/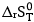 = 178500/159,26 = 1121K
= 178500/159,26 = 1121K

