Một em học sinh thiết lập thí nghiệm như hình vẽ dưới đây:
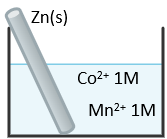
Biết thể điện cực chuẩn:
Mn2+(aq) + 2e ⇋ Mn(s) E° = -1,18V
Zn2+(aq) + 2e ⇋ Zn(s) E° = -0,76V
Co2+(aq) + 2e ⇋ Co(s) E° = -0,28V
Em đó đưa ra các phát biểu sau:
(1) Phản ứng xảy ra giữa Zn(s) và Co2+(aq) tạo được 1 pin điện có thế là 0,48V.
(2) Năng lượng hóa học dự trữ trong các chất phản ứng chủ yếu được chuyển hóa thành năng lượng điện khi phản ứng xảy ra.
(3) Nồng độ của các ion tăng bởi vì Zn(s) nhường 2e.
(4) Sau một thời gian xảy ra phản ứng, thanh Zn(s) bị ăn mòn dần ở phần nhúng trong dung dịch do xảy ra phản ứng Zn(s) + Mn2+(aq) → Zn2+(aq) + Mn(s).
Có bao nhiêu phát biểu sai?
A. 1. B. 2. C. 4. D. 3.
Câu trả lời tốt nhất
(1) Sai: Zn + Co2+ —> Zn2+ + Co
Co sinh ra bám luôn vào Zn nên pin bị đoản mạch và điện thế tạo ra gần như bằng 0.
(2) Đúng
(3) Sai, nồng độ của các ion không thay đổi vì tỉ lệ 1 mol Zn2+ tạo ra sẽ có 1 mol Co2+ mất đi.
(4) Sai, Mn có tính khử mạnh hơn Zn nên Zn không khử được Mn2+, Zn bị ăn mòn dần là do Zn + Co2+ —> Zn2+ + Co
Thầy ơi câu a thì em nghĩ sẽ là 0,48 nếu nồng độ Zn=1M chứ ạ

