Một nhà máy sản xuất ammonia theo quy trinh Haber – Bosch với nguyên liệu ban đầu là hỗn hợp khí N2 và H2 (tỉ lệ 1 : 3 về thể tích) được nén đến 200 atm ở 25°C. Trước khi nạp vào buồng phản ứng, nguyên liệu cần được gia nhiệt lên 500°C. Khi quy trình hoạt động ổn định, lưu lượng nguyên liệu nạp vào buồng phản ứng không đổi là 10^6 mol/giờ. Trong buồng tổng hợp xảy ra phản ứng:
N2 + 3H2 ⇋ 2NH3 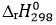 = -184 kJ
= -184 kJ
Biết mức độ chuyển hoá N2 mỗi lần đi qua buồng phản ứng là 15%. Hỗn hợp khí ra khỏi buồng phản ứng được làm lạnh xuống -20°C để ngưng tụ và tách NH3 lỏng. Phần N2 và H2 chưa phản ứng được dẫn trở lại và bổ sung nguyên liệu mới (để đủ 10^6 mol/giờ) và được gia nhiệt lên 500°C rồi lại nạp vào buồng phản ứng.
Biết năng lượng cần cung cấp để làm tăng nhiệt độ của 1 mol khí lên 1°C của N2 và H2 lần lượt là 29,1 (J/mol) và 28,8 (J/mol), 90% năng lượng tỏa ra từ phản ứng tổng hợp được dùng làm nóng nguyên liệu, phần năng lượng còn thiếu được cung cấp bằng phản ứng đốt cháy CH4. Khi đốt cháy 1 mol CH4 tỏa ra 802 kJ, 81% nhiệt lượng này được dùng để làm nóng nguyên liệu. Lượng CH4 cần đốt mỗi giờ là bao nhiêu kg? (làm tròn đến hàng đơn vị)
Câu trả lời tốt nhất
Nguyên liệu trong 1h gồm N2 (2,5.10^5 mol) và H2 (7,5.10^5 mol), trong đó:
+ 85% lượng nguyên liệu trên (tương ứng 2,125.10^5 mol N2 và 6,375.10^5 mol H2) được dẫn từ buồng làm lạnh ra, cần tăng nhiệt độ từ -20°C lên 500°C (tăng 520°C)
+ 15% lượng nguyên liệu còn lại cần bổ sung từ nguồn bên ngoài (tương ứng 3,75.10^4 mol N2 và 1,125.10^5 mol H2) cần tăng nhiệt độ từ 25°C lên 500°C (tăng 475°C).
Tổng lượng nhiệt cần thiết là:
29,1.2,125.10^5.520 + 28,8.6,375.10^5.520 + 29,1.3,75.10^4.475 + 28,8.1,125.10^5.475 = 1,482.10^10 J = 1,482.10^7 kJ
Lượng nhiệt nhận được từ phản ứng tổng hợp = 15%.2,5.10^5.184.90% = 6,21.10^6 kJ
Lượng nhiệt còn thiếu được cung cấp bởi việc đốt x mol CH4:
81%.802x = 1,482.10^7 – 6,21.10^6
—> x = 13253,90228 mol
—> mCH4 = 16x = 212062 gam ≈ 212 kg

