Một nhóm học sinh làm thí nghiệm để nghiên cứu sự phụ thuộc của thế điện cực vào nồng độ của ion kim loại. Giả thuyết mà nhóm học sinh này đặt ra là: “khi giảm nồng độ ion kim loại trong dung dịch thì thế điện cực cũng giảm”. Để kiểm chứng giả thuyết trên, nhóm học sinh tiến hành thí nghiệm như sau:
• Bước 1: chuẩn bị 5 cốc chứa dung dịch CuSO4 1M; 5 cốc chứa dung dịch ZnSO4 có nồng độ lần lượt là 1M; 0,5M; 0,1M; 0,05M; 0,01M; Các thanh điện cực Zn và Cu có kích thước như nhau; cầu muối; điện kế để đo sức điện động.
• Bước 2: Tiến hành lắp các dụng cụ theo sơ đồ như hình vẽ bên dưới.
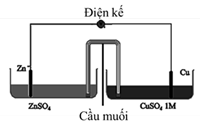
• Bước 3: Lần lượt thay các cốc chứa ZnSO4 có nồng độ khác nhau, tiến hành đo sức điện động của pin.
Kết quả thí nghiệm được học sinh thu thập được theo bảng sau:
Nồng độ ZnSO4…….Sức điện động (V)
1M…………………………….1,102
0,5M…………………………..1,109
0,1M…………………………..1,130
0,05M………………………….1,138
0,01M………………………….1,159
Câu 1. Xét đúng sai:
a) Trong thí nghiệm trên, Zn là anode còn Cu là cathode.
b) Cần phải đồng thời thay đổi cả nồng độ ZnSO4 và CuSO4 mới kiểm định được giả thuyết.
c) Từ kết quả thí nghiệm, tính được thế điện cực của Zn2+/Zn khi nồng độ Zn2+ bằng 0,01M là ‒0,819V, biết E°Cu2+/Cu = +0,34V.
d) Dựa vào kết quả thí nghiệm, có thể kết luận khi giảm nồng độ ion kim loại thì thế điện cực tăng.
Câu 2. Xét đúng sai:
a) Khi nồng độ ZnSO4 là 0,05M thì sức điện động chuẩn của pin là 1,138V.
b) Trong thí nghiệm trên, Cu là anode và Zn là cathode.
c) Từ kết quả thí nghiệm, tính được thế điện cực của Zn2+/Zn khi nồng độ Zn2+ bằng 0,1 M là -0,79V biết E°Cu2+/Cu = +0,34V..
d) Dựa vào kết quả thí nghiệm, giả thiết của học sinh đưa ra là không hợp lý.
Câu trả lời tốt nhất
Câu 1.
(a) Đúng, Zn có tính khử mạnh hơn Cu nên Zn là anode còn Cu là cathode.
(b) Sai, phải thay đổi 1 bên và giữ cố định 1 bên để kiểm định giả thiết.
(c) Đúng:
Epin = E°Cu2+/Cu – EZn2+/Zn = 1,159
—> EZn2+/Zn = E°Cu2+/Cu – 1,159 = -0,819V
(d) Sai, kết luận này chỉ đúng trong một chừng mực nhất định, nếu [Zn2+] xuống quá thấp thì điện trở dung dịch tăng lên, cản trở quá trình oxi hóa Zn và pin dừng hoạt động.
Câu 2.
(a) Sai, sức điện động chuẩn là sức điện động ở điều kiện chuẩn, được quy ước là nồng độ các muối đều 1M. Tại các điều kiện khác, cụm từ “sức điện động chuẩn” không được dùng để miêu tả.
(b) Sai, Zn có tính khử mạnh hơn Cu nên Zn là anode, Cu là cathode.
(c) Đúng
Epin = E°Cu2+/Cu – EZn2+/Zn = 1,13
—> EZn2+/Zn = E°Cu2+/Cu – 1,13 = -0,79V
(d) Đúng, giả thuyết “khi giảm nồng độ ion kim loại trong dung dịch thì sức điện động của pin cũng giảm” không hợp lý vì trái ngược với kết quả thí nghiệm.

