Nitric acid là một hóa chất quan trọng được sản xuất trên quy mô nhiều triệu tấn và được sử dụng trong các ngành công nghiệp hóa chất, thực phẩm và phân bón, cùng nhiều ngành khác. Quá trình sản xuất diễn ra chủ yếu bằng quy trình OSTWALD từ ammonia và oxygen. Dung dịch được tạo ra bằng quy trình OSTWALD chứa khoảng 60% khối lượng nitric acid. Để thu được nitric acid đặc hơn nữa, người ta dùng sulfuric acid đậm đặc để hút ẩm. Sơ đồ đơn giản hóa của một hệ thống làm đặc HNO3 như sau:
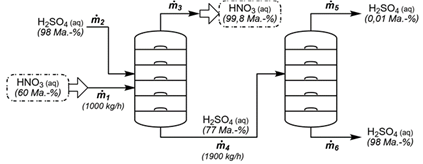
Ma.-% viết tắt của Mass percent (tiếng Anh) hay Massenprozent (tiếng Đức), nghĩa là phần trăm khối lượng. Đây là ký hiệu đúng trong một số tài liệu kỹ thuật.
Nitric acid 60% chảy vào cột thứ nhất với lưu lượng m1 = 1000 kg/h. Một dòng khối lượng m3 của nitric acid đậm đặc (99,8% theo khối lượng) được lấy khỏi cột và một dòng khối lượng m4 = 1900 kg/h của sulfuric acid 77% chảy vào cột khác. Trong cột này, sulfuric acid được cô đặc trở lại, nhưng một dòng khối lượng m5 của sulfuric acid loãng (0,01% theo khối lượng) được tạo ra dưới dạng nước thải.
a) Coi khối lượng riêng của nước thải bằng 1 g/mL và giả sử H2SO4 phân li hoàn toàn 2 nấc thì pH của nước thải là 2,69.
b) Lưu lượng m5 của nước thải là 407,2 kg/h.
c) Trong giai đoạn đầu tiên ở quy trình OSTWALD, ammonia bị oxygen khử thành NO với xúc tác thích hợp.
d) Lưu lượng m3 của nitric acid 99,8% mà nhà máy sản xuất là 401,2 kg/h.
Câu trả lời tốt nhất
(a) Đúng
1L nước thải (nặng 1000 gam) chứa nH2SO4 = 1000.0,01%/98 = 1/980
—> nH+ = 1/490 —> pH = 2,69
(b) Đúng: m4 = m5 + m6 = 1900 kg/h
mH2SO4 = 0,01%m5 + 98%m6 = 1900.77%
—> m5 = 407,2 và m6 = 1492,8
(c) Sai, NH3 bị O2 oxi hóa thành NO với xúc tác thích hợp.
(d) Sai, mHNO3 vào = 1000.60% = 600 kg/h
m3 = 600/99,8% = 601,2 kg/h

