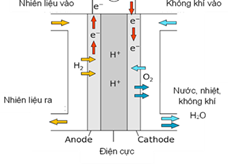
Pin nhiên liệu là một loại pin điện hóa, sử dụng năng lượng của phản ứng hóa học chuyển hóa thành điện năng. Cấu tạo của một pin nhiên liệu hydrogen được mô tả như sau:
– Anode (cực âm) là nơi cung cấp dòng electron để sinh ra dòng điện. Khi nhiên liệu (khí H2) được đưa từ bên ngoài vào, khi gặp điện cực sẽ bị oxi hóa thành ion H+.
– Dòng electron di chuyển theo dây dẫn qua cathode (cực dương). Tại đây, O2 trong không khí sẽ phản ứng với H+ ở điện cực tạo thành H2O. Dòng electron di chuyển từ anode qua cathode tạo ra dòng điện trong pin.
– Sau phản ứng, pin nhiên liệu không sinh ra khí thải mà sinh ra nước, nước có thể được tái sử dụng hoặc sử dụng cho những mục đích khác.
Cho giá trị thế điện cực tiêu chuẩn của một số điện cực ở 25°C trong bảng sau:
2H2O + 2e → H2 + 2OH- E° = –0,414
O2 + H2O + 4e → 4OH- E° = +0,40
2H+ + 2e → H2 E° = 0,00
O2 + 4H+ + 4e → 2H2O E° = +1,23
(Cho biết: điện tích của 1 mol electron là 96500 C/mol; công thức: q = I.t, trong đó q là điện tích (C), I là cường độ dòng điện (A), t là thời gian (s)), công suất đầu ra P = U.I (W))
a) Phản ứng xảy ra tại cathode là 4H+ + O2 + 4e → 2H2O
b) Sức điện động chuẩn của pin là 0,43 V.
c) Một hệ thống pin nhiên liệu hydrogen được sử dụng để cung cấp năng lượng dự phòng cho một trạm viễn thông. Hệ thống này cần đảm bảo cung cấp một công suất điện ổn định là 5 kW. Điện áp đầu ra của khối pin nhiên liệu là 48 V. Hiệu suất tổng thể của pin nhiên liệu là 55%. Để duy trì hoạt động trong 24 giờ liên tục, hệ thống cần tiêu thụ 170 gam khí H2 (làm tròn kết quả đến hàng đơn vị).
d) Phản ứng xảy ra tại anode là 2H+ + 2e → H2.
Câu trả lời tốt nhất
(a) Đúng
(b) Sai:
Anode: H2 —> 2H+ + 2e
Cathode: 4H+ + O2 + 4e → 2H2O
E° = E°(cathode) – E°(anode) = 1,23V
(c) Đúng:
P = UI —> I = P/U
q = ne.F = It —> ne = It/F
nH2 = ne/2
mH2 = 2nH2
Kết hợp lại ta có mH2 = Pt/(UF)
Hiệu suất chỉ đạt 55% nên thực tế cần mH2 = Pt/(55%.UF) ≈ 170 gam
(d) Sai, tại Anode: H2 —> 2H+ + 2e

