Pin nickel cadmium (Ni-Cd) được phát minh từ năm 1899 bởi Waldemar Jungner, người Thụy Điển. Pin sạc Ni-Cd hoạt động dựa trên phản ứng:
Cd(s) + Ni2O3(s) + 3H2O(l) 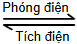 Cd(OH)2(s) + 2Ni(OH)2(s)
Cd(OH)2(s) + 2Ni(OH)2(s)
Pin gồm hai điện cực, một điện cực (kí hiệu điện cực (a)) làm bằng Cd phủ Cd(OH)2, điện cực còn lại ( kí hiệu là điện cực (b)) làm từ hỗn hợp Ni2O3 và Ni(OH)2 phủ trên Ni. Pin sử dụng chất điện li là dung dịch KOH 30%. Ở trạng thái ban đầu, pin không tích điện, người ta tích điện cho pin trong 1,0 h với hiệu điện thế phù hợp và cường độ dòng điện I = 0,5A. Biết điện lượng q = I.t. (I là cường độ dòng điện (A); t là thời gian điện phân (s)).
(1) Khi pin tích điện điện cực (a) là cathode, xảy ra quá trình khử.
(2) Khi pin phóng điện, điện cực (b) là cathode, xảy ra quá trình khử.
(3) Khi pin phóng điện, khối lượng của cả anode và cathode đều giảm đi.
(4) Phản ứng xảy ra tại anode là: Cd + 2OH- 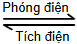 Cd(OH)2 + 2e.
Cd(OH)2 + 2e.
(5) Phản ứng xảy ra tại cathode khi pin phóng điện là: Ni2O3 + 3H2O + 2e → 2Ni(OH)2 + 2OH-.
(6) Điện lượng đã tích cho pin là 3600 C, biết hiệu suất quá trình là 100%.
Sắp xếp các câu đúng theo thứ tự tăng dần (ví dụ 134, 23,…).
Câu trả lời tốt nhất
Khi pin phóng điện:
+ Tại anode (a): Cd + 2OH- → Cd(OH)2 + 2e
+ Tại cathode (b): Ni2O3 + 3H2O + 2e → 2Ni(OH)2 + 2OH-.
Khi pin tích điện (xạc pin):
+ Tại anode (b) 2Ni(OH)2 + 2OH- → Ni2O3 + 3H2O + 2e
+ Tại cathode (a): Cd(OH)2 + 2e → Cd + 2OH-
(1)(2) Đúng
(3) Sai, khi pin phóng điện thì khối lượng anode tăng (do Cd chuyển thành Cd(OH)2), điện cực cathode giảm (do 2Ni(OH)2 chuyển thành Ni2O3).
(4) Sai, anode khi phóng điện sẽ trở thành cathode khi tích điện.
(5) Đúng
(6) Sai, q = It = 0,5.1.3600 = 1800C

